响应面法分析优化生地黄提取工艺研究
曹 瑞 张 红 师延琼 郑 蓓 崔春利 郭东艳
响应面分析法(response surface methology,RSM)是一种筛选工艺比较好的方法,能筛选各个因素和因素与因素之间相互作用在工艺优选中对评价指标即响应值的影响,可以表达因素和评价指标之间的关系[1]。和正交实验设计不同,可以通过软件拟合二项式模型,然后求得偏导数,得出较优参数,可以较好的反应出实验设计和结果表达[2]。目前,生地黄的提取多采用正交实验设计优化考察,本实验引入中心组合实验设计,结合效应面法优选生地黄的提取工艺,旨在优化水提取工艺的同时,为探讨中心组合实验设计-响应面法应用于中药提取工艺的可行性提供依据。
材料与方法
1.材料与仪器:生地黄(西安盛兴中药饮片有限责任公司,批号:111101),蒽酮(国药集团化学试剂有限公司,批号:20120701),梓醇对照品(中国药品生物制品检定所,供含量测定用,批号:110808-200508),葡萄糖对照品(20090201),95%乙醇、浓硫酸均为分析纯,甲醇、乙腈均为色谱纯,水为重蒸馏水。GB204梅特勒电子天平(瑞士制造);UV1102紫外分光光度计(上海天美科学仪器有限公司);日立L-2400型高效液相色谱仪(L-2130双泵,L-2400检测器,EZStart工作站);恒温水浴锅(HH-2型,北京科伟永兴仪器有限公司)。
2.样品中多糖与梓醇的含量测定:(1)多糖的含量测定:①对照品溶液的制备:精密称取105℃下干燥至恒重的葡萄糖,加蒸馏水配制成每1ml含0.054mg的溶液,即得;②供试品溶液的制备:精密移取提取液0.5ml至100ml量瓶中,并用蒸馏水定容至刻度,即得;③显色条件:加入新鲜配制的0.2%蒽酮试剂4ml,沸水浴15min,取出立即置冰水浴冷却20min,即得。(2)梓醇的含量测定:①色谱条件:色谱柱:Thermo-C18柱(250mm ×4.6mm,5μm)流动相:乙腈 -0.1% 磷酸水(1∶99),检测波长210nm,柱温30℃,流速1ml/min;②对照品溶液的制备:精密称取对照品适量,加流动相制成每1ml含0.154mg的溶液,即得;③供试品溶液的制备:精密移取提取液1ml,加蒸馏水定容至100ml量瓶中,0.45μm微孔滤膜滤过,即得。
3.单因素试验考察:(1)提取时间考察:分别称取生地黄饮片50g,加10倍量水,煎煮2次,煎煮时间分别为30、60、90、120、150min,过滤,合并滤液,浓缩至 100ml量瓶中。(2)加水倍量考察:分别称取生地黄饮片50g,煎煮时间为90min,煎煮2 次,加水倍量分别为8、10、12、14、16 倍,过滤,并将所得滤液浓缩至100ml量瓶中。(3)提取次数考察:分别称取生地黄饮片50g,煎煮时间为90min,加水量10倍,煎煮次数分别为1、2、3、4次,过滤,并将所得滤液浓缩至100ml量瓶中。
4.中心组合设计优选水提工艺条件:在煎煮时间、加水倍量、煎煮次数3个影响生地黄多糖和梓醇含量的单因素基础上,采用响应面法将这3个影响因素作为自变量,将生地黄多糖及梓醇综合加权含量进作为响应结果进行设计。综合评分=0.4W1/Wmax1+0.6W2/Wmax2,W1为多糖含量,Wmax1为多糖含量最大值,W2为梓醇含量,Wmax2为梓醇含量最大值。
5.统计学方法:采用Design Expert统计软件,数据资料用方差分析,以P<0.05为差异有统计学意义。
结 果
1.多糖含量测定线性范围:(1)检测波长的确定:取对照品溶液标准系列中含量为0.0486mg的葡萄糖对照品溶液。以相应试剂为空白对照,以200~800nm波长扫描,测定葡萄糖的最大吸收。结果葡萄糖在625nm波长处有最大吸收值。(2)线性关系考察:分别量取葡萄糖标准溶液 0、0.3、0.6、0.9、1.2、1.5、1.8ml置具塞试管中,加水至 2.0ml,加入新鲜配制的0.2%蒽酮试剂4ml,沸水浴15min,取出立即置冰水浴冷却20min,以相应试剂为空白,在625nm测定吸光度,以葡萄糖含量为横坐标,以测得的吸光度为纵坐标,计算回归方程为:Y=5.0988X+0.1334(R2=0.9995)。结果表明,在0.0162 ~0.0972mg的范围内线性良好。
2.梓醇含量测定线性范围:精密吸取梓醇对照品溶液 3、6、9、12、15、18μl,依“梓醇的含量测定”项下色谱条件进行测定,以梓醇的含量为横坐标,以测得的峰面积为纵坐标,计算回归方程为:Y=150045X+35910(R2=0.9997),结果表明,在 0.462 ~2.772μg的范围内线性关系良好。
3.单因素实验:(1)提取时间的考察:按照本文中“多糖的含量测定”项下方法及“梓醇的含量测定”项下方法分别制备供试品溶液,并依据上述显色条件及色谱条件,测定多糖及梓醇的含量。进行综合评分(即多糖含量权重系数为0.4,梓醇含量权重系数为0.6)。结果表明:加10倍量水,煎煮2次,每次煎煮90min时多糖及梓醇含量最高。结果见表1。(2)加水倍量考察:按照本文中“多糖的含量测定”项下方法及“梓醇的含量测定”项下方法分别制备供试品溶液,并依据上述显色条件及色谱条件,测定多糖及梓醇的含量。结果表明,煎煮2次,每次煎煮90min时,加10倍量水,多糖及梓醇含量最高。结果见表2。(3)提取次数考察:按照本文中“多糖的含量测定”项下方法及“梓醇的含量测定”项下方法分别制备供试品溶液,并依据上述显色条件及色谱条件,测定多糖及梓醇的含量。结果表明:加10倍量水煎煮90min,煎煮2次时多糖及梓醇含量最高。结果见表3。
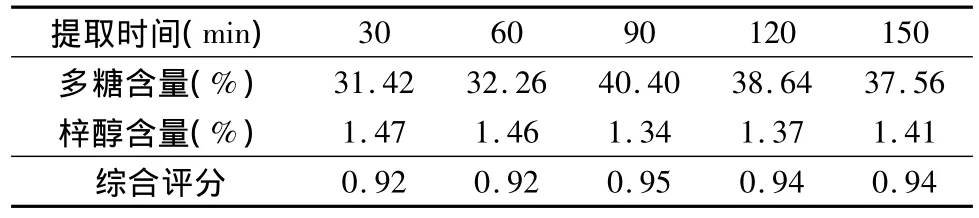
表1 提取时间考察结果
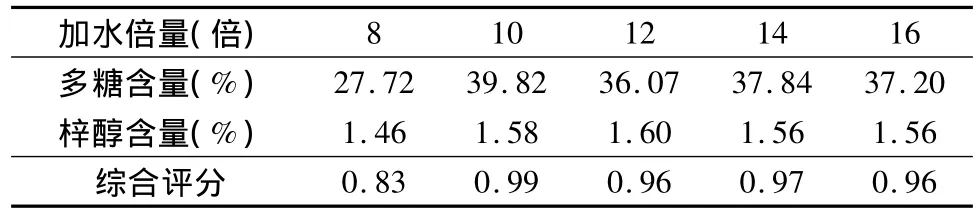
表2 加水倍量考察结果
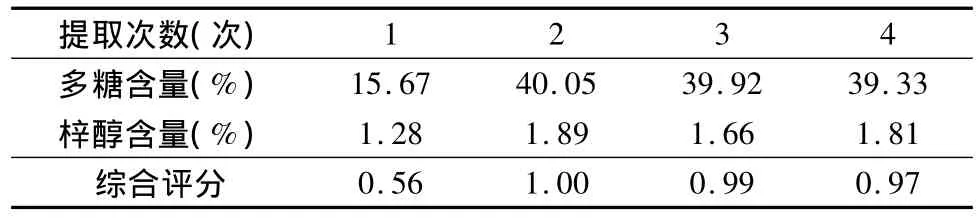
表3 提取次数考察结果
4.中心组合设计优选水提工艺条件:(1)实验设计的因素与水平表见表4,响应面试验方案及中心组合设计实验结果见表5。采用Design Expert软件对所得的提取回归模型方差分析结果见表6。回归方程中各个变量因素对加权含量响应值的显著性用F值来检验,F的值越小,相应的变量显著程度越高。从表7中可以看出,方程中X2(加水倍量)、X3(煎煮次数)、X1X2、(煎煮时间和加水倍量交互)(煎煮时间的二次方)、(加水倍量的二次方)、(煎煮次数的二次方)影响都比较显著,X1、(煎煮时间)X1X3、(煎煮时间和煎煮次数交互)X2X3(加水倍量和煎煮次数交互)没有显著性影响。在3个因素中,煎煮次数和加水倍量对生地黄多糖和梓醇的加权含量影响比煎煮时间对其的影响要大。此模型的P<0.0001,说明回归模型达到高度显著水平。失拟误差P=0.585,差异无统计学意义,说明该模型对试验拟合情况较好,试验存在误差较小,可以用此模型对水煎煮生地黄多糖及梓醇含量进行分析和预测。由Box-Behnken试验拟合出的多糖及梓醇加权含量Y对提取时间X1、加水倍量X2、提取次数X3的二次多项回归方程为:Y=0.91 -1.521E -003X1+8.649E -003X2+0.017X3+0.010X1X2+4.247E -003X2X3+(2)响应面优化与分析:根据二次多项式方程,分别绘制指标与响应显著的交互项的响应曲面图和等高线图,比较图1~图3中响应曲面图可知,煎煮时间和加水倍量的交互作用对生地黄多糖及梓醇含量的提取率为最显著,表现为响应面曲面,故煎煮时间和加水倍量的调整对生地黄多糖及梓醇含量的影响较大。煎煮次数与其他两因素的交互作用不及煎煮时间和加水倍量的交互作用明显。由Design Expert软件给出了最佳条件为:提取时间为117.53min,加水倍量为13.75倍,提取次数为2次,预测的最佳提取率加权评分为0.81。但是根据实际情况及可操作性,调整的最佳提取工艺条件为提取时间120min,加水倍量14倍,提取次数2次。
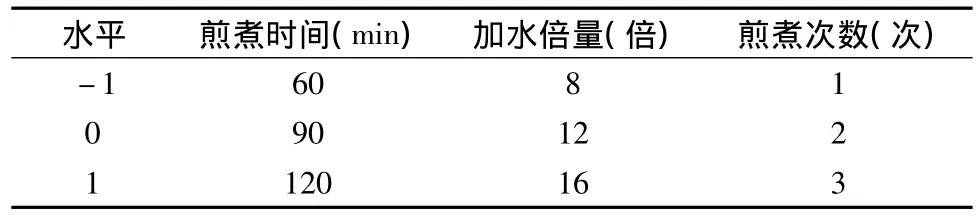
表4 因素与水平
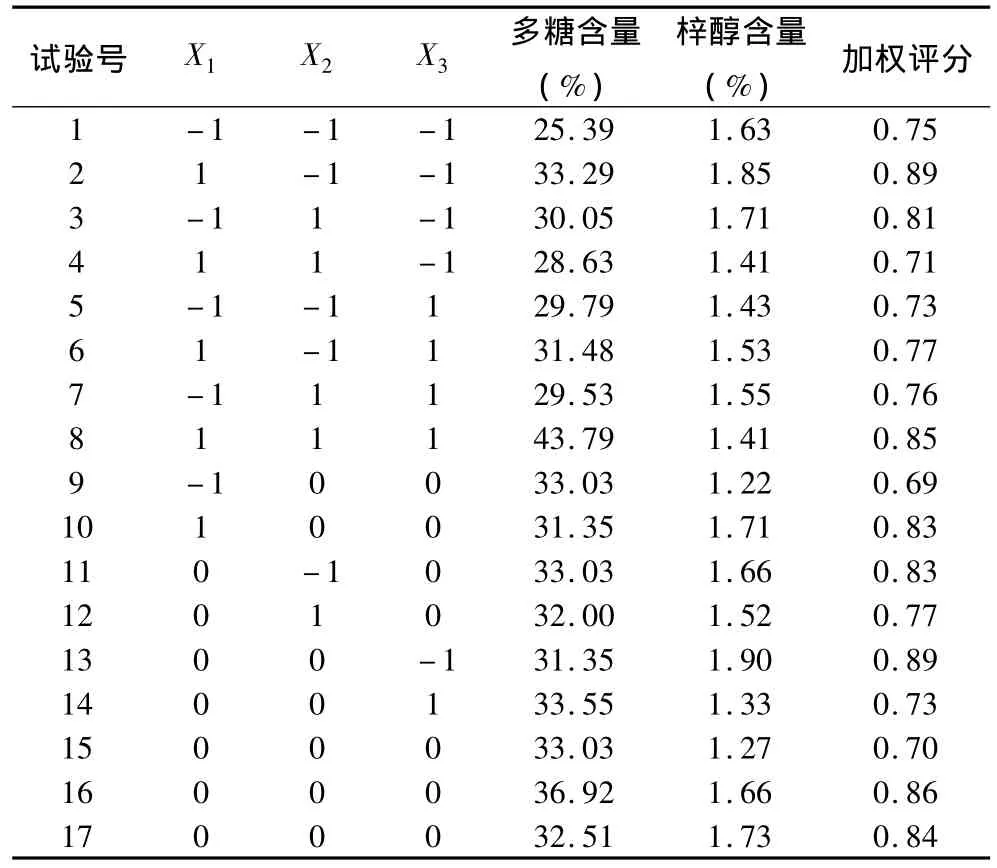
表5 试验设计与结果
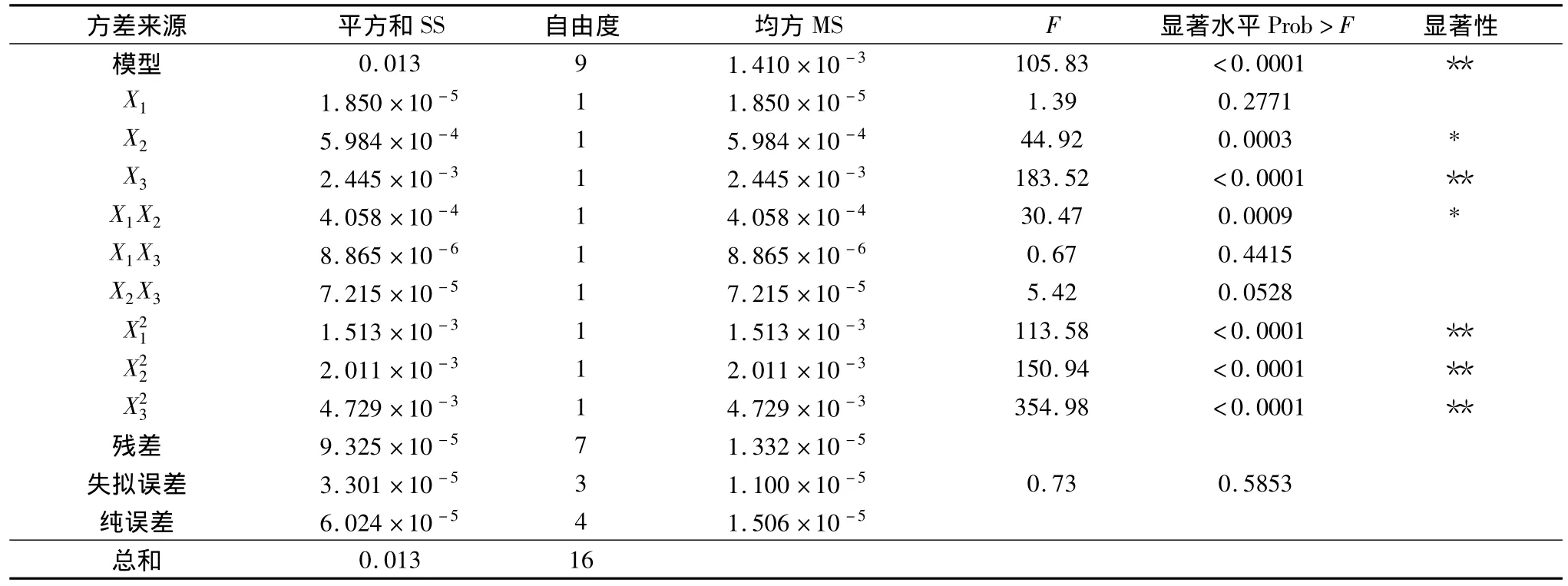
表6 回归方程方差分析
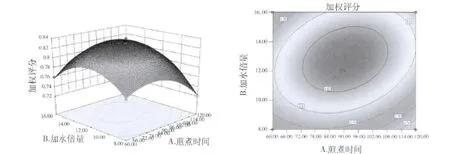
图1 煎煮时间和加水倍量对加权含量的影响
5.验证试验:按修正过的最佳条件进行3次重复试验,3 个平行实验的综合评分分别为0.79、0.80、0.82,平均值为0.80。与预测值基本一致,可见响应模型可以较好的反映出生地黄多糖及梓醇的提取的条件。
讨 论
本实验以生地黄中主要成分梓醇及多糖含量的综合评分作为评价指标,采用中心组合实验设计-响应面法优选最佳水提取工艺研究。确定了最优的水提取条件为:加14倍倍量水,提取2次,每次120min。验证实验结果表明,该工艺稳定可行。

图2 加水倍量和煎煮次数对加权含量的影响

图3 煎煮时间和煎煮次数对加权含量的影响
生地黄中主要含有多糖和环烯醚萜苷类成分,提取工艺的评价指标也多为多糖和梓醇的含量。多糖及环烯醚萜苷类都为极性比较大的成分,且水溶性较强,根据相似相溶原理及相关些文献报道,最终选择水作为提取溶媒,以多糖及环烯醚萜苷中主要成分梓醇的含量作为综合评价指标。考虑到多次提取会提高多糖提取率,但因环烯醚萜苷类对热不稳定,不能长时间煎煮,实验设计中考虑到这些因素,对生地黄的提取时间、提取次数、溶媒用量进行设计,优选合理的提取条件。
对环烯醚萜苷类化合物含量测定的报道较少,文献报道的方法有对二甲氨基苯甲醛显色-分光光度法、二阶导数分光光度法,紫外分光光度法[3~6]。本实验曾采用二甲氨基苯甲醛显色-分光光度法,以梓醇为对照品,经酸水解,二硝基苯肼乙醇试液和NaOH 70%乙醇溶液显色后在463nm处测定其含量[7]。本研究结果显示,此方法显色复杂,所得数据差异较大,稳定性及重复性差,说明此反应不稳定,其中影响因素过多,不易操作,且测定的含量远远小于实际含量。文献报道中提出可对地黄中的总环烯醚萜类成分——梓醇进行测定,其在210nm附近有最大吸收,从而对其水溶液直接采用紫外测定。但在实验中,因很多物质在210nm都有吸收,加上药液本身的颜色,种种因素都会对结果有较大的影响,最后导致了我们在实验中测定的含量远高于实际含量,所以这个方法对于测定环烯醚萜的含量也不是很合适。因此,最终决定采用环烯醚萜苷中的主要成分梓醇作为评价总环烯醚萜苷含量的指标。
1 Li QH.Application of response surface methodology for extraction optimization of germinant pumpkin seeds protein [J].Food Chemistry,2005,92(4):701 -706
2 魏安池,代红丽,谷文英.响应面分析法优化红花黄色素提取工艺条件[J].食品与机械,2006,22(2):11-13
3 李茂星,贾正平,沈涛,等.分光光度法测定藏药独一味及其制剂中总环烯醚萜苷的含量[J].中药新药与临床药理,2010,17(1):45-47
4 王雷琛,王秀鑫,汪硕闻,等.用二阶导数光谱法测定栀子中总环烯醚萜苷的含量[J].药学服务与研究,2010,10(3):205-207
5 郝婷,张树峰,赵桂琴.素馨花总环烯醚萜苷质量标准的研究[J].时珍国医国药,2013,24(1):69-71
6 崔春利,王月茹,王敏,等.秦艽药材及其提取物中总裂环环烯醚萜苷的含量测定[J].陕西中医学院学报,2011,34(6):75-77
7 王维,戴晓燕.筋骨草中总环烯醚萜苷的提取动力学研究[J].中国现代应用药学,2012,29(9):808-811

