适用于野生软枣猕猴桃遗传多样性分析的SSR引物筛选
覃 瑞,赖娟娟,李作洲,满玉萍,王彦昌,*
(1中南民族大学 生命科学学院,武汉 430074;2中国科学院 武汉植物园, 植物种质创新与特色农业重点实验室,武汉430074)
软枣猕猴桃(Actinidiaarguta)为猕猴桃属多年生木质藤本植物[1],是该属下进化地位较为原始的一个物种.其果实小,果面光滑无毛,富含多种人体必要的氨基酸、矿物质和维生素,除可用于鲜食外,还是果汁、罐头、果脯及酿酒的优质原料[1,2].我国和其他东北亚地区是软枣猕猴桃野生资源的主要分布区[3],该种是猕猴桃属下分布范围最广的物种,野外变异极为丰富.研究野生软枣猕猴桃的遗传多样性对了解不同地区软枣猕猴桃起源、进化、种植收集利用与保存均具有重要意义.
目前对该物种的遗传多样性了解有限,尤其对各分布区野生居群的遗传评价较少.路文鹏[4]、黄岳等[5]利用RAPD技术对长白山小范围分布的少量样本进行了初步研究,但涉及取样范围小,不能代表一个地区整体或不同区域间的资源遗传分化.而近年DNA标记技术的迅速发展为猕猴桃属植物的系统关系等研究提供了手段,其中SSR(简单重复序列)标记在植物的品种和亲缘关系鉴定等方面得到了广泛的应用.SSR比其他分子标记具有位点丰富、共显性、简便易操作、重复性和稳定性好等显著优势[6].在主要栽培种中华猕猴桃中,已开发了大量SSR引物,但适用于野生软枣猕猴桃居群遗传多样性评价的SSR引物还较缺乏,在我们前期筛选的软枣猕猴桃引物基础上[7],本研究进一步优化扩增条件,筛选出了多态性较好适合软枣野生居群分析的SSR引物,为该物种大格局遗传多样性研究提供了有效的分子工具.
1 材料与方法
1.1 材料和仪器
从来自陕西眉县、户县、吉林露水河、天全县二郎山、陕西安康等5个软枣猕猴桃(Actinidiaarguta)野生居群中随机选择8份样本作为扩增筛选的样品.引物筛选完成后,从天全县二郎山选取15个样品对筛选出的引物进行验证分析,样本分布的地理位置:经度在29°54′54.65″~29°57′30.44″,纬度在 102°22′51.34″~102°24′32.61″,海拔高度在1316.7~1463.9m之间.
PCR扩增仪[TC-96/G/H(b)A,杭州博日科技有限公司],电泳仪(DYCZ-20E型,DYY-12型,北京六一仪器厂),离心机(eppendorf centrifuge5810),恒温水浴锅(普瑞斯机械有限公司),成像凝胶系统(Tanon 2500R),高压灭菌锅(HIRAYAMA),电子天平(上海浦春计量仪器有限公司).
1.2 方法
1.2.1 DNA提取
取0.2 g软枣猕猴桃叶片放入事先预冷的研钵中,加入液氮快速研磨后用经典CTAB法[8]加以改进提取DNA.加入100 μL TE缓冲液于4℃下溶解DNA -20℃备用.
1.2.2 引物选择
从来自于中华猕猴桃二倍体基因组SSR中选择65对SSR引物[9]用于野生软枣猕猴桃的SSR筛选.
1.2.3 PCR反应
PCR反应采用10 μL反应体系,50~100 ng模板DNA 2 μL,10×buffer缓冲液1μL, MgCl20.6 μL,4×dNTPs 0.2 μL,SSR引物上游引物和下游引物各0.1 μL, Taq DNA 聚合酶0.1μL.用降落PCR进行扩增,反应程序为:①95℃预变性5 min;②94℃变性50 s;③61℃退火50 s;④72℃延伸1 min;②~④5个循环,每个循环中退火温度降1℃;⑤94℃变性50 s;⑥56℃退火50 s;⑦72℃延伸1min;⑤~⑦35个循环;⑧72℃保温8min;⑨4℃保存样品.
1.2.4 电泳检测
通过琼脂糖凝胶电泳检测PCR产物,通过凝胶成像系统观察,将没有扩增出来或者扩增率低于60%的引物剔除,将扩增率高于60%的引物在6%聚丙烯酰胺非变性凝胶上电泳分离1.5 h(恒定功率55W),银染检测.
1.2.5 群体验证
从天全二郎山选取15个样品对即将筛选出的引物进行验证分析,将每对引物分别对应该15个样品进行SSR-PCR扩增,在6%聚丙烯酰胺非变性凝胶上电泳分离1.5h(恒定功率55W),读取带型.
1.2.6 SSR数据分析
所有材料各SSR位点的不同等位变异在聚丙烯酰胺凝胶上均表现为谱带的有或无,将“有”赋值为“1”,将“无”赋值为“0”,构建15对SSR引物扩增结果的数据库,参考Korkovelos等的数据分析方法[10].通过treev32软件进行个体聚类NJ数的构建.
2 结果与分析
2.1 猕猴桃DNA质量检验
对所有样品进行琼脂糖检测,结果见图1.图1中显示为一条完整的清晰带,没有明显的拖尾,也未见RNA条带,说明DNA提取质量高.完整性好[11],可用于SSR引物的筛选分析和其他相关试验.

M) DNA Marker;1~18) 依次为:MQL-1,MQL-15,HQL-12,LSH-4,DBS-1,TYA-1,TYA-3 T,TYA-5、8~11、13、15~19
2.2 引物的初步筛选
将65对选定的引物对来自不同群体的8个DNA样品进行PCR扩增,扩增结果通过1%的琼脂糖凝胶电泳检测,剔除未扩增出条带的引物,结果见图2、图3.如图2所示,引物UDK-125对应的8个样品均能扩增出来,引物UDK-131和引物UDK-158中有1~2个样品未扩增出产物,选择的引物进入第二轮筛选;如图3所示,引物UDK-127,UDK-132,UDK-154对应的8个样品只有0~3个能扩增出来,故剔除.最终选出32对扩增产物较好的引物.
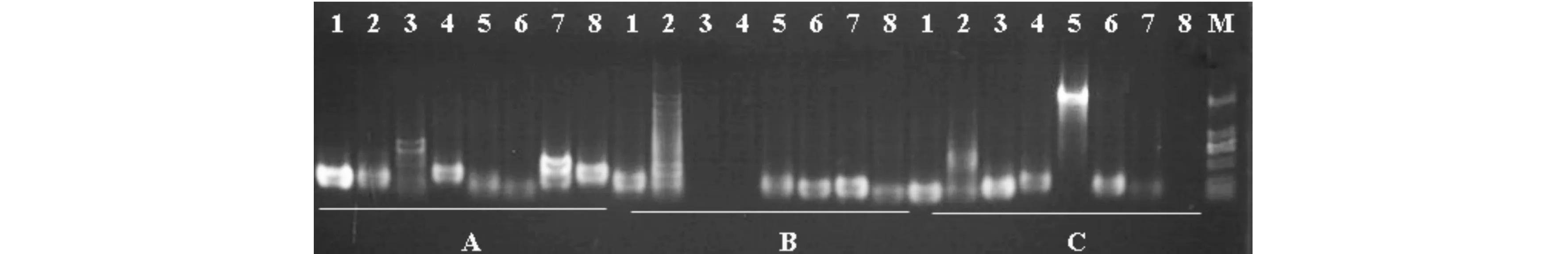
M) DNA Marker; 1~8)依次为:MQI-1、16,HQL-12、25,TYA-1、18,LSH-13,DBS-20;A~C依次为:UDK-125,131,158

M) DNA Marker; 1~8)依次为:MQI-1、16,HQL-12、25,TYA-1、18,LSH-13,DBS-20;A~C依次为:UDK-127,132,157
将选出的32对引物进行聚丙烯酰胺凝胶电泳检测(见图4),8个样品中扩增率大于等于38%的引物可用,扩增率低于38%的引物剔除.引物UDK-125、UDK-128、UDK-131扩增率均大于80%,而引物UDK-126扩增率则低于38%,故剔除.结果发现其中15对引物有扩增,3对引物的扩增率88%,3对引物扩增率75%,5对引物扩增效率为62%,2对引物扩增效率为50%,2对引物扩增效率为40%,其中1对引物扩增出的带型为单一条带即为单态性,其它14对均为多态性.筛选出的引物信息如表1.

M) 25bp ladder;125,126,128,131)依次为:UDK-125,UDK-126,UDK-128,UDK-131

表1 软枣猕猴桃SSR分子标记可用引物序列和退火温度
2.3 筛选引物在雅安天全二郎山软枣猕猴桃群体样本中的验证
用筛选出的15对引物对二郎山软枣猕猴桃的15个单株样品进行SSR分析(见表2),每对引物都能扩增,总共扩增141个等位基因,平均等位基因数为9.4个,2对引物中有亚等位基因,扩增的等位基因数最多的18个,最少的2个,平均PIC值为0.745.引物UDK-125扩增的片段最长,引物UDK-099扩增的片段最短.同一个样品在不同的引物中,等位基因数变变异较大,最低有5个不同的等位数,最多8个不同等位基因数;而同一个引物在不同样品中,等位基因数变化范围较小.

表2 二郎山15个样品的SSR分析
筛选出的15对引物通过treev32软件对天全二郎山15个个体作个体聚类NJ树(见图5),可将雅安天全二郎山15个个体分成三大组;TYA-11、1、8、5可聚为第一组,TYA-13、17、15、3、10、20、19可聚为第二组,TYA-6、18、9、16可聚为第三组;在第一组中TYA-8与TYA-5距离较近,第二组中的TYA-17与TYA-15,TYA-3与TYA-10,TYA-20与TYA-19之间的距离较近,第三组中TYA-6与TYA-18,TYA-9与TYA-16之间的距离较近;可推测这些距离较近的个体间亲缘关系较近.
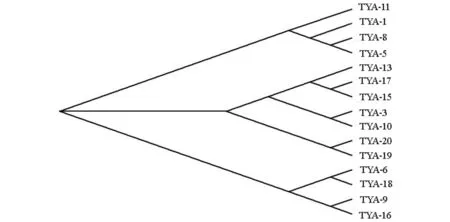
图5 二郎山15个个体的聚类NJ树
3 讨论
由于软枣猕猴桃叶片中含有较多的糖分,用传统的CTAB法不能提取高质量的DNA.本文在传统CTAB提取DNA的过程中有所改进,在研磨样品以后不直接加入CTAB,而是先加入山梨醇洗液,尽量将叶片中释放的糖分去掉,之后再加入CTAB裂解液,再回到传统的步骤上[8].改进后提取的软枣猕猴桃基因组DNA条带清晰,没有明显拖尾,后期做SSR扩增反应过程中,效果较好.
Testolin 等[9]利用中华猕猴桃基因组筛选出一批SSR引物最初用于遗传作图.根据前期已经报道的从中华猕猴桃到软枣猕猴桃SSR引物具有较高的通用性.本研究从来自不同地理居群中的少量样本提取DNA,利用Testolin等[9]开发的中华猕猴桃65对SSR引物进行扩增,用琼脂糖胶筛选出在多数样本中有扩增条带的引物32对,再利用6%的聚丙烯酰胺凝胶电泳进行筛选,得到有效引物引物15对,其中2对引物中有亚等位基因,1对引物具有单态性.本研究获得的数据显示,从中华猕猴桃到软枣猕猴桃,基因组SSR引物的通用性为23%,而在Man等[7]研究得出两个物种间SSR引物通用性可达到42%,该差异可能是由于软枣猕猴桃野生居群的遗传差异或者各自检测的SSR在基因组上的分布差异所致. 筛选出的15对引物通过treev32软件对天全二郎山15个个体作个体聚类NJ树,可将这些个体分成三大组及六个不同的小组,从而清楚的得出个体与个体之间的亲缘关系.在软枣猕猴桃基因组还未测序的前提下,可使用目前已经公布的中华猕猴桃EST库和新近公布的“红阳”基因组序列[9],开发出大量可用于软枣猕猴桃资源评价及遗传鉴定的可用标记.
本文在二郎山群体测试的平均PIC值为0.745,甚至高于Korkovelos等[10]在不同物种水平的PIC值,这可能是由于后者研究选择的引物少(8对)所致,某些SSR片段属于基因组中变异极高的区段,即使在物种内居群水平上也具有很高的多态性,故选择不同引物也必然会导致多态性变化.
由黄岳等[5]对长白山局部取样的软枣猕猴桃的RAPD分析可知,长白山地区的软枣猕猴桃多样性较高[5].本文利用SSR标记对四川天全二郎山地区的野生软枣猕猴桃进行分析,获得的多样性指数较高,说明我国东北地区和西南地区软枣猕猴桃资源的遗传多样性均较高,但由于采用的标记不同,无法平行比较,需要对跨区域居群样本进一步统一分析,才能了解各地区软枣猕猴桃资源遗传多样性水平.此外,对我国软枣猕猴桃资源的遗传评价研究中还需要进一步扩大居群数量和取样范围,以获得更准确的结论.
[1] 朴一龙,赵兰花. 软枣猕猴桃研究进展[J]. 北方园艺,2008(3): 76-78.
[2] 朴一龙,朴日子. 野生软枣猕猴桃离体培养体系的建立及优化[J]. 北方园艺,2011(15): 60.
[3] 朴一龙,赵兰花. 延边地区软枣猕猴桃资源分布和开发利用前景 [J]. 延边大学农学学报,2009,31(1): 32-35.
[4] 路文鹏,李昌禹,曲炳章,等. 东北原生种猕猴桃种质RAPD研究[J]. 特产研究,2006,28(2): 24-27.
[5] 黄 岳,朴一龙,王 琳. 长白山区野生软枣猕猴桃种质RAPD分析[J]. 延边大学农学学报,2009,31(2): 119-123.
[6] 郑轶琦,李作洲,黄宏文. 猕猴桃品种 SSR 分析的初步研究[J]. 武汉植物学研究,2003,21(5): 444-448.
[7] Man Y,Wang Y,Zhang L,et al.Development of microsatellite markers inActinidiaarguta(Actinidiaceae) based on the NCBI data platform[J]. Am J Bot,2011,98(11): e310-e315.
[8] 李思光,罗玉萍,陈万秋,等. 猕猴桃基因组 DNA 的提取及其 RAPD 扩增研究[J]. 南昌大学学报:理科版,2001,25(3):264-268.
[9] Testolin R,Huang W G,Lain O,et al. A kiwifruit (Actinidia spp.) linkage map based on microsatellites and integrated with AFLP markers[J]. TAG,2001,103(1): 30-36.
[10] Korkovelos A E,Mavromatis A G,Huang W G,et al. Effectiveness of SSR molecular markers in evaluating the phylogenetic relationships among eight Actinidia species[J]. Sci Hortic,2008,116(3): 305-310.
[11] 魏艳霞,豁泽春,王 飞,等. 野生猕猴桃 DNA 的提取及 RAPD 分析体系的建立[J]. 西北农业学报, 2008,17(2): 169-173.

