木瓜蛋白酶诱导骨关节炎模型中病理指标的动态变化
唐和斌,李婷婷,杨燕京,陈倍璠,马汝玉,颜海燕,李玉桑,奉黎静
(中南民族大学 药学院,武汉 430074)
骨关节炎(osteoarthritis,OA)是一种以关节软骨损伤、缺失并伴有周围骨病变为特点的退行性病变,主要表现为软骨表面纤维化、软骨细胞和基质蛋白多糖丢失、胶原基质破坏、软骨下骨外露及骨赘形成等[1].它是全球成年人最常见的骨性关节疾病,也是引起中老年人关节疼痛和致残的主要原因[2].理清OA模型中相关病理指标的动态变化对认识OA的形成、发展至关重要[3].关节腔内注射木瓜蛋白酶可诱导兔、豚鼠等动物髋关节或膝骨关节炎,具有发病快、重复性好、与人类骨关节炎类似等特点,是常用的造模方式[4,5].目前对OA相关病理指标的研究主要围绕多个指标进行单一时间点的相关检测[6],对多个时间点的检测也仅仅针对1~2个指标[7],未全面涉及OA模型的疼痛指标检测、疼痛行为学反应、炎症因子、软骨大体观察评分和一般组织病理学指标的连续变化.故本实验通过关节腔内注射木瓜蛋白酶诱导OA动物模型,检测上述相关病理指标以探讨OA大鼠关节炎形成过程中的动态变化.
1 材料和方法
1.1 试剂、仪器和动物
木瓜蛋白酶(美国Amresco),Rat IL-1β Platinum Elisa试剂盒(美国Ebioscience),甲苯胺蓝(上海源叶生物科技),沙黄O(德国Applichem),生理盐水(武汉滨湖双鹤药业).
手持式测痛仪(北京硕林苑),游标尺寸(上海台海),多功能酶标仪(瑞士Tecan),脱水机、包埋机、切片机、摊片机、烘片机(德国莱卡).
36只雄性Wistar大鼠(体重210~250 g,SPF级,4200695675,湖北省食品药品安全性评价中心).
1.2 OA大鼠动物分组及模型建立
36只成年雄性Wistar大鼠随机分为A、B两大组,A组为对照组(18只),B组为模型组(18只);其中A1、A2、A3分别为造模结束后第1、2、3周对照组(每组6只),B1、B2、B3分别为造模结束后第1、2、3周模型组(每组6只).
造模开始第1、4、7 d,于模型组大鼠左膝关节腔内注射4%木瓜蛋白酶生理盐水溶液,每次注射量为100 μL,诱导OA大鼠模型[8].对照组大鼠左膝关节于上述时间点注射等量生理盐水,作为正常对照.各组别分别于造模结束后第1、2、3周处死动物采集样品,期间进行疼痛指标检测及疼痛行为学反应观察、关节滑液中,IL-1β含量检测、关节软骨大体观察评分、一般病理学检测.无菌关节腔注射,注射前后以1%碘伏原液消毒.
1.3 疼痛指标检测及疼痛行为学反应观察
各组大鼠处死前检测左膝关节的肿胀程度、压痛阈值和大鼠行走疼痛记分.剃去左膝膝关节处毛发,运用游标卡尺测量大鼠左膝膝关节直径宽度,以表明关节肿胀程度;运用压痛仪按压大鼠左膝膝点,当大鼠首次出现剧烈挣扎,显示即为压痛阈值,并计算相对压痛阈值;于大鼠左右脚掌上均匀印上颜色深浅一致的印泥,于自制半封闭式大鼠行走通道上行走0.4 m,拍下脚掌印记照片,5人独立的按照如下记分标准就脚掌照片进行行走疼痛记分(当肢体出现疼痛反应,大鼠以爪子的最小接触面积运动,可减小患肢压力,而当左右脚着力不均、步态发生改变时,则表现为脚掌颜色深浅不一[9]).
疼痛记分标准如图1所示,脚掌分为4个区域:若左脚掌的1个区域颜色深于右脚掌,记1分;若有2个,记2分;依次累计(0~4分),如图1可判为4分.
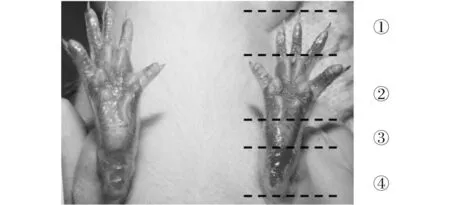
①脚趾,②前脚掌,③后脚掌,④脚后跟
1.4 样本采集及制备
处死大鼠,切开左膝关节,暴露关节囊,抽取0.4 mL生理盐水关节腔灌洗液,-80℃保存,待检测关节滑液中IL-1β含量.切开关节囊,去除滑膜、交叉韧带和半月板,暴露关节面,拍下软骨正面观,待大体观察评分.截取左膝关节,10%福尔马林固定,待染色评分.
1.5 关节滑液中IL-1β含量检测
Elisa方法测定左膝关节滑液的炎症因子IL-1β含量.
1.6 膝关节软骨大体观察评分
5人独立的按照以下评分标准就大鼠左膝软骨正面观进行评分[10]. 0分:软骨表面光滑呈无色半透明状;1分:软骨表面光滑,但有瑕疵;2分:软骨表面光滑,呈乳白不透明状;3分:软骨表面不光滑,呈乳白不透明状;4分:软骨缺失,伴软骨下骨外露.
1.7 关节软骨一般组织病理学检测
关节软骨固定后,经10% EDTA室温脱钙,常规脱水、透明、浸蜡、包埋,甲苯胺蓝染色和沙黄O染色[11].5人独立的按照Mankin′s评分标准[12]就染色图片评分(0~10分).
1.8 统计学方法
多组之间采用SPSS 19.0的Two-way ANOVA中的Dunnett进行分析.
2 结果
2.1 疼痛指标检测及疼痛行为学反应观察
2.1.1 关节肿胀程度测定
左膝关节肿胀程度结果见图2.如图2所示,造模结束后第1、2、3周,模型组均出现明显肿大现象,以第1周最明显,说明造模后大鼠出现较严重关节肿大现象,而第2、3周肿大情况缓解.

与对照组比较: **P<0.01, ***P<0.001;## 与第1周模型组比较: P<0.01
3.1.2 关节相对压痛阈值的测定
左膝关节相对压痛阈值结果见图3.由图3可见,第1周模型组相对压痛阈值明显降低,说明造模后大鼠出现明显机械诱发疼痛,而第2、3周阈值均升高,其中第3周升高较明显,第2、3周升高较第1周明显.

与对照组比较:*P<0.05,***P<0.001;###与第1周模型组比较:P<0.001
3.1.3 行走疼痛记分的测定
行走疼痛记分结果见图4.由图4可见,各周模型组的疼痛记分均增加,无统计学差异,第2、3周均较第1周模型组升高明显.

#与第1周模型组比较: P<0.05
3.2 关节滑液中IL-1β含量检测
左膝关节滑液中炎症因子IL-1β含量测定结果见图5.图5中各周模型组含量均升高,以第1周升高明显,第2周达峰值,第3周降低.
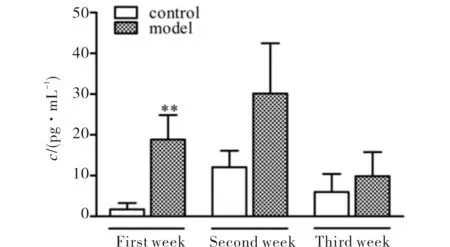
** 与对照组比较: P<0.01
3.3 关节软骨大体观察评分及一般组织病理学检测
3.3.1 关节软骨大体观察评分
左膝关节软骨正面观的代表图见图6.由图6可见,第1、2、3周,对照组软骨表面均呈无色半透明状,光滑且无明显病变症状;而模型组多有软骨变薄,出现血丝,逐渐加重,第3周软骨表面有磨损缺失现象,的趋势,说明软骨表面损伤较严重.

A~C) 对照组1、2、3周;D~F) 模型组1、2、3周
图7为左膝关节软骨大体观察评分.由图7可见,各周模型组关节软骨大体观察评分均随时间明显升高,表明软骨表面损伤,逐渐加重.

与对照组比较: *P<0.05,***P<0.001; ##与第1周模型组比较:P<0.01
3.3.2 关节软骨光镜下Mankin′s评分
图8、9分别为左膝关节软骨甲苯胺蓝染色和沙黄O染色的代表图.由图8、9可见,第1、2、3周,对照组软骨组织结构完整、排列规则、无细胞增生现象、着色较为均匀;而各周模型组软骨组织结构较紊乱,细胞增生、着色降低,软骨表面有破损,且逐渐加重.

A~C) 对照组1、2、3周;D~F) 模型组1、2、3周
表1为左膝关节软骨光镜下Mankind′s评分结果(0~10分).第1、2、3周,对照组记分逐渐升高;与相应对照组比较,各周模型组评分值均明显升高,结合相应的组织一般病理学检测,表明模型大鼠的软骨损伤严重.
与对照组比较:**P< 0.01,***P< 0.001
3 讨论
本文通过对木瓜蛋白酶诱导OA模型大鼠的疼痛指标检测、疼痛行为学反应观察、关节滑液中IL-1β含量、软骨大体观察评分和软骨一般病理学等指标的检测,进行了木瓜蛋白酶诱导骨性关节炎模型的动态变化研究.
通过测定疼痛指标及疼痛行为学反应观察,反映OA形成过程中疼痛反应的动态变化. 造模结束后第1周,造模组的关节明显肿大且压痛阈值降低,第 2、3周的肿胀现象有所缓解,但压痛阈值反而逐渐升高.软骨本身不受神经支配,不能感知疼痛,而OA疼痛主要来源于非软骨的关节内和关节周围组织结构,如边缘骨增生导致的骨膜掀起,暴露的软骨下骨压力升高等[13,14];机械诱发疼痛仅针对接触部位检测,对OA疼痛检测并不完全故本文通过行走疼痛记分从机体整体步态上评估OA疼痛反应,可避免一般机械诱发疼痛,能客观、快速地量化多个指标[9,15].疼痛记分结果显示:各周模型组疼痛记分逐渐增加,说明木瓜蛋白酶诱导OA模型出现了明显的疼痛反应,且有逐渐加重的趋势.
通过检测关节滑液中IL-1β含量水平,反映OA形成过程中关节腔内炎症因子的动态变化.Elisa结果显示造模后出现急性炎症,且于第2周达到峰值.第1、2周,关节腔内出现急性炎症,而第3周可能随基质蛋白和肉芽组织的形成,急性炎症得以缓解,IL-1β含量回落[7,8].IL-1β在OA病理过程中能促进软骨基质的降解和软骨细胞的破坏,其在关节腔内的高表达与关节内组织的急性炎症和急性损伤有关[16],故需进一步检测关节软骨大体观察和Mankin′s评分以判断软骨损伤情况.
结果第1、2、3周,模型组的两项评分均明显升高,且有逐渐加重的趋势,说明软骨表面损伤较为严重,一般组织病理学特征有较明显变化,且不断加重.而IL-1β含量水平并不随软骨损伤的进行性加重而不断升高[7],而是在第2周出现峰值后回落.
综上所述,木瓜蛋白酶诱导OA模型形成过程中,出现明显步态变化,同时软骨损伤与疼痛行为学变化趋势相一致,与IL-1β含量变化趋势不一致,而IL-1β的变化趋势与关节肿胀程度、相对压痛阈值变化趋势较为接近.提示木瓜蛋白酶诱导OA模型形成初期(1~2周),出现了较为严重的急性炎症反应,患处分泌的炎症因子明显增多、肿大、相对压痛阈值降低,而随着急性炎症的缓解(2周后),炎症因子含量回落,患处消肿,相对压痛阈值回升,但OA进程并未停止,软骨损伤的深层病变随OA进程不断加重,并从整体上反映为肢体步态变化.本文的炎症、疼痛等相关指标动态变化检测可为骨性关节炎的机制探讨和OA治疗药物的药理学评价提供实验依据.
[1] 李小军,汪 巍,汪 晖,等. 甘草多糖抗骨关节炎作用及其机制研究[J]. 中国药理通讯,2009,26(2):51.
[2] 高曙光,徐文硕,曾凯斌,等. 膝骨关节炎滑液和软骨骨桥蛋白水平与其病变程度的相关性[J]. 中华骨科杂志,2010,30(7): 672-675.
[3] Young M F. Mouse models of osteoarhritis provide new research tools[J]. Trends Pham acol Sci,2005,26(7): 333-335.
[4] Havdrup T,Telhag H. Papain-induced changes in the knee joints of adult rabbits[J]. Acta Orthop Scand,1977,48(2): 143-149.
[5] Kopp S,Mejersjo C,Clemenssson E. Induction of osteoar-
throsis in the guinea pig knee by papain[J]. Oral Surg Oral Med Oral Pathol,1983,55(3): 259-266.
[6] 傅 欣,林 霖,张继英,等. 骨性关节炎兔关节软骨、关节液细胞因子IL-1β和TNF-α变化的研究[J]. 中国运动医学杂志,2007,26(6): 709-713.
[7] 周 斌,樊粤光,曾意荣. 中药关节康对骨性关节炎软骨TGF-β1、IL-1β表达的影响[J]. 中国中医骨伤科杂志,2009,17(2): 11-13.
[8] 孙鲁宁,黄桂成,赵燕华,等. 木瓜蛋白酶诱导兔膝关节骨关节炎模型滑膜中白细胞介素1、白细胞介素6、白三烯浓度变化与药物注射时间的关系[J]. 中国组织工程研究,2012,16(33): 6184-6188.
[9] Dorien H,Frank F T. ‘CatWalk′ automated quantitative gait analysis as a novel method to assess mechanical allodynia in the rat; a comparison with von Frey testing[J]. Pain,2003,102(1/2): 203-209.
[10] Takeshita N,Yoshimi E,Hatori C,et al. Alleviating effects of AS1892802,a Rho kinase inhibitor,on osteoarthritic disorders in rodents[J]. J Pharm Sci,2011,115(4): 481-489.
[11] 高改霞,卫小春,李 凯,等. 鼠膝关节软骨不同染色方法的差异[J]. 中国组织工程研究与临床康复,2010,14(24): 4385-4389.
[12] Gerwin N,Bendele A M,Glasson S,et al. The OARSI histopathology initiative-recommendations for histological assessments of osteoarthritis in the rat[J]. Osteoarthritis Cartilage,2010,18(Sup): S24-S34.
[13] 耿晓鹏,陈百成,王 霞,等. 软骨下骨髓水肿与膝骨关节炎疼痛相关性的影像学研究[J]. 中华骨科杂志,2005,25(11): 682-686.

[15] Bove M S,Calcaterra M S,Kilgore K,et al. Weight bearing as a measure of disease progression and efficacy of anti-inflammatory compounds in a model of monosodium iodoacetate-induced osteoarthritis[J]. Osteoarthritis Cartilage,2003,11(11): 821-830.
[16] 吴红娟,孙必强,邱赛红,等. 盐酸青藤碱对家兔骨关节炎关节液IL-1β、PGE2生成与关节组织结构的影响[J]. 湖南中医药大学学报,2010,30(9): 84-86.

