鼠疫菌OxyR蛋白对katY的转录调控机制
倪 斌,张义全,黄新祥,杨瑞馥,周冬生
2.军事医学科学院微生物流行病研究所,病原微生物生物安全国家重点实验室,北京 100071;Email:nibinyl@gmail.com
鼠疫是由鼠疫耶尔森氏菌(以下简称鼠疫菌)引起的一种人兽共患病,人类通常被带菌蚤体叮咬而被感染,临床表现主要有腺鼠疫、肺鼠疫和败血症鼠疫[1]。鼠疫菌在感染早期被巨噬细胞吞噬,并能在其中生存繁殖[2],这表明鼠疫菌能通过一系列的自我调节,从而抵抗巨噬细胞内一系列杀菌物质(特别是活性过氧化物)的杀菌作用。其中,由转录调控子对特定靶基因在转录水平上的调节,起着关键的作用。
OxyR蛋白是LysR家族转录调控子之一,在细菌抗氧化过程中发挥重要作用,其分子内的两个对过氧化物敏感的半胱氨酸残基(Cys-199和Cys-208)能被氧化成二硫键,并促进其寡聚化(二聚体或四聚体)而具有转录调节活性[3]。研究表明,大肠杆菌OxyR的调控元基因大多与细菌抗氧化有关,比如dps、gorA、grxA、katG、fur、ahpCF等[4-5];另外,OxyR还能激活小RNA基因oxyS的转录,因而OxyR又能通过OxyS调节其它基因的表达[4]。鼠疫菌OxyR蛋白也参与抗氧化调节,特别是能直接激活katY的表达[6]。鼠疫菌KatY蛋白首次发现于1956年,它是一种温度依赖型蛋白,在37。C时高表 达[6-7]。KatY分子具有4种亚型,即α-KatY(~70kDa)、β-KatY(~50kDa)、γ-KatY(~36kDa)和δ-KatY(~34kDa),小分子量的γ-和δ-亚型可能是α-或β-亚型的酶解产物[6-7]。α-与α-KatY 或α-与β-KatY能形成4聚体而具有过氧化物酶及触酶活性,进而解除过氧化物(比如H2O2)对细胞的毒害,有利于鼠疫菌在巨噬细胞内的生存[6-7]。
虽然已经证明鼠疫菌OxyR能直接激活katY的表达[6],但是katY的转录起始位点以及OxyR与katY启动子区DNA相互作用机制并未被阐明。本文利用引物延伸实验、实时定量RT-PCR实验、凝胶阻滞(EMSA)实验以及DNase I足迹实验等经典的分子生物学实验技术,进一步完善了OxyR对katY的转录调控机制。
1 材料和方法
1.1 材料
1.1.1 菌株 His-OxyR蛋白表达菌、鼠疫菌201株(野生型,WT)及其oxyR突变株(ΔoxyR)等均由本实验室保存。
1.1.2 主要试剂 实验所用的Primer Extension System、fmol®DNA Cycle Sequencing System等为Promega产品;TRIzol Reagent为Invitrogen产品;TaqDNA连接酶、dNTPs为上海生工生物工程公司产品;PCR产物纯化试剂盒为QIAGEN产品。
1.2 鼠疫菌生长曲线的测定 取50μL甘油菌种接种于18mL的TMH[8]培养基中(50mL的三角烧瓶,加玻璃珠,下同),26。C下230r/min培养至平台期,按1∶20稀释接种至新鲜的TMH培养基中,26。C下230r/min培养至OD620≈1.0,再按1∶20稀释接种至新鲜的TMH培养基中,26。C下230r/min连续培养,并每隔3h取一次样,测其OD620的吸光度值,最后以时间为横坐标,以OD620的值为纵坐标,绘制生长曲线。
1.3 凝胶阻滞(EMSA)实验[9]PCR 扩增katY(引物序列见表1)的启动子区序列并对产物纯化回收。用T4多聚核苷酸激酶(T4PNK)和[γ-32P]ATP(5 000Ci/mmol,10mCi/mL)对DNA片段5′末端进行标记。标记的DNA和不同浓度的His-OxyR蛋白在特定的反应体系中,室温共同孵育20 min后,进行4%非变性聚丙烯酰胺凝胶电泳,放射自显影后分析结果。

表1 本研究所用引物Tab.1 Oligonucleotide primers used in this study
1.4 DNase I足迹实验[9]利用[γ-32P]ATP对特异性引物(引物序列见表1)的5′末端进行标记,以鼠疫菌201株基因组DNA为模板,用被标记的引物和对应未标记的配对引物进行PCR扩增,PCR产物可作为足迹实验的探针。探针和不同量的His-OxyR蛋白在特定的结合体系中室温共同孵育30min,再用合适浓度的DNaseⅠ消化适当的时间(30~60s),消化产物配伍测序条带进行6%聚丙烯酰胺凝胶电泳,放射自显影分析结果。
1.5 引物延伸实验[10]将与katY的mRNA互补的特异性引物(表1)5′-末端用[γ-32P]ATP进行放射性标记,并将其退火到mRNA上(分别以等量的WT和ΔoxyR的总RNA为模板),进而将mRNA逆转录成cDNA。逆转录产物配伍测序条带进行6%聚丙烯酰胺凝胶电泳,放射自显影后,通过引物延伸条带的位置即可确定转录起始位点,而根据其相对丰度即可判定OxyR对katY的调控关系。
1.6 实时定量 RT-PCR[10]提取 WT 和ΔoxyR的总RNA,并用 DNA-freeTMKit(Amibion)消化去除其中的DNA污染,再用N6随机引物将其逆转录成cDNA,最后用Roche的LightCycler system作实时定量RT-PCR。将cDNA进行系列稀释,并以16SrRNA的cDNA为内参绘制标准曲线,用于katY表达水平的相对定量。
2 结 果
2.1 鼠疫菌在TMH中的生长状态 从图1可以看出:在TMH中,ΔoxyR的生长速率比 WT的稍慢,但从对数末期开始二者基本趋于一致,在24h时达到平台期,且其OD值均能达到2.0以上,这说明oxyR的缺失对鼠疫菌在TMH中的生长没有太大的影响。根据生长曲线,我们向OD620≈1.0的培养物中加入终浓度为10mmol/L过氧化氢,并继续培养30min后收集菌体,供后续的分子生化实验用。
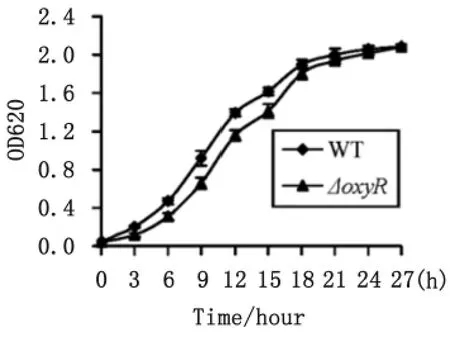
图1 WT和ΔoxyR在TMH中的生长曲线Fig.1 Yersinia pestis growth curves Cell cultured with an OD620value of about 1.0in TMH medium were diluted 1∶20into 18mL of the corresponding fresh medium.Bacteria were then grown at 26。C with shaking at 230r/min,and the OD620values were monitored for each culture with a 3hinterval until the cultures reached the stationary phase.
2.2 OxyR能结合到katY的启动子区 在本室前期的研究中,已证明OxyR能结合到katY的启动子区[6]。本文中,首先利用EMSA实验,重复验证了OxyR蛋白对katY启动子区具有结合作用,结果如图2A)所示:随着 His-OxyR蛋白浓度的不断增加,自由DNA条带越来越弱(泳道1到4),当先向反应体系中加入未标记的katY启动子区DNA(Cold probe,第5泳道)后,由于蛋白先与Cold probe结合就不能再结合探针,这样自由条带就会增加,阻滞带就会消失或减少,而加入16SrDNA作为negative probe(第6泳道)就没有这种效应;而当只加入鼠疫菌F1抗原蛋白(Un-related protein,第7泳道)时,由于F1抗原蛋白是非调控子蛋白,它不能与katY启动子区结合,而不出现阻滞条带。上述结果表明His-OxyR蛋白对katY启动子区的结合是特异性的。
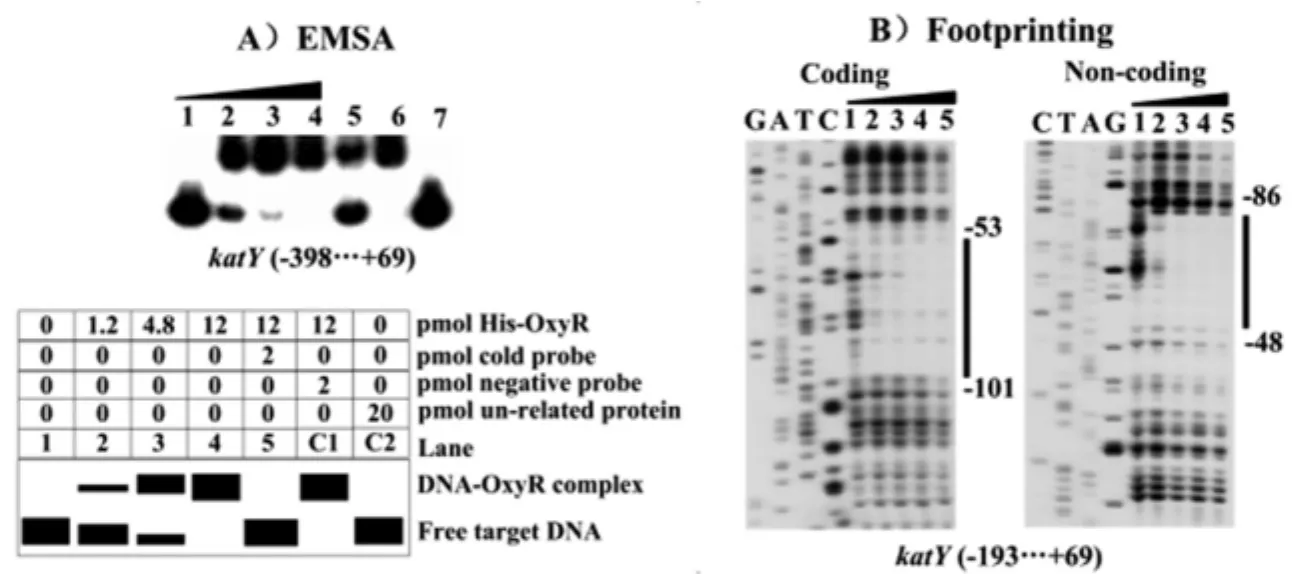
图2 EMSA实验(A)和DNaseⅠ足迹实验(B)放射自显影结果Fig.2 EMSA and DNase I footprinting assays of binding of His-OxyR to katYpromoter region
进一步利用DNaseⅠ足迹实验来确定OxyR对katY启动子区的结合位置,结果如图2B)所示:“1 2 3 4 5”为蛋白量从低到高的不同蛋白梯度,“1”为未加蛋白的参照,coding是指被标记引物是上游引物,Non-coding指被标记引物是下游引物。根据“G A T C”测序条带,我们可以得出OxyR对katY启动子区的结合位置为-101至-48之间的碱基(翻译起始位点为“+1”),这比前期所得的结合序列长了许多[6],但是其核心区域是一致的,其主要原因可能是探针制备方法不同所致。
2.3 OxyR激活katY的转录 我们利用引物延伸和RT-PCR实验技术研究OxyR对katY的调控关系。图3A为引物延伸结果:若以翻译起始位点为+1,katY的转录起始位点为-26位的碱基G,且我们只在WT中检测出了引物延伸条带,而在ΔoxyR中没检测出,这表明鼠疫菌OxyR能促进katY的转录;图3B为RT-PCR结果,可以看出:WT中katY的mRNA丰度远远高于ΔoxyR中的,二者具有4倍以上的差异,这进一步表明OxyR能促进katY的转录表达。
2.4 鼠疫菌katY启动子区结构 图4为katY基因的启动子区结构示意图:包含翻译起始位点、转录起始位点 P、OxyR 结合位点、-10和-35区以及Shine-Dalgarno序列(SD序列,为核糖体识别位点)。
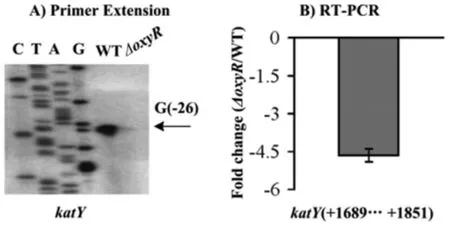
图3 OxyR对katY调控的引物延伸(A)和RT-PCR实验(B)结果Fig.3 OxyR activation of the transciption of katY
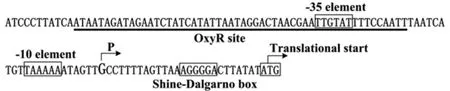
图4 鼠疫菌katY启动子区示意图Fig.4 Organization of katYpromoter DNA region Shown were translation and transcription starts,Shine-Dalgarno box,predicted OxyR sites,and-10and-35core promoter elements.
3 讨 论
之前的研究表明:当鼠疫菌被巨噬细胞吞噬后,katY即迅速表达,这与OxyR能直接激活katY的转录有关[6]。但是前期的研究并没有详细阐述OxyR对katY调控机制。本文中,我们利用引物延伸实验、实时定量RT-PCR、EMSA、DNase I足迹等实验技术,完善了OxyR对katY基因的转录调控机制。图4为katY启动子区结构:P为katY的转录起始位点,-10和-35区为RNA聚合酶的识别位点,Shine-Dalgarno序列为核糖体结合位置。可以看出OxyR的结合位点覆盖-35区,而不覆盖-10区,这表明OxyR对katY的激活可能是通过与RNA聚合酶σ亚基的C-末端结构域(σCTD)相互作用,从而有利于σ亚基对-10和-35区的结合而实现的。简而言之,OxyR对katY基因的激活,是通过OxyR、RNA聚合酶及katY启动子区DNA序列的共同相互作用而实现的。
[1]Perry RD,Fetherston JD.Yersiniapestis--etiologic agent of plague[J].Clin Microbiol Rev,1997,10(1):35-66.
[2]Straley SC,Harmon PA.Yersiniapestisgrows within phagolysosomes in mouse peritoneal macrophages[J].Infect Immun,1984,45(3):655-659.
[3]Kim SO,Merchant K,Nudelman R,et al.OxyR:a molecular code for redox-related signaling[J].Cell,2002,109:383-396.DOI:10.1016/S0092-8674(02)00723-7
[4]Pomposiello PJ,Demple B.Redox-operated genetic switches:the SoxR and OxyR transcription factors[J].Trends Biotechnol,2001,19(3):109-114.
[5]Zheng M,Wang X,Templeton LJ,et al.DNA microarray-mediated transcriptional profiling of theEscherichiacoliresponse to hydrogen peroxide[J].J Bacteriol,2001,183(15):4562-4570.DOI:10.1128/JB.183.15.4562-4570.2001
[6]Han Y,Geng J,Qiu Y,et al.Physiological and regulatory characterization of KatA and KatY inYersiniapestis[J].DNA Cell Biol,2008,27(8):453-462.DOI:10.1089/dna.2007.0657
[7]Garcia E,Nedialkov YA,Elliott J,et al.Molecular character-ization of KatY (antigen 5),a thermoregulated chromosomally encoded catalase-peroxidase ofYersiniapestis[J].J Bacteriol,1999,181(10):3114-3122.
[8]Straley SC,Bowmer WS.Virulence genes regulated at the transcriptional level by Ca2+inYersiniapestisinclude structural genes for outer membrane proteins[J].Infect Immun,1986,51(2):445-454.
[9]Zhang Y,Gao H,Wang L,et al.Purification of recombinant HNS protein ofYersiniapestisand characterization of its DNA-binding activity[J].Acta Microbiologica Sinica,2011,51(5):615-621.(in Chinese)张义全,高鹤,王丽,等,鼠疫菌H-NS蛋白的表达与纯化及其DNA结合活性分析[J].微生物学报,2011,51(5):615-621.
[10]Gao H,Zhang Y,Yang L,et al.Regulatory effects of cAMP receptor protein (CRP)on porin genes and its own gene inYersiniapestis[J].BMC Microbiol,2011,11:40.DOI:10.1186/1471-2180-11-40

