干扰日本血吸虫凋亡抑制因子最佳siRNA分子的筛选
罗 荣,赵江平,胡 超,程国锋
日本血吸虫病为人兽共患寄生虫病,危害严重,是我国最重要的公共卫生问题之一。虽然半个多世纪来,我国血吸虫病防治取得了重大成就,但防治形势仍然很严峻[1-2]。
尽管血吸虫面对宿主的免疫排斥和对抗,仍可在终末宿主体内存活数年,推测虫体细胞生死存活调控可能具有一定的特殊性[3-4]。凋亡作为细胞内程序性的有序死亡,是生命体维持自身生长发育、病理及生理性反应的重要方式。凋亡抑制因子作为细胞凋亡调控的负因子,已引起了有关学者的关注。在日本血吸虫中,已有凋亡负调控相关的因子SjBcl-2/1、SjBcl-2/2、SjA[3]、SjIAP[4]和Sj-CIAP[5]等研究报道。我们实验室的前期研究发现日本血吸虫凋亡抑制因子可显著抑制人HEK293T的凋亡[4],提示SjIAP在日本血吸虫的寄生和生长发育中可能发挥重要作用。
为进一步研究SjIAP的功能,本研究根据其cDNA序列设计了3对siRNA分子,首先在HEK293T细胞中筛选出了最佳siRNA干扰分子,然后利用获得最佳的siRNA分子对体外培养的日本血吸虫虫体进行干扰研究。
1 材料和方法
1.1 实验动物和生物材料 新西兰大耳兔购自上海罗泾飞达实验动物养殖场;BALB/c小鼠购自中国科学院上海实验动物中心。日本血吸虫尾蚴由中国农业科学院上海兽医研究所钉螺室提供。利用腹部贴片法将尾蚴感染新西兰白兔(约3 000条尾蚴/兔)以及BALB/c小鼠(约150条尾蚴/鼠),感染后第12d剖杀动物,肝门静脉灌注法收集血吸虫虫体,然后立即进行体外培养。培养基组成为:RPMI-1640中加入终浓度10% 胎牛血清(V/V)、100 U/mL青霉素、100μg/mL链霉素、0.2%D-葡萄糖(g/V)、0.1% 水解乳蛋白 (g/V)、1μmol/L次黄嘌呤、1μmol/L 5-羟色胺、0.5μmol/L氢化可的松和0.2U/mL胰岛素。培养条件:37。C、CO2浓度为5%的细胞培养箱。
1.2 试剂耗材 RPMI1640培养基、胎牛血清、双抗(青霉素和链霉素)购自上海世仪生物有限公司;Lipofectamine 2000和Opti-MEM®培养基购自Invitrogen公司;Caspase3/7检测试剂盒购自Promega公司;抗Tubulin抗体和羊抗兔的IgG-HRP购自北京康为世纪有限公司;氢化可的松、5-羟色胺、次黄嘌呤和胰岛素购自Sigma公司;Bradford蛋白定量试剂盒购自生工生物工程(上海)股份有限公司;小干扰siRNA分子由上海吉玛制药技术有限公司设计并化学合成。
1.3 HEK293T细胞培养 HEK293T细胞由本实验室惠存,培养液为95%DMEM培养基、5% 胎牛血清、100U/mL青霉素和100μg/mL链霉素;培养条件:37。C、5%CO2细胞培养箱。待细胞培养汇合约90%时,利用胰酶消化细胞,消化结束后加入胎牛血清终止反应,将消化的细胞离心并洗涤,加入培养基,在新培养板中进行培养。
1.4 质粒和SiRNA共转染 首先将A液(50μL Opti-MEM +1.5μL Lipofectamine 2000)充分混匀且室温孵育5min,然后将其转移至B液(50μL Opti-MEM +400ng pcDNA3.1(+)-IAP+2μL siRNA)中,充分混匀后室温继续孵育20min,然后小心将其加入细胞培养孔中且摇匀,继续进行培养,48h后收集转染细胞,分别利用Real time RT-PCR检测IAP的转录水平和免疫印迹检测IAP蛋白水平变化。
1.5 日本血吸虫体外RNA干扰 将收集的日本血吸虫虫体用0.5%(w/v)的水解乳蛋白溶液洗涤3次,添加完全培养基于12孔培养板进行体外培养,每孔培养基为3mL,虫体约为25条。实验共设:空白组,无关对照组,siRNA-592和siRNA-951处理组,RNA终浓度均为100nmol/L,培养条件如前所述,每12h补加一次RNA。培养72h后,收集虫体进行IAP转录水平和蛋白水平检测。
1.6 Real time RT-PCR 利用Trizol提取转染的HEK293T细胞或日本血吸虫虫体总RNA。将1 μg细胞或虫体总RNA进行逆转录制备cDNA,将1μL cDNA作为模版,进行Real time RT-PCR检测IAP转录水平的变化。反应体系为:细胞或虫体cDNA 1μL,2×SBYR®Primix Ex TaqTMⅡ7.5 μL,引物0.3μL(SjIAP上游:5′-CGG ATC AAC CTG AAG CGT GT-3′,下游:5′-ATT ACC CCA GGA AGA CCA CG-3’),dH2O 6.2μL。PCR运行参数是:95。C,30s;循环扩增反应为:95。C,5s;60。C,34s,共40个循环。分别以人18S核糖体RNA(上游:5′-GAC GGA AGG GCA CCA CCA G-3′ 下 游:5′-ACC AGA CAA ATC GCT CCA CC-3′)和血吸虫烟酰胺腺嘌呤二核苷酸脱氢酶(上游:5′-CGA GGA CCT AAC AGC AGA GG-3′下游:5′–TCC GAA CGA ACT TTG AAT TC-3′)为内参,通过2-ΔΔCt方法计算IAP的相对表达量。
1.7 免疫印迹分析 利用Bradford法(生工生物工程(上海)股份有限公司)对HEK293T细胞和日本血吸虫虫体蛋白进行定量,将20μg蛋白样品进行电泳(10%SDS-聚丙稀酰胺凝胶)分离,将分离的蛋白电转至硝酸纤维膜(Whatman Germany)上。膜在5%(W/V)脱脂奶粉封闭2h,结束后,利用PBST(pH=7.4)对膜进行洗涤。然后,分别将抗IAP抗体(稀释度为1∶500)和抗Tubulin的抗体与膜共温育1h,结束后,用PBST(pH=7.4)溶液洗3次,每次5min。利用羊抗兔(鼠)IgG-HRP作为二抗,室温下与硝酸纤维膜孵育30min,然后再用PBST溶液洗3次,每次5min。最后,利用ECL反应液进行显色。
1.8 Caspase3/7活性检测 利用 Caspase 3/7as-say试剂盒进行Caspase 3/7活性测定,将80μL的虫体裂解液与80μL Caspase试剂混合。然后,在室温作用30min。结束后,取100μL的混合物在荧光酶检测仪(Berthold FB 12Luminometer)进行测定。同时,利用Bradford法进行蛋白定量,通过蛋白浓度对荧光值进行均一化处理。数据统计学分析采用T检验。
2 结 果
2.1 干扰SjIAP的最佳siRNA分子筛选 利用生物信息学,根据SjIAP的cDNA序列设计3对siRNA分子(表1),对其进行化学合成。将体外退火的每对siRNA分子分别与重组质粒pcDNA3.1(+)-IAP共转染至HEK293T细胞中。利用Real time RT-PCR分析IAP转录水平的变化。结果表明转染siRNA-592和siRNA-951小RNA分子可显著降低SjIAP的转录,其中siRNA-951抑制能力最强,可达79%(图1)。

表1 日本血吸虫IAP的siRNAs序列Tab.1 List of the siRNAs used for SjIAP silence
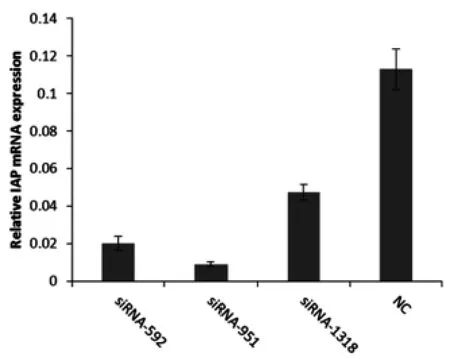
图1 实时定量RT-PCR分析最佳干扰IAP的siRNA分子Fig.1 Real-time RT-PCR analysis of the siRNAs for silencing IAP in HEK293Tcell
2.2 最佳siRNA的虫体内干扰研究 在体外培养的日本血吸虫童虫(12d)中分别加入siRNA-951,siRNA-592及无关对照siRNA(终浓度均为100 nmol/L),继续培养72h,收集虫体,检测SjIAP转录水平和蛋白水平表达情况。结果表明实时RTPCR显示干扰72h后虫体SjIAP的转录水平均没有明显变化(图2)。进一步免疫印迹分析表明siRNA-951处理组可显著降低虫体内SjIAP的表达(图3)。
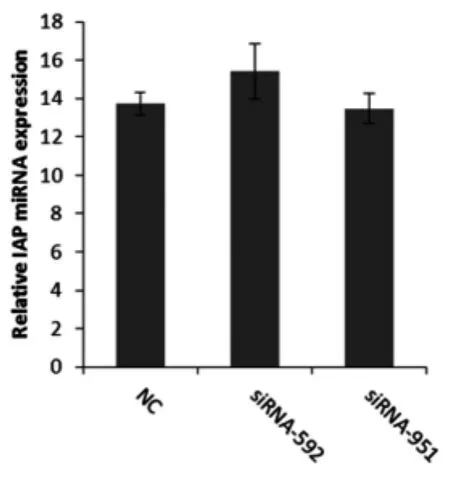
图2 实时定量RT-PCR分析最佳干扰siRNA分子干扰血吸虫体内IAP的效果Fig.2 Real-time RT-PCR analysis of the siRNAs for silencing IAP in S.japonicum
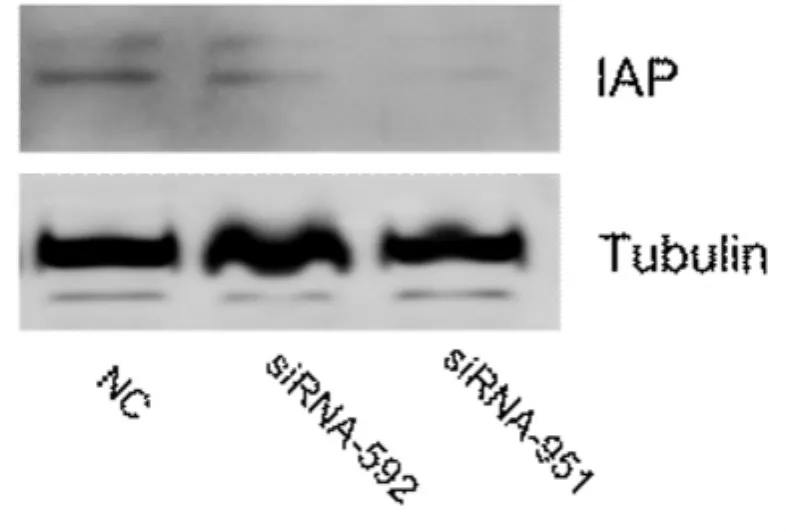
图3 免疫印迹分析血吸虫IAP干扰的效果Fig.3 Western blot analysis of the IAP expression in schistosomes treated by the siRNAs
2.3SjIAP敲降后虫体Caspase活性测定 本课题组前期研究表明SjIAP可抑制人HEK293细胞凋亡的进程,Caspase作为细胞凋亡过程中重要活性分子,对此测定可反映细胞凋亡的强弱[4-5]。为此,在siRNA处理72h后,对虫体内的Caspase3/7活性检测。结果表明,与空白对照组和无关对照组相比,siRNA-951 和 siRNA-592 处 理 组 虫 体 的Caspase3/7活性有所提高(图4),提示干扰SjIAP后血吸虫虫体细胞的凋亡可能有所上升。另外,siRNA处理和对照组的虫体形态没有明显区别。
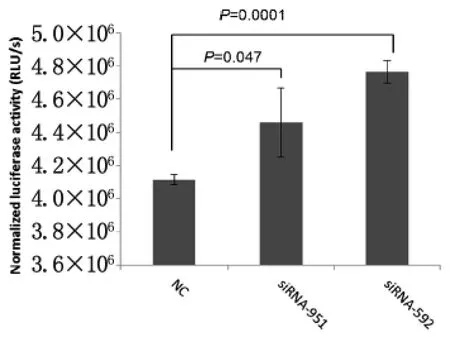
图4 日本血吸虫IAP干扰后Caspase 3/7活性分析Fig.4 Effect of SjIAP silence in schistosomes on Caspase 3/7 activity
3 讨 论
研究表明寄生虫可调控宿主细胞的凋亡以维持其寄生[6-7]。日本血吸虫成虫通常寄生于终末宿主的肠系膜静脉内,虽然直接面对来自宿主血液体统的免疫排斥和对抗,仍能存活长达数年。因此,深入研究血吸虫如何调控自身细胞的存活的分子机理并对其进行干预有可能开拓血吸虫病防控的新途径。血吸虫基因组学研究表明虫体内存在编码与高等动物类似细胞凋亡信号通路。我们课题组前期研究表明血吸虫IAP蛋白能显著抑制放线菌素诱导的HEK293T细胞的凋亡[4]。为进一步研究此分子的功能,本研究根据SjIAP的cDNA序列设计了3对siRNA分子。分别将3对siRNA分子与表达SjIAP的重组质粒共转染到HEK293T细胞中,实时定量RT-PCR和免疫印迹分析表明获得了2个干扰效果较好的siRNA分子(siRNA-592和siRNA-951)。然后,将这2个siRNA分子分别加入到干扰体外培养日本血吸虫童虫中(12d),继续培养3d,免疫印迹分析表明虫体内SjIAP蛋白表达有所下降,特别是siRNA-951组尤为明显。Caspase活性测定表明在SjIAP敲降后的虫体中Caspase 3/7活性有所提高,提示虫体细胞凋亡进行可能有所增强,有待后续研究深入查明。
免疫印记分析表明干扰后虫体IAP蛋白的表达有所降低,但实时定量RT-PCR和半定量PCR分析表明其mRNA在转录水平变化不明显。我们推测可能由于SjIAP的mRNA量较高(比内参NADH还高),在干扰效果有限的情况下,导致IAP转录水平干扰效果不明显。另外,也可能由于siRNA-951分子主要引起IAP蛋白的翻译抑制,有待进一步研究查明。
总之,本研究获得了2个干扰SjIAP较好的siRNA分子,为进一步利用此分子,研究SjIAP的功能奠定了前期基础。
[1]Zheng Q,Chen Y,Zhang HB,et al.The control of hookworm infection in China[J].Parasit Vectors,2009,2:44.
[2]Hotez PJ,Brindley PJ,Bethony JM,et al.Helminth infections:the great neglected tropical diseases[J].J Clin Invest,2008,118(4):1311-1321.
[3]Lee EF,Clarke OB,Evangelista M,et al.Discovery and molecular characterization of a Bcl-2-regulated cell death pathway in schistosomes[J].Proc Natl Acad Sci USA,2011,108:6999-7003.
[4]Peng J,Yang Y,Feng X,et al.Molecular characterizations of an inhibitor of apoptosis fromSchistosomajaponicum[J].Parasitol Res,2010,106:967-976.
[5]Luo R,Zhou C,Shi Y,et al.Molecular characterization of a cytokine-induced apoptosis inhibitor fromSchistosomajaponicum[J].Parasitol Res,2012,111(6):2317-2324.
[6]Lüder CG,Gross U,Lopes MF.Intracellular protozoan parasites and apoptosis:diverse strategies to modulate parasite host interactions[J].Trends Parasitol,2001,17(10):480-486.
[7]James ER,Green DR.Manipulation of apoptosis in the host-parasite interaction[J].Trends Parasitol,2004,20(6):280-287.

