多重耐药志贺菌临床分离株耐药基因检测及指标聚类分析
叶金艳,祝建军,李英龙,李永祥,杜玉海,李桂军,高雯洁,顾蓓青,吴晓燕,宋秀兰
志贺菌(shigella)至今仍是影响人类肠道健康的主要致病菌之一,引起人类细菌性痢疾[1]。婴幼儿胃肠道抵抗力弱,对志贺菌更加具有易感性。近年来在抗菌素的压力下志贺菌出现多重耐药,使临床用药显得棘手,而儿科适用药物谱较狭窄,治疗更为困难。有关志贺菌耐药机制的探讨,我们曾对复方新诺明耐药相关基因、氯霉素类基因、β-内酰胺类基因做了研究[2-4],由于试验菌株少,不能反应嘉兴地区志贺菌的耐药状况。因此,为进一步了解志贺菌对常用药的耐药机制,本研究共筛选了嘉兴地区耐药志贺菌58株,检测了β-内酰胺类基因、复方新诺明耐药相关基因、接合性质粒、转座酶、插入序列和整合子,共14种耐药相关基因,用指标聚类分析(SPSS法)分析获得性耐药相关基因和可移动元件遗传标记存在状况的相关性。
1 材料与方法
1.1 材料
1.1.1 菌株 58株多重耐药志贺菌分离自嘉兴地区7家医院2006年11月—2012年10月间住院及门诊患者的大便标本。菌株使用ATB-EXPRESSION细菌鉴定仪及志贺菌诊断血清鉴定到种。质控菌株:大肠埃希菌ATCC 25922;肺炎克雷伯菌700603(ESBLs阳性质控菌)。
1.2 方法
1.2.1 抗菌药物敏感性试验 采用K-B纸片扩散法,根据美国抗微生物药物敏感性试验执行标准(CLSI)2010年版要求测定12种抗菌药物的敏感性,药敏纸片均为英国Oxoid公司产品。超广谱β内酰胺酶(ESBLs)表型确证试验参照CLSI 2010年版大肠埃希菌及克雷伯菌的判断标准。头孢哌酮/舒巴坦的判定标准参照CLSI 2010年版头孢哌酮的折点。
1.2.2 细菌处理 挑纯培养菌落置入0.5mL离心管内(内预置200ng/mL蛋白酶 K溶液200 μL),56℃水浴2h,改95℃水浴10min,离心(15 000r/min)30s。上清液即为基因检测的模板液,-20℃冰箱保存备用。
1.2.3 基因检测 traA、trbC、tnp513、int I 1、ISEcp1、IS26、IS903、TEM、SHV、CTXM-1、OXA、qacEΔlsul1、dfrA1、dfrA12检测均为PCR法。蛋白酶K消化法制备DNA扩增模板。靶基因引物识别序列和目的产物长度见表1。各种靶基因PCR扩增体系均为:每反应体系P1引物1μL(1.0μmol/L)、P2引物1μL (1.0μmol/L),dNTPs 2μL (2 mmol/L),10 倍 缓 冲 液 2μL [KCl 10mmol/L,(NH4)2SO48mmol/L,MgC122mmol/L,Tris-HC1(pH9.0)10mmol/L,NP40 0.5%,BSA 0.02%],Taq DNA pol 1u(不计体积),超纯水9 μL,模板液5μL,总反应体积20μL。PCR扩增产物>500bp,热循环参数均为:93℃预变性2min,然后93℃60s,55℃60s,72℃60s,循环35个周期,最后一个72℃延长至5min,其余均为:93℃预变性2min,然后93℃30s→55℃30s→72℃60s,循环35个周期,最后一个72℃延长至5min。产物经2%琼脂糖凝胶电泳,出现与阳性对照分子相当的目的条带为阳性。检测试剂盒、靶基因PCR引物序列及阳性对照DNA由无锡市克隆遗传技术研究所提供。
1.2.4 阳性基因测序 选择部分菌株用和CTXM-1群相同的引物进行测序。PCR阳性产物为PCR直接全自动荧光法测序,委托上海博尚生物技术有限公司完成(测序在美国ABI公司3730型毛细管全自动测序仪上进行)。
1.2.5 序列对比 读序工具软件为Chromas,测序结果用Chromas直接与美国核酸库(GenBank)作BLASTn(www.ncbi.nlm.nih.gov/BLASTn)比对。
1.2.6 聚类分析 进行β内酰胺类、复方新诺明耐药相关基因与接合性质粒、转座酶、插入序列、整合子基因检测结果的指标聚类分析(SPSS 18.0)。

表1 靶基因名称和PCR引物序列Tab.1 Target genes and the primer sequence of PCR
2 结 果
2.1 58株志贺菌对12种抗生素耐药率 58株志贺菌ESBLs均为阳性,其对氨苄西林、头孢曲松、头孢噻肟、复方新诺明耐药率较高,分别为100.0%、89.7%、89.7%、89.7%;耐药率为0的为亚胺培南、头孢哌酮/舒巴坦、阿米卡星;氨苄西林/舒巴坦、头孢他啶、环丙沙星、氯霉素和庆大霉素耐药率在30%~70%。
2.2 耐药相关基因检测 对58株志贺菌进行耐药相关基因的检测,阳性率超过了55.0%的可移动元件为3种,分别为插入序列遗传标记基因ISEcp1 75.9%(44/58)、整合子遗传标记基因intI 1 60.3%(35/58)、接合性质粒遗传标记基因traA 55.2%(32/58)。阳性率见表2。检测均阴性的基因为SHV型β-内酰胺类基因、插入序列IS26、转座酶tnp513,未列在表内。
2.3 测序 选择11株菌株用和CTX-M-1群相同的引物进行测序,测得序列经比对与美国核酸库(GenBank)已登录的 CTM-M-55序列均100%相同。CTM-M-55基因测序图见图1。
2.4 指标聚类分析 检测结果的指标聚类分析见图2。
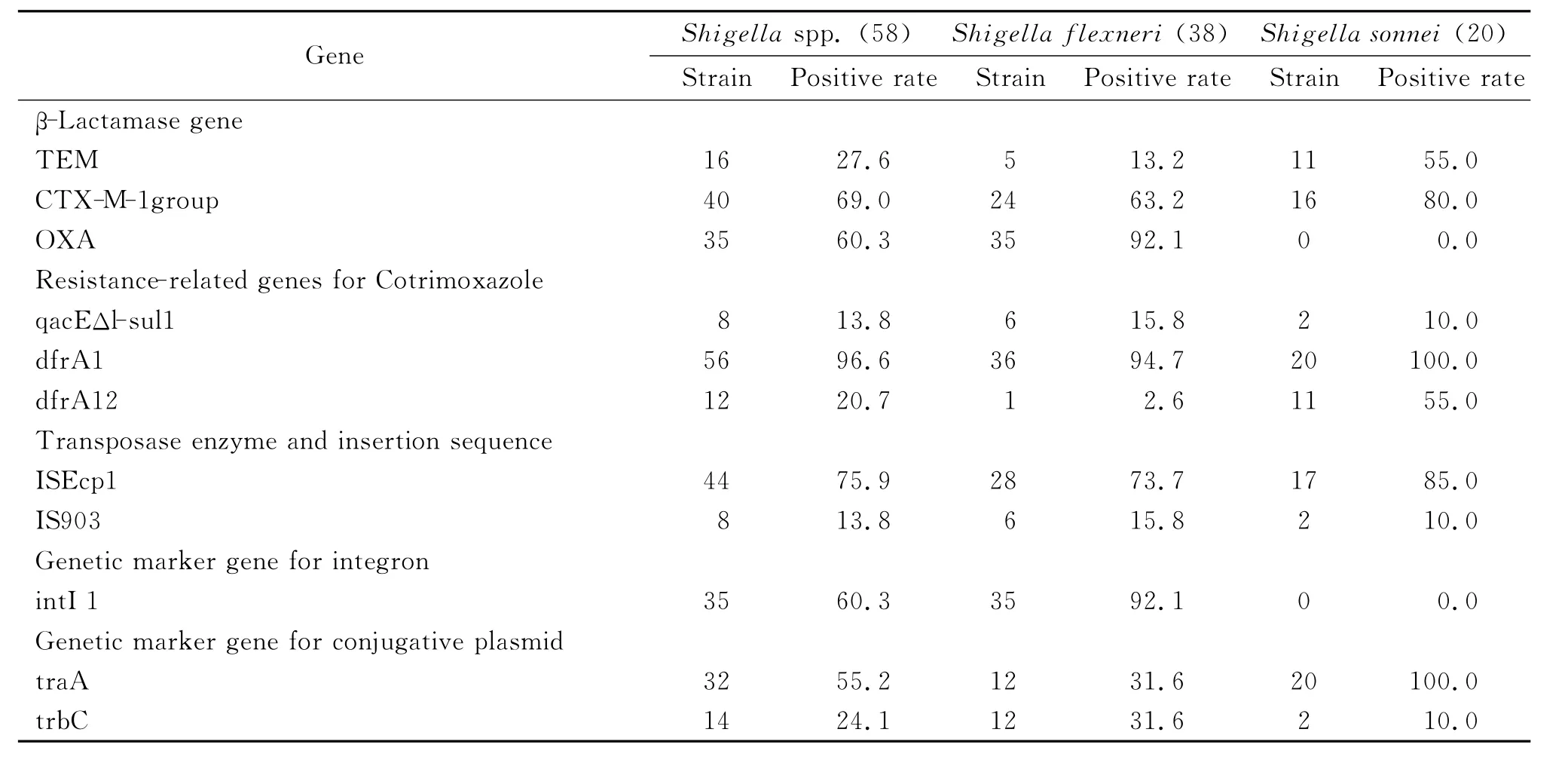
表2 志贺菌基因检测阳性率(%)Tab.2 Positive rate of Shigellagene testing(%)
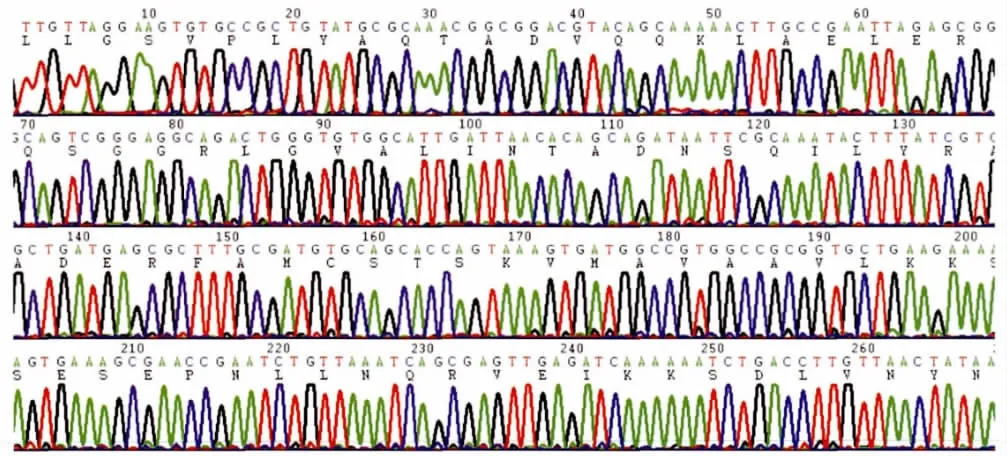
图1 志贺菌属CTX M-55基因测序图Fig.1 CTX M-55gene sequence of Shigellaisolates
3 讨 论
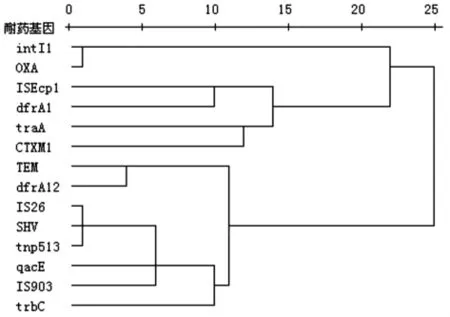
图2 检测结果的指标聚类分析Fig.2 Index cluster analysis of the test results
细菌对抗菌药物的耐药机制可分突变耐药和获得性耐药。获得性耐药是指细菌通过基因水平转移,从其它细菌获得外源性耐药基因,整合在自身基因组上。可移动遗传元件,不仅可以通过耐药基因的载体传递导致获得性耐药基因,并可使耐药基因高表达,它们还与细菌耐药程度相关。基因水平转移就是由介导各种耐药基因的可移动遗传元件(质粒、转座子、整合子、噬菌体、插入序列共同区等)完成,它们可以在同种细菌甚至不同种细菌菌株间传递[5],从而使细菌的耐药性得以快速传播。近年来国内外有较多关于质粒、整合子、转座子等可移动遗传元件致各类细菌获得性耐药[6-10]的报告。本组资料中我们在7种可移动遗传元件检出5种阳性基因,阳性率超过了55.0%的可移动元件为3种,分别为插入序列遗传标记基因ISEcp1 75.9%(44/58)、整合子遗传标记基因intI 1 60.3%(35/58)、接合性质粒遗传标记基因traA 55.2%(32/58)。对于志贺菌方面的研究,苑广盈等[11]证实志贺菌可通过质粒水平传递ESBLs而导致耐药。王淑玲等[12]验证志贺菌通过耐多药相关基因(T1C4)进行水平转移,导致对多种药物的抗性。从而显示可移动元件在参与志贺菌多重耐药基因转移中发挥的作用不容忽视。
intⅠ1为Ⅰ类整合子的遗传标记,Ⅰ类整合子的3′端包括qacEΔ1-sul1,qacEΔ1-sul1也可作为Ⅰ类整合子的遗传标记,且可以被转座。本组资料检测出intI 1 60.3%,qacEΔl-sul1 13.8%,阳性率相差较大的原因可能因为一部分整合酶基因intⅠ1或3′端 的qacEΔ1-sul1可从Ⅰ类整合子中被转座,因此造成两者的比例不相符。本组资料复方新诺明耐药相关基因dfrA1 96.6%(56/58),复方新诺明的耐药率高为89.7%,与携带复方新诺明耐药相关基因密切相关。
转座子是能将自身基因插入基因组中任何一个序列上的一组DNA序列。转座子从一个位置转座到另一个位置转入和切出的过程,改变了原有基因的结构和排序,从而产生了突变。并且当转座子插入到某个功能基因内部或邻近位点时,就会使插入位置的基因失活并诱导产生突变型。插入序列则是最简单的一类转座子,由一段编码转座酶的DNA序列构成。一个耐药转座子可表现为对某种抗生素耐药,而插入序列没有这种功能,只编码转座酶。本组资料转座子中检出插入序列ISEcp1、IS903分别为75.9%(44/58)、13.8(8/58)。
可移动遗传元件中的接合性质粒有泛宿主和狭宿主之分。狭宿主转移限制在少量相似种属的细菌之间,而泛宿主则能够在不同种属的细菌之间转移元件。traA和trbC分别是狭宿主性和泛宿主性接合性质粒遗传标记。一些泛宿主在革兰阴性菌内没有宿主限制,并能把质粒转移到革兰阳性菌和真菌等单细胞真核生物,为耐药基因的广泛传播提供了良好的载体。张嵘等[13]在志贺菌中通过接合试验,20株产ESBL志贺菌中18株质粒接合试验成功,且所有获得接合子的受体菌药物敏感试验均显示产ESBLs。本组试验检测到接合性质粒traA和trbC,阳性率分别为55.2%(32/58)、24.1%(14/58)。提示志贺菌存在泛宿主和狭宿主性接合性质粒,提示耐药在志贺菌同种属和不同种属之间的耐药不容忽视,这和近年来志贺菌耐药率的提高极为密切。
志贺菌耐三代头孢菌素的重要机制是携带CTX-M型ESBLs基因,该基因对头孢噻肟水解力强。本组资料志贺菌头孢噻肟耐药率89.7%(52/58),CTX-M-1群基因检测阳性率69.0%,显示其与头孢噻肟耐药(89.7%)高度相关,而比率的差异显示存在其他的耐药机制。张环等[14]的研究结果为志贺菌对三代头孢菌素耐药是多种机制共同作用,主要原因为ESBLs基因,主动外排是起作用的另一项因素。从另一组数据显示福氏志贺菌OXA检出率92.1(35/38),宋内氏志贺菌则为0,而福氏志贺菌、宋内氏志贺菌氨苄西林/舒巴坦耐药率分别为92.1%、0,可见氨苄西林/舒巴坦耐药与OXA相关。
β内酰胺类基因、复方新诺明耐药相关基因与接合性质粒、转座酶、插入序列、整合子基因检测结果的指标聚类分析显示,β内酰胺类基因OXA由intI1介导,SHV由IS26、tnp513介导。而SHV、IS26、tnp513、qacE、IS903均有可能在trbC 宽范围宿主质粒上,能够在不同种属的细菌之间转移元件,造成耐药性的播散。
可移动遗传元件可致多种类细菌呈多药耐药[9-10],在志贺菌中的检测国内未曾报道,特别是对14种耐药相关基因的联合检测。细菌耐多药是多方面的原因所致,本组志贺菌因为携带获得性耐药基因和可移动遗传元件导致多重耐药,可移动元件的水平转移使细菌的耐药性得以在同种甚至不同菌株间快速传播,是近年来志贺菌耐药率高的原因之一。
[1]Zhong HJ,Chang ZR,Zhang J,etal.The analysis of bacillary dysentery surveillance in China,2007[J].Chin J Epidemiol,2010,31(3):304-307.DOI:10.3760/cma.j.issn.0254-6450.2010.03.016 (in Chinese)钟豪杰,常昭瑞,张静,等.中国2007年细菌性痢疾监测分析[J].中华流行病学杂志,2010,31(3):304-307.
[2]Zhu JJ,Ye JY,Du YH,etal.The CTX-M-55group beta-lactamases in clinical isolates of Shigella[J].Chin J Nosocomiol,2008,31(12):1378-1379.(in Chinese)祝建军,叶金艳,杜玉海,等.在志贺菌中鉴别出产CTX-M-55株[J].中华检验医学杂志,2008,31(12):1378-1379.
[3]Ye JY,Zhu JJ,Du YH,etal.Genes of SMZco resistance in drug-resistant Shigellastrains[J].Chin J Nosocomiol,2009,19(2):142-144.(in Chinese)叶金艳,祝建军,杜玉海,等.志贺菌对复方新诺明耐药相关基因的研究[J].中华医院感染学杂志,2009,19(2):142-144.
[4]Ye JY,Zhu JJ,Du YH,etal.Chloramphenicol resistance gene CmlA1of Shigella[J].Chin J Nosocomiol,2009,19(3):271-273.(in Chinese)叶金艳,祝建军,杜玉海,等.志贺菌分离株中发现氯霉素外排泵基因cmlA1[J].中华医院感染学杂志,2009,19(3):271-273.
[5]Tenover FC.Mechanisms of antimicrobial resistance in bacteria[J].Am J Med,2006,119(6Suppl 1):S62-70.
[6]Gaze WH,Abdouslam N,Hawkey PM,etal.Incidence of class 1integrons in a quaternary ammonium compound polluted environment[J].Antimicrob Agents Chemother,2005,49(5):1802-1807.
[7]Poirel L,Brinas L,Verlinde A,etal.BEL-1,a novel clavulanic acid-inhibited extended-spectrum beta-lactamase,and the class 1 integron In120in Pseudomonas aeruginosa[J].Antimicrob A-gents Chemother,2005,49(9):3743-3748.
[8]Essa AM,Julian DJ,Kidd SP,etal.Mercury resistance determinants related to Tn21,Tnl696,and Tn5053in enterobacteria from the preantibioticera[J].Antimierob Agents Chemother,2003,47(3):1115-1119.
[9]Zhang JM,Mi ZH,Wang CB,etal.Index cluster analysis of horizontal acquired resistance genes and mobile genetic elements in drug-resistant Acinetobacter baumannii[J].Chin J Microbiol Immunol2012325394.DOI10.3760cma.j.issn.0254-5101.2012.05.002(in Chinese)张建明,糜祖煌,万长标,等.耐药鲍曼不动杆菌获得性耐药基因和可移动遗传元件检测与指标聚类分析[J].中华微生物学和免疫学杂志,2012,32(5):394.
[10]Hu XH,Xu XM,Mi ZH,etal.Study on drug-resistance and mobile genetic elements of Pseudomonas aeruginosa from burn wound[J].Chin J Burns,2009,25(2):103-105.DOI:10.3760/cma.j.issn.1009-2587.2009.02.010(in Chinese)胡锡浩,徐小敏,糜祖煌,等.烧伤创面铜绿假单胞菌耐药性与可移动遗传元件的关系[J].中华烧伤杂志,2009,25(2):103-105.
[11]Yu GY,Bian FZ,Zhu JM,etal.Plasmid-mediated resistance determinants in association withβ-lactamases of Shigella[J].Chin J Lab Med,2008,31(11):1245-1248.(in Chinese)苑广盈,边锋芝,朱健美,等.质粒介导的志贺菌超广谱β内酰胺酶及其耐药基因型[J].中华检验医学杂志,2008,31(11):1245-1248.
[12]Wang SL,Song CH,Duan GC,etal.Identification on horizontal transfer of multi-drug resistance related gene fragment of Shigella and its drug-resistance[J].Chin J Zoonoses,2010,26(9):814-817.(in Chinese)王淑玲,宋春花,段广才,等.志贺菌耐多药相关基因水平转移的验证及其耐药性研究[J].中国人兽共患病学报,2010,26(9):814-817.
[13]Zhang R,Huang YL,Wang ZX,etal.Homology analysis of the genotype of extended-spectrumβ-lactamases in Shigella[J].Chin J Infect Dis,2009,27(2):79-80.DOI:10.3760/cma.j.issn.1000-6680.2009.02.005 (in Chinese)张嵘,黄永禄,王宗欣,等.志贺菌同源性和超广谱β-内酰胺类基因型分析[J].中华传染病杂志,2009,27(2):79-80.
[14]Zhang H,Xie YY,Guo MY,etal.A study on resistance mechanism of tert-cephalosporin in Shigella[J].Chin J Microbiol Immunol,2011,31(12):1104-1106.DOI:10.3760/cma.j.issn.0254-5101.2011.12.01 (in Chinese)张环,谢瑶瑶,郭美艳,等.志贺菌耐药特性及对三代头孢菌素耐药机制研究[J].中华微生物学和免疫学杂志,2011,31(12):1104-1106.

