弓形虫MIC6羧基端与醛缩酶相互作用的鉴定
郑 斌,尹志奎,詹希美
刚地弓形虫(Toxoplasma gondii)是一种专性的细胞内寄生原虫,在宿主细胞内繁殖以及破坏宿主细胞,引起致病。弓形虫的入侵机制目前尚未阐明,微线体蛋白(microneme protein,MIC)、菱形体蛋白(rhomboid,ROM)和肌动蛋白(actin)等都参与了弓形虫主动入侵宿主细胞的过程[1-3]。若能利用蛋白相互作用技术,以已知入侵蛋白来探寻一些未知的作用蛋白,则有助于揭示弓形虫的入侵机制。我们在前期的研究中采用GST pull-down技术已筛选到 MIC6羧基端(MIC6C)的作用蛋白[4],本文利用免疫共沉淀(immunoprecipitation,IP)技术对前期研究的初筛结果进行鉴定,并提供细胞定位上的依据。
1 材料与方法
1.1 弓形虫株和主要仪器 弓形虫RH株为中山大学中山医学院寄生虫学教研室传代保种;Olympus研究型生物荧光显微镜(BX51,日本);SPOT彩色面阵CCD(分辨率为1 600×1 200pixel,美国);图像采集卡(CCD附件,美国)。
1.2 主要试剂 硝酸纤维素膜(NC)购自美国PALL公司;免疫共沉淀用 protein G/protein A sepharose购自美国Calbiochem公司;兔免疫前血清、兔源性 GST-MIC6C多克隆抗体(效价1∶8 000)、鼠源性 GST-MIC6C多克隆抗体(效价1∶4 000)、鼠源性醛缩酶-His6多克隆抗体(效价1∶4 000)、鼠源性 Actin-His6多克隆抗体(效价1∶4 000)和兔源性GST-MIC2C多克隆抗体(效价1∶8 000)为本实验室前期制备;免疫印迹增强化学发光法(ECM)试剂盒(大鼠IgG)购自美国Promega公司;X感光胶片为Kodak产品;显影液、定影液、兔抗大鼠IgG-HRP和荧光二抗(羊抗兔IgGTRITC、兔抗大鼠IgG-FITC)购自武汉博士德公司。
1.3 免疫共沉淀实验(immunoprecipitation,IP)制备弓形虫速殖子裂解液[4]。分别取100μL免疫共沉淀用protein G plus/protein A sepharose于2支1.5mL Eppendorf管中,分别加入100μL兔源性GST-MIC6C多克隆抗体和兔免疫前血清,4℃缓慢旋转结合1h。离心,4 000r/min×4min,弃上清,PBS重悬。PBS洗2次,最后1次用Buffer A(50mmol/L KCl,10mmol/L HEPES,pH 7.7,1 mmol/L MgCl2,1mmol/L EDTA,2mmol/L ATP,0.2%Tween-20)洗涤。分别加入600μL弓形虫速殖子裂解液,4℃缓慢旋转结合12h。离心,4 000r/min×4min,弃上清,Buffer A洗涤5次。4×SDS凝胶加样缓冲液重悬sepharose,100℃加热5min,SDS-PAGE,转 NC 膜,分别用大鼠源性GST-MIC6C多克隆抗体、醛缩酶-His6多克隆抗体和Actin-His6多克隆抗体为一抗。兔抗大鼠IgGHRP为二抗温育NC膜,常规漂洗后,免疫印迹增强化学发光法(ECM)检测NC膜。
1.4 间接免疫荧光定位
1.4.1 MIC6蛋白和醛缩酶蛋白在弓形虫体内的定位 新鲜收集的弓形虫速殖子,PBS洗3次,涂片,室温下晾干。3.7%多聚甲醛(多聚甲醛3.7g,加蒸馏水50mL,加热至60℃,搅拌并加入1mol/L NaOH数滴,直至溶液变清,冷却后用0.1mol/L pH 7.4PBS加至100mL)固定,室温20min。PBS-Ca2+液(CaCl21.11g,PBS 100mL)洗5次,室温下封闭液(5%BSA,0.25%Triton-100)封闭1h。PBS洗5次。滴加一抗液(兔源性GST-MIC6C多克隆抗体、鼠源性醛缩酶-His6多克隆抗体),37℃湿盒温育1h。PBS洗5次。滴加荧光二抗(羊抗兔IgG-TRITC),37℃湿盒温育1h。PBS洗5次。滴加荧光二抗(兔抗大鼠IgG-FITC),37℃湿盒温育1 h。PBS洗5次,室温下晾干。荧光显微镜油镜下观察并拍照。
1.4.2 MIC2蛋白(阳性对照蛋白)和醛缩酶蛋白在弓形虫体内的定位 一抗液为兔源性GSTMIC2C多克隆抗体和鼠源性醛缩酶-His6多克隆抗体,余同方法1.4.1。
2 结 果
2.1 免疫共沉淀实验鉴定MIC6C的作用蛋白免疫共沉淀产物SDS-PAGE后,转NC膜,分别用大鼠源性GST-MIC6C多克隆抗体、醛缩酶-His6多克隆抗体和Actin-His6多克隆抗体为一抗。兔抗大鼠IgG-HRP为二抗温育NC膜,常规漂洗后,ECM检测NC膜。在GST-MIC6C多克隆抗体的IP产物中,有3个蛋白条带可分别被大鼠源性GSTMIC6C多克隆抗体、醛缩酶-His6多克隆抗体(antialdolase)和 Actin-His6多克隆抗体(anti-actin)识别,而在免疫前血清的IP产物中未检测到蛋白条带(图1)。

图1 免疫共沉淀实验产物的Western blot分析Fig.1 Western blot analysis of products from immunoprecipitation1:T.gondii lysate;2:The IP experiment products of anti-GST-MIC6C;3:The IP experiment products of preimmune serum
2.2 MIC6蛋白和醛缩酶蛋白在弓形虫体内的间接荧光定位 新鲜弓形虫速殖子涂片,多聚甲醛固定,封闭液封闭。一抗液(兔源性GST-MIC6C多克隆抗体、鼠源性醛缩酶-His6多克隆抗体)常规温育、漂洗,先滴加羊抗兔IgG-TRITC荧光二抗,温育、漂洗,再滴加兔抗大鼠IgG-FITC荧光二抗,温育、漂洗,室温下晾干。荧光显微镜下观察。首先在自然光源下观察玻片上虫体,拍照。更换到荧光光源,FITC在495nm激化,525nm发射荧光,呈绿色荧光。拍照。TRITC最大吸收光谱550nm,发射光谱600~620nm,呈现橙红色荧光。SPOT 4.0.2和Photoshop 8.0分析图像。在虫体的顶端可观察到红色荧光(MIC6蛋白)和绿色荧光(醛缩酶蛋白)(图2)。
2.3 MIC2蛋白(阳性对照蛋白)和醛缩酶蛋白在弓形虫体内的间接荧光定位 一抗液采用兔源性GST-MIC2C多克隆抗体、大鼠源性醛缩酶-His6多克隆抗体,荧光二抗同上,荧光显微镜下观察并拍照。SPOT 4.0.2和 Photoshop 8.0分析图像。在虫体的顶端可观察到红色荧光(MIC2蛋白)和绿色荧光(醛缩酶蛋白)(图3)。

图2 MIC6蛋白和醛缩酶蛋白在弓形虫顶端的定位Fig.2 MIC6and aldolase are apically localized in T.gondii MIC6was localized using rabbit anti-MIC6Cand goat anti-rabbit conjugated to TRITC (red);aldolase was visualized using rat anti-aldolase and rabbit anti-rat conjugated to FITC (green)
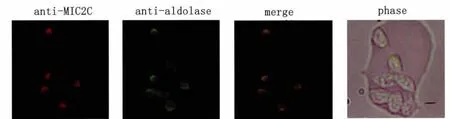
图3 MIC2蛋白和醛缩酶蛋白在弓形虫顶端的定位Fig.3 MIC2and aldolase are apically localized in T.gondii MIC2was localized using rabbit anti-MIC2Cand goat anti-rabbit conjugated to TRITC (red);aldolase was visualized using rat anti-aldolase and rabbit anti-rat conjugated to FITC (green)
3 讨 论
弓形虫的 MIC6和 MIC1、MIC4组成 MIC6-MIC1-MIC4复合体参与虫体的入侵过程。MIC1具有凝集素特性,在识别、粘附宿主细胞中发挥重要作用[5];MIC4有6个富含半胱氨酸的苹果模序(apple motif)结构,其第5个苹果模序具有潜在的半乳糖粘合特性,很可能干预宿主的免疫保护过程[6]。MIC6的氨基端(N端)通过 MIC1连接 MIC4,MIC6的跨膜区将 MIC6-MIC1-MIC4复合体固定于膜上,经初步筛选,MIC6的羧基端(MIC6C)与醛缩酶作用参与虫体入侵[4]。该作用蛋白为GST pull-down技术筛选获得,为排除 GST pull-down技术有时会因蛋白质的电荷、第三者的中介等产生假阳性结果,有必要采用其它的蛋白作用技术来鉴定MIC6C的作用蛋白。
免疫共沉淀实验的结果表明在自然状态下与MIC6C端作用的蛋白是醛缩酶,即无论在虫体内(免疫共沉淀的结果)或虫体外(GST pull-down的结果),MIC6C与醛缩酶都存在相互作用;此结果也与Jewett等的结论相符[7]。MIC6和醛缩酶的间接免疫荧光定位显示两蛋白共定位于虫体的顶端,为MIC6和醛缩酶相互作用的确立提供了细胞定位学上的证据。至于MIC6和醛缩酶的作用位点如何则有待于进一步的研究。
[1]Dowse TJ,Pascall JC,Brown KD,etal.Apicomplexan rhomboids have a potential role in microneme protein cleavage during host cell invasion[J].Int J Parasitol,2005,35(7):747-756.DOI:10.1016/j.ijpara.2005.04.001
[2]Santos JM,Graindorge A,Soldati-Favre D.New insights into parasite rhomboid proteases[J].Mol Biochem Parasitol,2012,182(1/2):27-36.DOI:10.1016/j.molbiopara.2011.11.010
[3]Daher W,Klages N,Carlier MF,etal.Molecular characterization of Toxoplasma gondii formin 3,an actin nucleator dispensable for tachyzoite growth and motility[J].Eukaryot Cell,2012,11(3):343-352.DOI:10.1128/EC.05192-11
[4]Zheng B,Yin ZK,He A,etal.Screening the protein interacts with C terminal of MIC6of Toxoplasma gondii[J].Chin J Zoo-noses,2011,27(11):970-974.(in Chinese)郑斌,尹志奎,何蔼,等.弓形虫MIC6羧基端相互作用蛋白的筛选[J].中国人兽共患病学报,2011,27(11):970-974.
[5]Friedrich N,Santos JM,Liu Y,etal.Members of a novel protein family containing MAR domains act as sialic acid-binding lectins during host cell invasion by apicomplexan parasites[J].J Biol Chem,2010,285(3):2064-2076.DOI:10.1074/jbc.M109.060988
[6]Marchant J,Cowper B,Liu Y,etal.Galactose recognition by the apicomplexan parasite Toxoplasma gondii[J].J Biol Chem,2012,287(20):16720-16733.DOI:10.1074/jbc.M111.325928
[7]Jewett TJ,Sibley LD.Aldolase forms a bridge between cell surface adhesins and the actin cytoskeleton in apicomplexan parasites[J].Mol Cell,2003,11(4):885-894.DOI:10.1016/S1097-2765(03)00113-8

