流产布鲁氏菌疫苗A19-ΔVirB12突变株生物学特性研究
易新萍,谷文喜,吴冬玲,李延涛,马晓菁,叶 锋,刘丽娅,薛 晶,钟 旗
2.新疆天康畜牧生物技术股份有限公司,乌鲁木齐830032
布鲁氏菌病(Brucellosis,简称布病)是由布鲁氏菌(Brucella)引起的以感染家畜为主的人兽共患传染病。布鲁氏菌具有宿主广泛、传染性强以及感染后根治困难等特点,对畜牧业和人类健康均构成严重威胁。迄今该病已波及到世界各地,许多国家和地区都有人畜布鲁氏菌病的存在和流行[1-3]。近几年,我国布鲁氏菌病的发病率呈明显上升趋势,而带菌的动物是其他动物和人类布病的主要传染源。因此,加强动物布鲁氏菌病的防控势在必行,这对防控人间布病具有重要的意义[4]。在正确诊断和捕杀患病动物切断传染源的基础上,接种疫苗是公认的能够降低动物布病发生和传播的最实际、最有效的方法之一[5]。用于预防牛布鲁氏菌病的A19疫苗在我国使用至今已有60余年,为有效地控制牛布病提供了重要保障,但同时也存在一定的缺陷。即A19疫苗缺乏鉴别诊断标记,疫苗接种动物与自然患病动物无法甄别,造成布鲁氏菌无法在畜群中根除,严重地影响了布鲁氏菌病的诊断、检疫。因此,研制具有诊断标记的A19疫苗是布病疫苗研究的热点之一[6-9]。
以我国A19疫苗为亲本株,应用同源重组技术敲除布鲁氏菌IV型分泌系统中VirB12基因而成功构建了A19-ΔVirB12突变株。本研究对 A19-ΔVirB12突变株菌落形态、毒力、遗传稳定性、免疫原性等生物学特性进行测定,评价了A19-ΔVirB12突变株的免疫效果,为动物布鲁氏菌分子标记疫苗株的研制提供数据参考,以期布鲁氏菌病综合防治技术提供支持。
1 材料和方法
1.1 菌株 流产布鲁氏菌标准菌株2308、流产布鲁氏菌疫苗株A19(B.abortusvaccine A19)和流产布鲁氏菌标记疫苗候选株A19-ΔVirB12,均由新疆维吾尔自治区畜牧科学院兽医研究所细菌室构建或保存。
1.2 试剂 Brucella Broth培养基(TSB)和 Brucella Agar(TSA)培养基购自美国BD公司。布鲁氏菌抗原及血清购自中国疾病预防控制中心传染病研究所。PCR mix购自北京庄盟生物技术有限公司。
1.3 实验动物 BALB/c雌鼠购自新疆实验动物研究中心,许可证号:SCXK(新)2003-0002。BALB/c雌鼠饲养于新疆天康畜牧生物技术股份有限公司三级生物安全实验室的负压隔离笼具中。
1.4 A19-ΔVirB12的培养特性 取布鲁氏菌A19-ΔVirB12与A19纯培养物在Brucella Agar培养基上划线培养,肉眼观察菌落形态。革兰氏染色法和柯兹洛夫斯基染色法染色,显微镜下观察细菌形态及染色情况。
1.5 血清凝集试验 分别将30μL A19-ΔVirB12抗原与布鲁氏菌光滑型或粗糙型血清等量混合,反应1~2min观察抗原悬液与光滑型或粗糙型血清因子的凝集反应情况。
1.6 变异检查 对A19-ΔVirB12继代菌株做结晶紫染色,同时将制备的A19-ΔVirB12抗原与0.1%吖啶黄染液各30μL等量混合,37。C反应6h后取出置室温,次日观察菌体悬液的凝集情况,鉴定其是否发生变异。
1.7 传代稳定性
1.7.1 体外传代试验 挑取A19-ΔVirB12单菌落接种于5mL TSB液体培养基中,37。C条件下180r/min培养36h后进行变异检查(结晶紫染色和吖啶黄凝集试验)和PCR鉴定[10]。取液体培养菌液按1∶100比例接种至新的TSB液体培养基中振荡培养36h,再次对培养菌液进行变异检查及PCR鉴定,如此反复在体外传至25代,观察菌株 A19-ΔVirB12的体外传代稳定性。根据GenBank序列(AF226278)设计VirB12基因鉴别引物,即上游引物 (VirB12-F)5′-CGTCGGAACCG CTCTATA GGTC-3′,下 游 引 物 (VirB12-R)5′-GTCAGCTTCTCGCCAACACAAG-3′。
1.7.2 体内传代试验 选择6周龄BALB/c鼠3只,接种疫苗候选株A19-ΔVirB12,剂量为5×104CFU/只。10d剖杀,无菌取其脾脏制备组织匀浆,涂布于TSA培养基上,待长出菌落后并制备成菌悬液,将第2代接种物以上述方式继代接种第2批BALB/c鼠。如此反复在BALB/c鼠体内进行传代,并对各代次分离菌株与初代接种菌株进行基因型和表型比较。
1.8 毒力测定 取6周龄雌性BALB/c小鼠20只,随机分为2组,分别以10亿CFU皮下接种A19和A19-ΔVirB12,15d剖杀取脾脏匀浆进行细菌分离计数,统计每克脾脏载菌量以评价其毒力。
1.9 免疫保护力测定 取6周龄雌性BALB/c小鼠30只,随机分为3组,每组10只,并分别腹腔接种 A19、A19-ΔVirB12和PBS,参照文献[11],以5.0×104CFU/只剂量接种免疫。接种后第45d分别用布鲁氏菌标准菌株2308对各组小鼠进行攻毒试验,剂量为3.0×104CFU/只。攻毒后15d剖杀各组小鼠,取脾脏匀浆进行细菌分离计数,SPSS 11.5软件分析比较免疫组及PBS对照组中小鼠体内的细菌数量。
2 结 果
2.1 A19-ΔVirB12的培养特性 在TSA培养基平板上划线培养,72h则可发现 A19和 A19-ΔVirB12菌株均具有淡蓝色、半透明的针尖大小菌落,且二者形态大小基本一致;95%以上的菌落属光滑型,菌落边缘整齐,圆润,露滴状,微带蓝色乳光(图1)。在TSB液体培养基中生长均匀,浑浊,不透明。
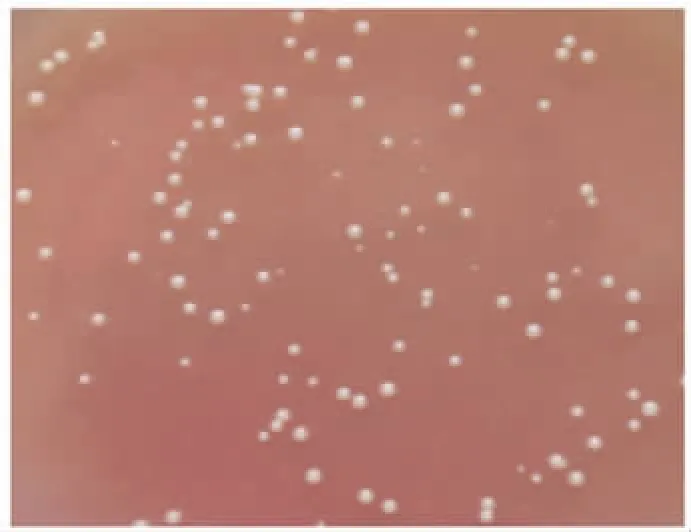
图1 A19-ΔVirB12菌株的培养Fig.1 Culture of A19-ΔVirB12strain
2.2 菌落染色特性 将A19-ΔVirB12菌落涂片,进行革兰氏和柯兹罗夫斯基染色并镜检鉴定。A19-ΔVirB12为球杆菌,单个散在,无鞭毛,不形成芽孢和荚膜。A19-ΔVirB12革兰氏染色呈红色,柯兹罗夫斯基染色的布鲁氏菌呈红色,背景为绿色(图2,图3)。
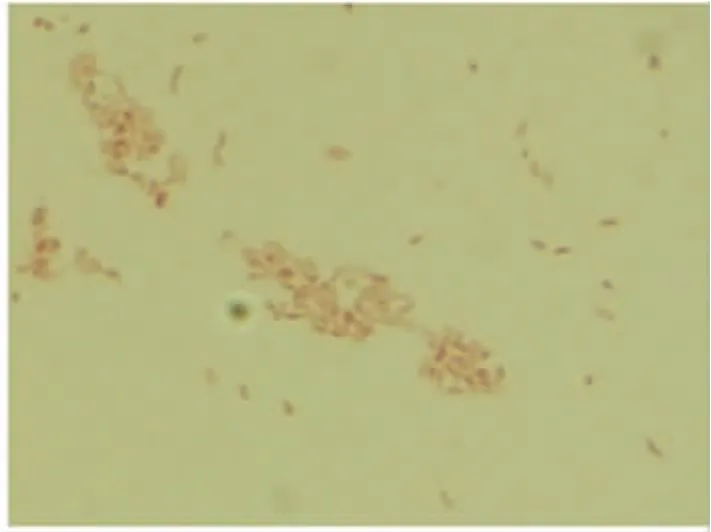
图2 A19-ΔVirB12革兰氏染色Fig.2 Gram staining of A19-ΔVirB12strain
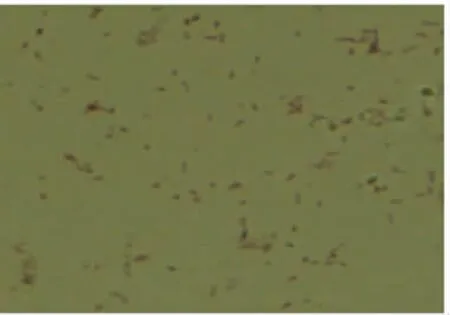
图3 A19-ΔVirB12柯兹罗夫斯基染色Fig.3 Cozy Roelfs Ki staining of A19-ΔVirB12strain
2.3 血清凝集实验 疫苗株A19与A19-ΔVirB12菌与光滑型菌株免疫动物的血清凝集,与粗糙型菌株免疫血清不凝集反应,表明A19和A19-ΔVirB12均具备光滑型布鲁氏菌特性。
2.4 变异检查 A19-ΔVirB12抗原与0.1%吖啶黄染液各30μL等量混合,37。C反应6h后取出置室温,次日观察菌体悬液为均匀混浊状态,表明A19-ΔVirB12为光滑型菌液。A19-ΔVirB12菌落结晶紫染色呈浅黄色,表明其菌落形态为光滑型。
2.5 传代稳定性
2.5.1 体外传代 将 A19-ΔVirB12菌株用 TSB液体培养基体外连续传至30代,取每代菌液及其固体培养基划线接种物,通过吖啶黄凝集试验和菌落结晶紫染色试验检测,各代次A19-ΔVirB12均不与吖啶黄溶液凝集,且结晶紫染色的菌落均匀一致,均呈浅黄色。以布鲁氏菌VirB12基因为鉴定引物,分别每隔5代选取部分菌落进行PCR鉴定,A19参考株PCR扩增目的片段为713bp,A19-ΔVirB12突变株PCR扩增目的片段为236bp。结果表明,A19-ΔVirB12突变株在体外传代稳定,缺失的VirB12基因没有发生重组而重新恢复获得VirB12基因(图4)。
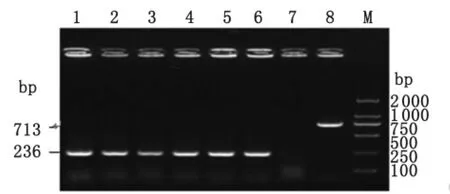
图4 A19-ΔVirB12体外传代的PCR鉴定Fig.4 Identification of A19-ΔVirB12 in vitro by PCR 1:The first generation of A19-ΔVirB12strain;2:The fifth generation of A19-ΔVirB12strain;3:The tenth generation of A19-ΔVirB12strain;4:The fifteen generation of A19-ΔVirB12strain;5:The twentieth generation of A19-ΔVirB12strain;6:The twenty-fifth generation of A19-ΔVirB12strain;7:Negative control;8:A19;M:DL2000DNA marker.
2.5.2 体内传代 将剖杀的BALB/c鼠脾脏分离布鲁氏菌,按照2.5.1中PCR方法对各代次分离的细菌进行PCR鉴定,结果表明从BALB/c鼠脾脏分离的每代A19-ΔVirB12株扩增目的条带为236bp,均缺失VirB12部分基因,结果见图5。
2.6 毒力测定 表1结果表明A19-ΔVirB12突变株每克脾脏含菌量低于1.0×106CFU,为弱毒株。相比较于A19株,A19-ΔVirB12在BALB/c鼠的克脾菌数低于A19,表明A19-ΔVirB12标记株毒力稍弱于A19株。
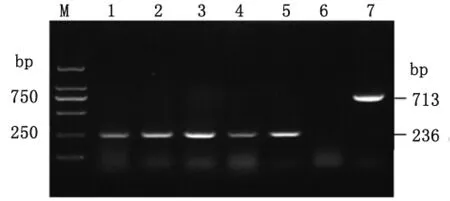
图5 A19-ΔVirB12BALB/c鼠体内传代的PCR鉴定Fig.5 Identification of A19-ΔVirB12 in vivo with BALB/c mice by PCR M:DL2000DNA marker;1:The first generation of A19-ΔVirB12strain;2:The second generation of A19-ΔVirB12strain;3:The third generation of A19-ΔVirB12strain;4:The fourth generation of A19-ΔVirB12strain;5:The fifth generation of A19-ΔVirB12strain;6:Negative control;7:A19
2.7 免疫保护力测定 将A19和 A19-ΔVirB12菌株培养增殖计数,以5.0×104CFU/只剂量免疫BALB/c鼠,在第45d分别对每组BALB/c鼠攻毒强毒菌株2308,攻毒后15d剖杀并无菌采集脾脏匀浆进行攻毒菌株分离。通过比较免疫接种组和对照组小鼠每克脾脏中攻毒菌株2308的载菌量(克脾指数),评价各菌株的免疫保护效果,结果见表2。由表2可知,与PBS对照组相比,A19和 A19-ΔVirB12均对BALB/c鼠有一定程度的免疫保护,且A19和A19-ΔVirB12之间差异无统计学意义(P>0.05),A19-ΔVirB12株并没有因为缺失 VirB12基因而使其免疫保护力下降。
3 讨 论
我国应用牛布鲁氏菌A19疫苗株在防治牛布鲁氏菌病方面取得明显的效果,但常规血清学检测与诊断方法不能将其与自然感染相区分,这对我国布鲁氏菌病防治与净化是不利的。解决该难题的方法之一是寻找具有抗原性的蛋白抗原,然后敲除相应的基因,建立相应的检测方法。本研究以牛流产布鲁氏菌A19弱毒疫苗株为亲本株,通过同源重组技术将四型分泌系统中VirB12基因敲除,PCR证实了构建的标记疫苗株VirB12基因被敲除,获得了具有诊断标记抗原的A19-ΔVirB12突变株。

表1 A19株和A19-ΔVirB12株毒力测定Tab.1 Determination on virulence of A19and A19-ΔVirB12strains
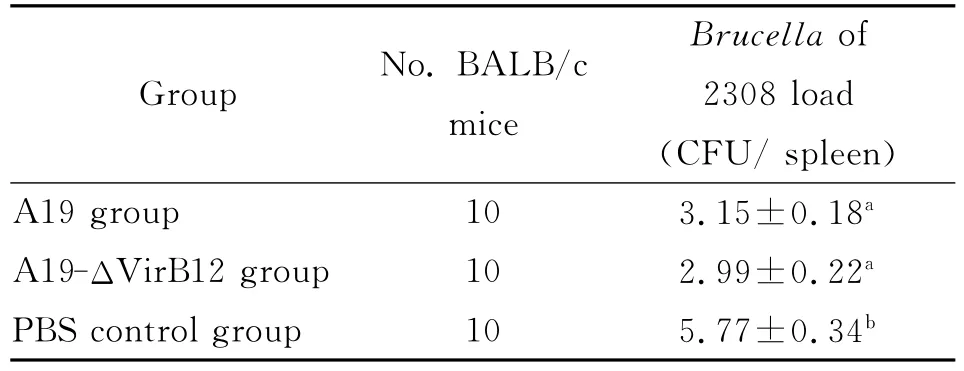
表2 A19和A19-ΔVirB12对BALB/c鼠免疫保护力Tab.2 Protection of immunized mice against 2308strainchallenging
布鲁氏菌的Ⅳ型分泌系统(T4SS)由一个含有12个可跨越细菌被膜的多蛋白复合物家族组成,并由同一启动子调控,是继脂多糖之后又一个关键的致病力因子[12]。VirB1~12是细菌在细胞内复制和形成持续感染所必须的,与其在宿主细胞内生存、复制有关[13-16]。其中 VirB12基因由519bp组成,编码173个氨基酸,VirB12蛋白分子量约17kDa。相关研究证实VirB12在牛种布鲁氏菌感染中是一种免疫原性蛋白,在小鼠感染布鲁氏菌的过程中均有表达,但在T4SS中并不是必需蛋白,它可作为一种布鲁氏菌血清学检测标记抗原[17]。因此,本研究中将成功构建的缺失VirB12基因的A19-ΔVirB12突变株为研究对象,对该突变株毒力和免疫保护力进行评价,实验进一步证实VirB12基因的缺失对该菌株毒力有所减弱,但对其免疫保护力基本无影响。同时,以VirB12蛋白作为标记诊断抗原可建立布鲁氏菌血清学检测方法,这为鉴别区分A19-ΔVirB12疫苗免疫与自然感染的血清学方法奠定了基础。
与布鲁氏菌传统实验鉴定方法相对比,PCR检测方法具有快速、特异,并能降低实验室操作者的感染风险等优点,对鉴别区分布鲁氏菌牛流产野毒株和疫苗株有重要的实际应用价值[18]。本研究以VirB12基因作为鉴别诊断标记,建立了区分鉴定布病A19-ΔVirB12疫苗株与野毒流行菌株的PCR鉴定方法,该诊断方法弥补了传统布鲁氏菌鉴定方法的不足,为布病的流行病学调查及防控措施的制定提供科学的技术支撑。
综上所述,对A19-ΔVirB12突变株的基本特性、小鼠毒力和免疫保护效力测定,初步确定该菌株遗传背景清晰、遗传性状稳定,具备布鲁氏菌病新型标记疫苗的基本特性。动物实验结果初步显示,布鲁氏菌分子标记A19-ΔVirB12疫苗株毒力弱于亲本株A19,但其免疫保护力在BALB/c鼠体内与亲本菌株A19无显著差异,有望开发成为布鲁氏菌病标记疫苗。以敲除的VirB12基因为诊断标记,可建立区分布病A19-ΔVirB12疫苗株与流行菌株的病原学PCR鉴定方法。以VirB12基因编码表达的VirB12蛋白作为标记抗原,可建立鉴别区分A19-ΔVirB12疫苗免疫与自然感染动物的血清学方法,明显提升了原有A19疫苗的功能,但究竟A19-ΔVirB12突变株在靶动物体内的免疫效力如何还需进一步评价。
[1]Cutler SJ,Whatmore AM,Commander NJ.Brucellosis-new aspects of an old disease[J].J Appl Microbiol,2005,98:1270-1281.DOI:10.1111/j.1365-2672.2005.02622.x
[2]Gul ST,Khan A.Epidemiology and epizootology of brucellosis:a review[J].Palostam Vet J,2007,27(3):145-151.
[3]Cui BY.Brucellosis epidemic monitoring and control in China[J].Dis Surveill,2007,22(10):649-651.(in Chinese).崔步云.中国布鲁氏菌病疫情监测与控制[J].疾病监测,2007,22(10):649-651.
[4]Xu JP,Liu LJ,Li X,et al.Epidemiological survey of brucellosis of cattle and sheep[J].Chin J Vet Med,2008,44(8):78-79.(in Chinese)徐建平,刘丽洁,李霞,等.牛羊布鲁氏菌病流行病学调查[J].中国兽医杂志,2008,44(8):78-79.
[5]Gerhardt G,Schurig NA,Michael J.Bruceuosis vaccines:past,present and future[J].Vet Mmicrobial,1990,20(20):479-496.
[6]Eleonora C,Silvio LC,Laura D,et al.BrucellaabortusINTA2,a novel strain 19-Δbp26:lucΔbmp18double mutant lacking drug resistance markers[J].Vet Microbiol,2002,87:1-13.DOI:10.1016/S0378-1135(02)00016-0
[7]Boschirol M,Cravero S,Arese A,et al.Protection against infection in mice vaccinated with aBrucellaabortus mutant[J].Infec Immun,1997,65(2):798-800.
[8]Yan GM,Wang XL,Ren LZ,et al.Construction of molecular marker and virulence deleted vaccine strainΔS19-2ofB.abortus[J].Chin J Vet Sci,2007,27(5):690-694,699.(in Chinese)闫广谋,王兴龙,任林柱,等.布鲁氏菌分子标记、毒力缺失疫苗株ΔS19-2的构建[J].中国兽医学报,2007,27(5):690-694-699.
[9]Zheng XH,Hu S,Wang JL,et al.Construction of mutant SBrucellaAbortusS19strain and evaluation of immunization in mice[J].Chin J Prev Vet Med,2009,31(11):887-891,913.(in Chinese)郑孝辉,胡森,王加兰,等.流产布氏杆菌S19突变株构建及在小鼠感染模型中的免疫保护评估[J].中国预防兽医学报,2009,31(11):887-891-913.
[10]Zhong Q,Yi XP,Wang LJ,et al.Determination of marker vaccine ofBrucellaabortusA19strain and virulence and immunity[P].China,201210190126.0.钟旗,易新萍,王力俭,等.布鲁氏菌病A19分子标记疫苗株的构建及毒力和免疫原性测定[P].中国,201210190126.0.
[11]Yi XP,Gu WX,Li JP,et al.Establishment of BALB/c mouse model for evaluation of protective immunity inBrucellaabortus[C].Beijing:The Fourth Veterinary Conference,2012:221-225.(in Chinese)易新萍,谷文喜,李金平,等.评价牛型布鲁氏菌疫苗免疫保护力BALB/c鼠模型的建立[C].北京:第四届兽药大会论文集,2012:221-225.
[12]David OC,Chantal C,Allardet S,et al.A homologue of theAgrobacteriumtumefaciensVirB andBordetellapertussisPtl type IV secretion systems is essential for intracellular survival ofBrucellasuis[J].Mol Microbiol,1999,33(6):1210-1220.DOI:10.1046/j.1365-2958.1999.01569.x
[13]Rouot B,Alvarez-Martinez MT,Marius C,et al.Production of the type IV secretion system differs am ongBrucellaspecies as revealed with VirB5and VirB8Specific antisera[J].Infect Immun,2003,7l(3):1075-1082.DOI:10.1128/IAI.71.3.1075-1082.2003
[14]Huppner C,Carle A,Sivanesan D,et al.The putative lyric transglycosylase VirB1fromBrucellasuis interacts with the type IV secretion system core components VirB8,VirB9and VirB11[J].Microbiology,2005,l51:3469-3482.DOI:10.1111/j.1467-9396.2009.00845.x
[15]Patey G,Qi Z,Bourg G,et al.Swapping of periplasmic domains betweenBrucellasuisVirrB8and a pSB102VirB8homologue allows heterologous complementation[J].Infect Immun,2006,74(8):4945-4949.DOI:10.1116/1.2172950
[16]den Hartigh AB,Sun YH,Sondervan D,et al.Differential requirements for VirB1and VirB2duringBrucellaabortusinfection[J].Infect Immun,2004,72(9):5143-5l49.DOI:10.1128/IAI.72.9.5143-5149.2004
[17]Rolan HG,den Hartigh AB,Kahl MM,et al.VirB12is a serological marker of Brucella infection in experimental and natural hosts[J].Clin Vaccine Immunol,2008,15 (2):208-214.DOI:10.1128/CVI.00374-07
[18]Zhong Q,Yi XP,Li B,et al.Study and application of polymerase chain reaction assay onBrucellaidentification[J].Chin J Zoonoses,2011,27(3):241-245.(in Chinese)钟旗,易新萍,李博,等.布鲁氏菌PCR鉴定方法的研究与应用[J].中国人兽共患病学报,2011,27(3):241-245.

