猪源耐甲氧西林金黄色葡萄球菌的耐药表型及其SCCmec基因分型研究
王雪敏,姚建楠,,李蓓蓓,杨传定,邵东华,王少辉,马志永
甲氧西林金黄色葡萄球菌(Methicillin-resistantStaphylococcusaureus,MRSA)目前已经成为医院和社区获得性感染的主要病原菌之一,它可以引起人的心内膜炎、肺炎、菌血症等致死性感染[1]。近年来,MRSA的临床分离率呈明显上升趋势,并且对临床使用的多种常用抗菌药物表现出交叉耐药和多重耐药的特点,这给临床治疗带来了严峻挑战。MRSA的耐药机制主要是获得了外源性甲氧西林决定子基因(methicillin-resistant determinant A,mecA),该基因编码青霉素结合蛋白2α,造成对所有β-内酰胺类药物耐药。而SCCmec是一种可移动的遗传元件,该元件还携带除mecA基因外的其他抗生素耐药基因,造成多重耐药。SCCmecⅠ,Ⅱ,Ⅲ型主要存在于医院获得性MRSA(Hospitalacquired/associated MRSA,HA-MRSA)中,该菌种中mecA复合体的下游带有多个质粒及转座子。SCCmecIV型和SCCmecV型通常存在于社区获得性 MRSA(Community-acquired/associated MRSA,CA-MRSA)和非多重耐药 MRSA菌株中,其分子较小,除mecA外几乎不携带其他多重耐药基因,易移动并通过质粒或噬菌体传播至不同遗传背景的葡萄球菌中,容易在人群中传播和定植。杀白细胞素(Panton-Valetine Leukocidin,PVL)是金黄色葡萄球菌产生的一种可以导致坏死性感染的细胞外毒素,严重时可以引起人的坏死性肺炎等[2]。近年来,MRSA流行病学发生很大变化,出现了另一类导致人类严重感染的牲畜相关性 MRSA(Livestock-associated MRSA,LA-MRSA),已有多篇文献报道LA-MRSA能够在猪和人之间传播[3-5],所以猪源MRSA引起了全世界的广泛关注。本研究通过调查上海地区猪源MRSA的流行状况、耐药谱特征及其SCCmec基因分型特点,阐明上海地区猪源MRSA的流行情况及其主要的流行型,以期指导猪场合理用药,同时为动物源MRSA向人传播的风险评估提供科学依据。
1 材料与方法
1.1 样品及标准菌株来源 于2011年8月—2012年5月分别在上海市5个规模化猪场和1个屠宰场,采集猪鼻腔拭子样品共计232份。质控菌株ATCC 29213来源于本实验保存。
1.2 主要试剂及抗生素来源 MH肉汤,脑心浸液培养基 (BHI),7.5% 氯 化 钠 肉 汤 (7.5%Sodium Chloride Broth)均购自青岛海博生物技术有限公司;金黄色葡萄球菌显色培养基购自上海市科玛嘉微生物技术有限公司;抗生素阿奇霉素(AZI)、红霉素(ERY)、氯霉素(CHL)、氟苯尼考(FLO)和诺氟沙星(NOR)购自山西恒丰强动物药业有限公司;庆大霉素(GEN)购自濮阳泓天威药业有限公司;头孢噻呋(CEF),万古霉素(VAN)购自浙江海正有限公司;利奈唑胺(LNZ),瑞他怕林(REP)购自上海景颜化工科技有限公司;苯唑西林(OXA),沃尼妙林(VAL),泰妙菌素(TIA),阿米卡星(AMK)购自浙江康恩贝股份有限公司;2×Taq PCR MasterMix,2 000bp DNA Ladder Marker及细菌基因组提取试剂盒均购自天根生化科技有限公司(北京)。
1.3 引物 本研究使用引物(见表1)均由英俊生物技术有限公司(上海)合成。
1.4 DNA的提取 根据细菌基因组DNA提取试剂盒(天根)说明书提取,-20。C保存备用。
1.5SA和MRSA的分离鉴定 将采集的猪鼻腔拭子浸出液先接种于7.5%氯化钠肉汤中,37。C,200 r/min摇床培养12~16h,然后划线于科玛嘉显色培养基,37。C培养24h,再挑取疑似菌落接种于BHI培养基中37。C培养12~16h。nuc基因和mecA基因进行双重PCR鉴定SA或MRSA。
1.6 MRSA 的耐药性检测 参照 CLSI[7]标准用肉汤稀释法测定药物最小抑制浓度(MIC)。
1.7 SCCmec基因分型 SCCmec基因分型采用多重PCR,引物及反应条件参照文献[7]。
1.8PVL基因检测 采用20μL反应体系,体系参数为:2×Taq PCR MasterMix(天根)10μL,DNA模板0.5μL,PVL基因上下游引物[8]各0.5 μL,去离子水8.5μL。PCR循环参数为95。C预变性4min,94。C40s、55。C30s、72。C1min,共31个循环,72。C终延伸7min,对PCR产物进行电泳检测。
2 结果与讨论
2.1 SA和MRSA的分离鉴定 232个样品通过7.5%氯化钠肉汤预增菌,科玛嘉显色培养基显色培养及双重PCR方法分离得到139株SA,其中70株MRSA,占总样品数的30.2%(70/232),与已报道的国内猪群中MRSA检出率比较,高于河北地区(25.0%),明显高于湖北地区(12.1%),陕西地区(8.5%),四川地区(1.6%)等[9]。值得注意的是本研究各个猪场间MRSA检出率不尽相同,尤其以浦东地区的检出率最低(表2)。存在这种差异性的原因可能与各个猪场猪的来源、抗生素的使用、喂养的方式、环境因素等有关。

表1 引物序列Tab.1 Primer sequence
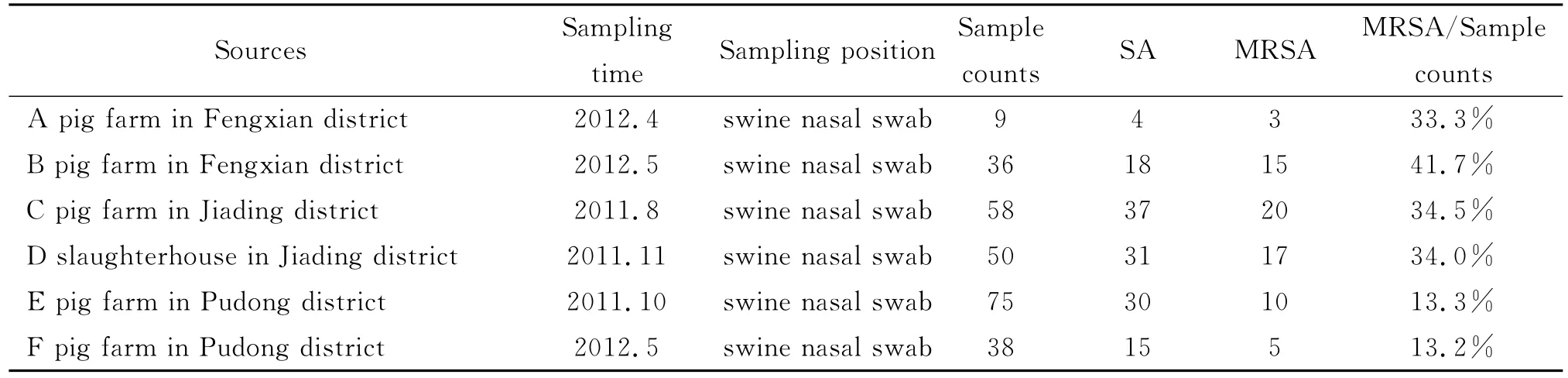
表2 上海地区SA及MRSA检测结果Tab.2 Isolation results of SA and MRSA in Shanghai areas
2.2 MRSA抗菌药物耐药性及SCCmec基因分型
猪源MRSA对14种常用抗生素的耐药性,表现出交叉耐药和多重耐药的特点。除对LNZ、VAN和AMK全部敏感外,对CEF、GEN和NOR耐药率分别为74.3%,62.9%和42.9%;对 AZI、ERY、CHL、FLO和OXA耐药率100%,对重要人医用药REP和重要畜禽专用药VAL和TIA也全部耐药。MRSA对14种抗生素的耐药数据见表3。MRSA的多重耐药一直是临床治疗面临的难题,伴随着近年来MRSA分离率增加,这一问题显得尤为突出。从本研究药敏试验结果可以看出,猪源MRSA的耐药率很高,除了对LNZ、VAN和AMK敏感外,其余11种都有耐药,且多表现为多重耐药。值得注意的是,本研究发现所有MRSA菌株对截短侧耳类药物REP,VAL和TIA表现出高水平耐药。截短侧耳类药物是在天然化合物截短侧耳素(pleuromutilin)的基础上进行化学修饰改造获得的一类抗菌药物。该类药物的代表泰妙菌素和沃尼妙林是畜禽专用药,用于兽医临床上多种细菌感染的治疗。近年来兴起了开发新的截短侧耳类衍生物用于治疗人类细菌感染。Retapamulin是第一个用于人医的截短侧耳类药物,2007年被批准用于由金黄色葡萄球菌和酿脓链球菌引起的皮肤感染和伤口感染。研究表明,REP耐药株在人源金黄色葡萄球菌中检出率非常低(5 676株中仅6株表现敏感性降低或者耐药[10]),这也说明该类药物在人医上的开发潜力巨大。与人源相比,动物源金黄色葡菌对截短侧耳类药物的耐药情况则非常严重。在对瑞士2009—2010年间分离的耐甲氧西林金黄色葡萄球菌(MRSA)的研究中发现,90%的菌株对泰妙菌素耐药[11]。在德国GERM-Vet项目中分离到的68株MRSA中有9株检测到对截短侧耳类药物的耐药。这些菌株不仅来源于猪,而且还分离自牛、火鸡以及零售肉制品[12]。本实验所有猪源 MRSA菌株对3种截短侧耳类药物全部表现高水平耐药,应引起我们足够重视,这也提示我们要防控动物源耐药菌/耐药基因通过食物链或者环境向人类的传播,否则一些类似于REP的新型抗菌药物在人医上的应用前景将大打折扣。
本研究是首次对上海地区猪源MRSA耐药基因进行分型,结果发现所有猪源MRSA SCCmec分型均为Ⅳb型,与王新等报道的陕西地区猪源MRSA SCCmec基因型一致,与崔生辉等[9]报道的四川地区(SCCmecⅢ型),河北地区(SCCmecⅢ型),湖北地区(SCCmecⅢ型)猪源MRSA分型不一致。本次试验并未检测到PVL毒力基因。根据文献报道我国人源医院相关性 MRSA(Hospital-acquired/associated MRSA,HA-MRSA)主要流行SCCmecⅢ型,并且具有交叉耐药和多重耐药的特点[13-14]。另一类社区相关性 MRSA(Community-acquired/associated MRSA,CA-MRSA)则主要流行 SCCmecⅣ和SCCmecⅤ型,但为非多重耐药性菌株[14]。本研究结果显示SCCmecⅣb型的猪源MRSA的耐药性严重,不同于SCCmecⅣ型的非多重耐药性CA-MRSA,推测猪源MRSA可能存在其他耐药机制,还有待进一步的研究证明。这也警示我们应该谨防猪源MRSA通过食物链或环境向社区传播,否则一些非多重耐药性CA-MRSA成为耐药性菌株,对公共卫生和人类健康构成严重威胁。
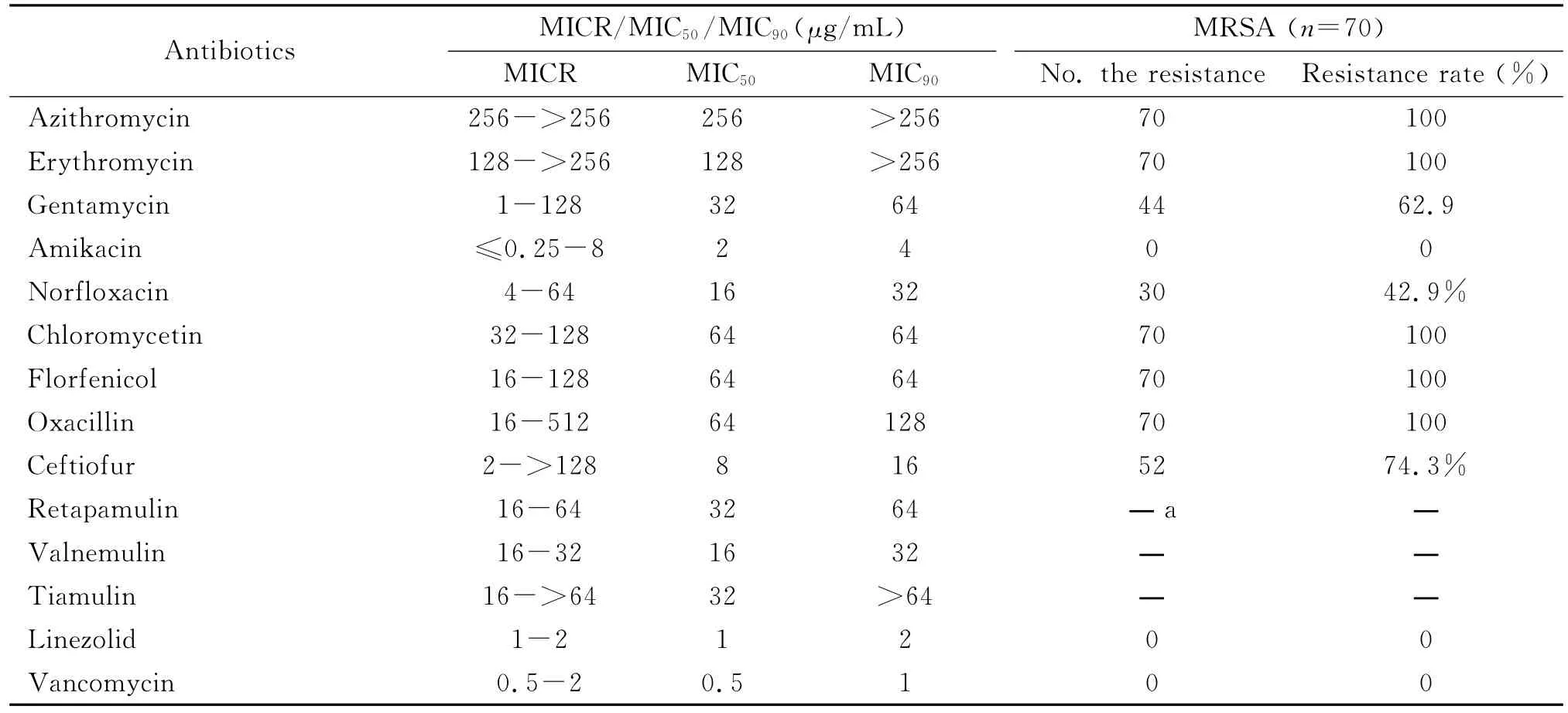
表3 MRSA对14种抗生素的耐药数据Tab.3 Antimicrobial susceptibility data of MRSA to 14antibiotics
[1]Duijkeren EV,Jansen MD,Flemming SC,et al.Methicillin-resistantStaphylococcusaureusin pigs with exudative epidermitis[J].Emerg Infect Dis,2007,13(9):1408-1410.DOI:10.321/eid1309.061268
[2]Du N,Hu BJ,Chu YZ.Detection of SCCmectyping and toxic genes of methicillin-resistantStaphylococcusaureusat five teaching hospitals in China[J].Chin J Lab Med,2007,30(5):499-504.(in Chinese)杜娜,胡比杰,褚云卓.我国五家教学医院耐甲氧西林金黄色葡萄球菌SCCmec分型及毒素基因的检测[J].中华检验医学杂志,2007,30(5):499-504.
[3]Duijkeren EV,Ikawaty R,Broekhuizen-Stins MJ,et al.Transmission of methicillin-resistantStaphylococcusaureusstrains between different kinds of pig farms[J].Vet Microbiol,2008,126(4):383-389.
[4]Khanna T,Friendship R,Dewery C,et al.Methicillin resistantStaphylococcusaureuscolonization in pigs and pig farmers[J].Vet Microbiol,2008,128:298-303.
[5]Smith TC,Male MJ,Harper AL,et al.Methicillin-resistantStaphylococcusaureus(MRSA)strain ST398is present in midwestern U.S.swine and swine workers[J].PLoS One,2008,4(1):e4258.DOI:10.1371/journal.pone.0004258
[6]Merlino J,Watson J,Rose B,et al.Detection and expression of methicillin/oxacillin resistance in multidrug-resistant and nonmultidrug-resistantStaphylococcusaureusin Central Sydney,Australia[J].J Antimicrob Chemother,2002,49(5):793-801.DOI:10.1093/jac/dkf021
[7]Zhang KY,Mcclure JA,Elsayed S,et al.Methicillin-resistantStaphylococcuschromosomemectypes I to V in subtyping of staphylococcal cassette characterization and concomitant novel multiplex PCR assay for aureus[J].J Clin Microbiol,2005,43(10):5026-5033.DOI:10.1128/JCM.43.10.5026-5033.2005
[8]Mcclure JA,Conly JM,Lau V,et al.Novel multiplex PCR assay for detection of the staphylococcal virulence marker panton-valentine leukocidin genes and simultaneous discrimination of methicillin-susceptible from-resistantStaphylococci[J].J Clin Microbiol,2006,44(3):1141-1144.DOI:10.1128/JCM.44.3.1141-1144.2006
[9]Cui SH,Li JY,Hu CQ,et al.Isolation and characterization of methicillin-resistantStaphylococcusaureusfrom swine and workers in China[J].J Antimicrob Chemother,2009,64:680-683.DOI:10.1093/jac/dkp275
[10]Gentry DR,Closkery LM,Gwynn MN,et al.Genetic characterization of Vga ABC proteins conferring reduced susceptibility to pleuromutilins inStaphylococcusaureus[J].Antimicrob A-gents Chemother,2008,52(12):4507-4509.DOI:10.1128/AAC.00915-08
[11]Schwendener S.New transposonTn6133in methicillin-resistantStaphylococcusaureusST398contains vga(E),a novel streptogramin A,pleuromutilin,and lincosamide resistance gene[J].Antimicrob Agents Chemother,2011,55(10):4900-4904.DOI:10.1128/AAC.00528-11
[12]Kadlec K,Pomba CF,Couto N,et al.Small plasmids carrying vga(A)or vga(C)genes mediate resistance to lincosamides,pleuromutilins and streptogramin A antibiotics in methicillin-resistantStaphylococcusaureusST398from swine[J].J Antimicrob Chemother,2011,28:1-2.DOI:10.1093/jac/dkq365
[13]Cui XG,Wei J,Jia W,et al.Detection of leukocidin gene in methicillin-resistantStaphylococcusaureusform burn department and molecular epidemiology of SCCmec[J].Chin J Nosocomio,2012,22(13):2721-2723.(in Chinese)崔学光,魏军,贾伟,等.烧伤科耐甲氧西林金黄色葡萄球菌杀白细胞素基因检测及SCCmec分子流行病学调查[J].中华医院感染性杂志,2012,22(13):2721-2723.
[14]Stefani S,Chung DR,Lindsay JA,et al.Meticillin-resistantStaphylococcusaureus(MRSA):global epidemiology and harmonisation of typing methods[J].Int J Antimicrob Agents,2012,39:273-282.DOI:10.1016/j.ijantimicag.2011.09.030

