东方次睾吸虫在鸡体内发育及其对宿主致病性研究
张智芳,程由注,江典伟,张春梁,林国华,方彦炎,李莉莎,陈宝建
东方次睾吸虫(Metorchis orientalis)曾一向被人们认为只是危害家鸭等鸟、禽类的寄生虫。林金祥、程由注首次报告狗、猫自然感染东方次睾吸虫[1],这是该虫感染哺乳类动物的新突破。1998年程由注等在广东省平远县开展棘隙吸虫调查研究时,发现当地的淡水鱼普遍感染东方次睾吸虫和华支睾吸虫,并以前者为优势种群[2]。由于该虫与华支睾吸虫的第一、二中间宿主,以及成虫寄生部位等生物学特征相同或相近,故考虑其对人体感染与致病的可能性,特分离该虫囊蚴分别做感染狗、猫、鸡、鸭以及人体实验,结果除进一步证实这些实验动物均能寄生外,并首次证实人体亦能良好感染。进而,调查当地人群和各类宿主。发现了东方次睾吸虫人体自然感染病例,并证实当地为东方次睾吸虫病自然疫源地,该虫同时存在于华支睾吸虫病流行区,往往与华支睾吸虫混合[3]。人体自然感染东方次睾吸虫并致病,为21世纪新发现的人体寄生虫病[4]。为了解东方次睾吸虫在终末宿主的动态发育过程及致病性过程,特从第二中间宿主麦穗鱼体内分离得到囊蚴,进行动物感染实验观察,结果报告如下。
1 材料与方法
1.1 材料
1.1.1 囊蚴 从福建省浦城县临江镇王村流行区鱼塘捕捞感染有东方次睾吸虫囊蚴的麦穗鱼,取鱼肌肉,用压片法于解剖镜下查找,鉴定囊蚴,然后分离囊蚴,并将其放在阿尔塞弗氏(Alsever’s)溶液中,暂存于6℃冰箱中备用。
1.1.2 实验动物 50日龄童鸡,感染组鸡平均体重394.8g,对照组鸡平均体重390.6g。由福州郊区家禽养殖场提供。实验前笼养在消毒环境中,并进行鸡瘟苗的免疫接种。
1.1.3 主要试剂及仪器 95%乙醇(分析纯)(上海成海化学工业有限公司),PL602-S型电子天平(上海精宏实验设备有限公司),HM340石蜡切片机(上海倍曼生物科技有限公司)、C-7070数码相机 (OLYMPUS)、显微镜(OLYMPUS)和解剖镜(MOTIC)。
1.2 方法
1.2.1 动物分组及处理 将45只健康童鸡,随机分为9组。设1~8为感染组,以感染后2h、4h、8 h、48h、1周、2周、4周、6周时间分别解剖观察;第9组为对照组。每组各5只鸡,对实验中途自然死亡者,再作补充感染。将囊蚴置于医用胶囊内,感染组鸡经口服吞食感染,2h、4h、8h、48h组每只鸡各感染囊蚴100个,1周、2周、4周、6周组每只鸡各感染囊蚴200个。各组的饲养条件相同。解剖鸡分期处死,取出小肠和肝脏置于生理盐水中 ,解剖小肠、肝胆管和胆囊,以吸管吸取逸出的东方次睾吸虫,显微镜下查找虫体,并计数回收率;在运动减弱或接近死亡时观察虫体发育情况,同时进行测量与拍照。
1.2.2 临床症状与病理变化观察 感染后每日进行临床观察,每隔一周称体重。定期解剖取虫,观察脏器变化。取出的肝脏及胆囊组织用4℃生理盐水冲洗干净,在肝脏最大叶距边缘5mm处取小块肝组织用4%甲醛固定后,进行常规石蜡切片、H-E染色,切片观察病理变化。胆囊组织用4℃生理盐水冲洗干净,固定后切片观察。
1.2.3 数据处理 结果用SPSS17.0进行统计学处理,计算平均数与标准差,用x±s表示,两组之间率及构成比的比较采用卡方检验,均值的比较采用方差分析。
2 结 果
2.1 不同时间实验感染鸡获虫情况 所有试验鸡扑杀均查获虫体。其中2h、4h、8h、48h的各组虫回收率较为接近(79.8%~86.2%),经统计学处理,组间比较差异无统计学意义(P均﹥0.05)。2h组共检获399条虫中,分别为小肠114条(28.6%)、肝胆管183条(45.8%)、胆囊102条(25.6%);4h组共检获405条虫,分别为小肠83(20.5%)、肝胆管132(32.6%)、胆囊190(46.9%);8h组共检获418条虫,分别为肝胆管185(44.2%)和胆囊233(55.8%);48h组共检获431条虫,分别为肝胆管112(26.2%)和胆囊319(73.8%);1周组共检获637条虫,分别为肝胆管193(30.3%)和胆囊444(69.7%)。2周组共检获394条虫,分别为肝胆管93(23.6%)%和胆囊301(76.4%)。4周组共检获175条虫,分别为肝胆管23(13.1%)%和胆囊152(86.9%),6周仅于胆囊内检获虫。以1周组虫回收率71.7%最高,随后回收率呈下降,6周组回收率仅7.6%。不同时间实验感染鸡获虫情况见表1。
2.2 各阶段虫体发育观察 东方次睾吸虫后尾蚴在鸡体内发育迅速。感染2h时排泄囊内浅棕色颗粒消失(图1),感染4h时排泄囊已与后尾蚴完全不同(图2)。感染48h时就已出现睾丸等生殖器官雏形(图3),至感染2周时,只有部分虫发育成熟(图4),但个体发育不同步,随后虫体及口、腹吸盘继续发育增长,至6周时全部虫发育才成熟(图5)。各阶段虫体发育情况见表1、2。
2.3 感染鸡发病情况
2.3.1 一般情况 部分鸡感染第3d开始发病,第5d普遍发病并出现死亡。发病主要特征为不同程度的精神萎靡、食欲减退、活动减弱、常闭目嗜睡和羽毛失去光泽等,随后症状明显加重。40只感染鸡至第6周时先后死亡9只,死亡率达22.5%(均为接种囊蚴200/只);其中第5d死亡1只,第6d死亡1只,第9d死亡1只,第14d死亡1只,第21d死亡1只,第24d死亡1只,第31d死亡1只,第35d死亡1只,第37d死亡1只;第5~9d鸡死亡之前未见明显征兆,突然倒地,全身抽搐而死;14d以后死亡鸡之前2、3d均出现绝食、拉稀便等症状,以致衰竭致死。
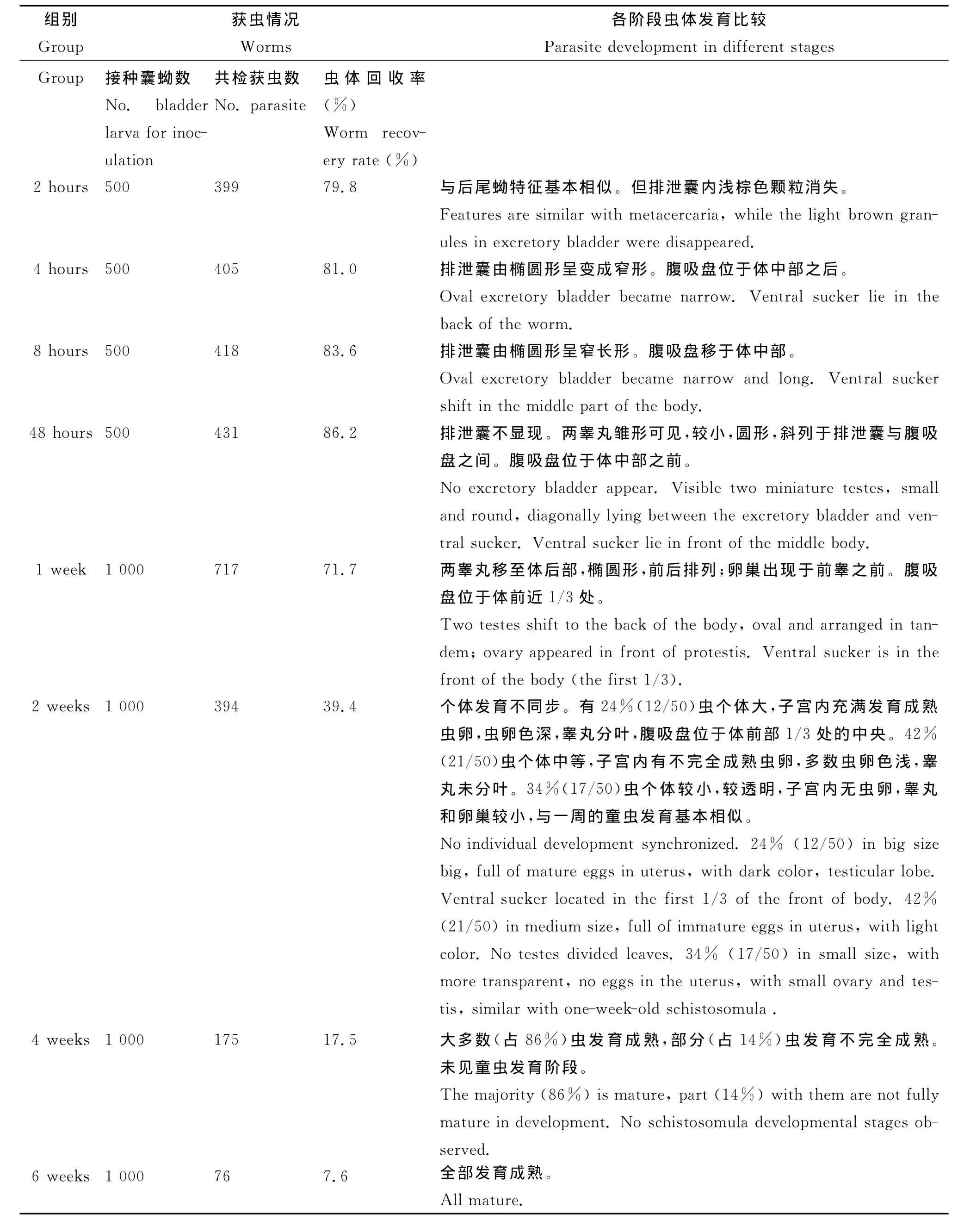
表1 不同时间实验感染鸡获虫与发育观察Tab.1 Metorchis orientalis and development observation in experimentally infected chickens at different time
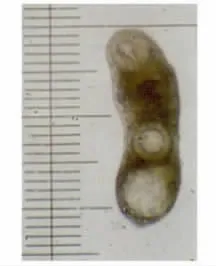
图1 2h东方次睾吸虫幼虫Fig.1 Metorchis orientalis larvae at 2hours p.i.
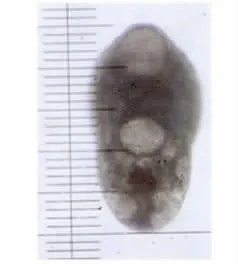
图2 4h东方次睾吸虫幼虫Fig.2 Metorchis orientalis larvae at 4hours p.i.
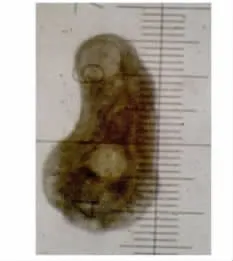
图3 48h东方次睾吸虫幼虫Fig.3 Metorchis orientalis larvae at 48hours p.i.
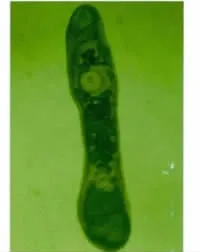
图4 2周时东方次睾吸虫虫发育接近成熟Fig.4 Metorchis orientalis development approaching maturity at 2weeks
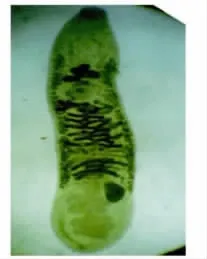
图5 6周时东方次睾吸虫成虫Fig.5 Metorchis orientalis adults at 6weeks

图6 感染东方次睾吸虫6周后肝脏与胆囊病变Fig.6 Pathological changes in liver and gallbladder infected with Metorchis orientalis at 6weeks p.i.

表2 实验鸡体内不同时间东方次睾吸虫虫体和口、腹吸盘大小检测(单位:μm)Tab.2 Detection on worm body,oral sucker and ventral sucker in experimental chickens in different time for Metorchis orientalis infection
2.3.2 与对照组鸡的体重比较 对照组在饲养期间无死亡和未见任何异常表现,从感染前平均体重390.6g,至第6周时上升至844.9g,肝脏呈红褐色,质地柔软,胆囊椭圆形,大小适中,胆汁呈草绿色或深绿色,肝脏,胆囊寄生虫检查全为阴性。感染组鸡生长迟缓,增重明显减慢,平均体重从感染前394.8g至第6周时为523.5g,两组鸡体重差异有统计学意义(t=2.31>2.262,P<0.05)。
2.4 不同时间感染鸡肝脏变化
2.4.1 肉眼肝脏变化感染 1周组感染鸡有2只轻度肿大。2周后感染鸡肝脏普遍有轻度肿大,感染4~6周,肝脏不同程度肿大,为对照组的2~5倍,局部充血红肿,表面有散在的白色小坏死灶(图6)。肝脏被膜增厚,肝边缘囊状扩张的胆管更加明显。肝脏质地逐渐变硬。切面可见胆管密度增加,管壁增厚变硬,有增生样白色花纹,个别的胆管呈囊状扩张,稍加挤压,胆管内虫体和白色或黄绿色栓塞物溢出切口。
2.4.2 石蜡切片显微观察 正常对照组鸡肝脏切片显示肝小叶结构完整,肝细胞排列紧密,大小均匀一致,肝核呈圆形,形态规则,肝索排列规则,无炎症细胞。见图7.A。2h和4h病理变化差别不大,肝小叶结构尚完整,实质细胞结构基本正常,病变程度较低,在汇管区可见到淋巴滤泡样结构,有少量炎症细胞,中央静脉周围有炎性细胞,肝窦和肝细胞之间亦有炎性细胞散在分布,炎性细胞以淋巴细胞为主,见图7.B。8h肝小叶结构尚完整,肝实质细胞病变程度较低,肝内血窦及汇管区静脉扩张充血,见图7.C。48h肝小叶结构轻度不完整,肝细胞有水肿,汇管区大量炎症细胞浸润,肝血窦充血明显 ,见图7.D。1周组肝小叶周边细胞排列紊乱,可见肝细胞脂肪变性,胞浆内见脂肪空泡,脂肪变的细胞相互连成片状网眼结构,间质小胆管广泛增生,门管区尤为明显,见图7.E。2周组肝间质结缔组织明显增生,肝小叶周围的肝细胞萎缩,浸润的炎性细胞以淋巴细胞和嗜酸性粒细胞为主,充满中央静脉和弥漫分布在肝窦、肝细胞之间及增生的小胆管周围、结缔组织之间,肝细胞索状结构消失且排列杂乱,肝血窦缩小,多灶性肝细胞肿胀,呈水样变性或脂肪变,细胞膜边界不清,有胞膜溶解现象,部分细胞核固缩、碎裂消失,见图7.F。4周组病鸡肝脏胆小管增生;汇管区周围成纤维细胞、结缔组织和假胆管增生明显,并向小叶内伸展。中央静脉淤血,周围出现胆管上皮样细胞形成的管套,见图7.G。6周组肝索排列混乱、胆汁淤积,汇管区淋巴滤泡增生,肝细胞水肿很严重,小胆管增生,大量炎症细胞(嗜酸性粒细胞,淋巴细胞)浸润,组织纤维化较严重,见图7.H。
2.5 不同时间感染鸡胆囊病理变化
2.5.1 肉眼胆囊变化观察 感染后1周有3只鸡的胆囊肿大,胆囊壁增厚,有出血现象,囊内胆汁变少,淡绿色。感染后2周的感染鸡胆囊全部肿大(图8),呈蓝灰色或淡绿色,为对照组的2~10倍,胆囊壁增厚明显,囊内容物浓稠状(图9)。感染后4~6周,胆囊与感染后2周的肿胀大小相近(图10),但囊内胆汁更为浓稠,或固化为结石状(图11)。
2.5.2 石蜡切片显微观察 正常对照组,胆囊粘膜排列规则,结构完整,见图12.A。2h与4h组差别不大,胆囊粘膜部分上皮细胞脱落,部分区域出现炎症反应,见少量炎症细胞浸润,病变较轻,见图12.B。8h胆囊粘膜脱落,炎症细胞增多,肌层结构完整,见图12.C。48h粘膜结构不完整,上皮细胞脱落严重,粘膜下血管扩张充血、出血明显,粘膜间质水肿,炎症细胞浸润,胆囊与周围组织并无粘连,见图12.D。1周组胆囊粘膜上皮细胞严重脱落,黏膜面变得较为平坦,肌层纤维组织大量增生,见图12.E。2周组,坏死灶内胆管上皮细胞大量增生,呈腺管状或索状;扩张胆管内可见东方次睾吸虫,见图12.F。4周组,胆囊黏膜上皮呈乳头状增生,固有膜和黏膜下层大量淋巴细胞浸润,并有淋巴滤泡形成,见图12.G。6周组胆囊黏膜下层结缔组织增生,并有淋巴细胞、嗜酸性粒细胞和中性粒细胞浸润,局灶出血,在胆囊与肝脏邻近处的粘膜下小胆管增生,周围有淋巴细胞和少量嗜酸性粒细胞浸润。肌层血管充血、出血,有淋巴细胞和嗜酸性粒细胞浸润,胆囊壁有散在出血、灶性坏死,小脓肿形成,或全层坏死和坏疽改变见图12.H。
3 讨 论
东方次睾吸虫在我国分布比较广泛,在广东,吉林,福建,四川,江苏,北京,上海,天津,台湾等省(市)均发现本虫感染的宿主。东方次睾吸虫病不仅给养殖业造成损失[5-7],而且也可感染人体,对人类健康造成影响。东方次睾吸虫对禽类宿主动物的感染致病早有报道[8-11],本文通过感染实验动物鸡观察其动态发育以及对宿主致病的过程。显示感染鸡生长缓慢,发育受阻,死亡率高;感染时间越久,虫的回收率越低,且胆囊病变越严重。当虫体进入胆管时,成虫的机械运动可造成胆管上皮机械损伤,感染较重者,大量成虫可造成胆管的机械性梗阻。另外,活虫代谢产物、死虫崩解产物、虫卵的分泌物均可造成化学性损伤或引起宿主过敏,造成局部的炎症反应,胆汁淤积,汇管区淋巴滤泡增生水肿很严重,胆管增生,大量炎症细胞浸润,嗜酸性粒细胞,淋巴细胞大量增多,组织纤维化较严重。当胆囊内容物的出路被阻塞时,由于胆囊粘膜仍继续分泌粘液,造成胆囊内压力不断增高使胆囊不断膨胀、积水,胆囊壁的血管因此受压而缺血、坏死。当胆囊缺血时,胆囊抵抗力下降,细菌就容易生长繁殖,经慢性炎症,粘膜遭到破坏,呈息肉样改变,胆囊壁增厚,纤维化、慢性炎细胞浸润,胆汁持久潴留,胆汁原有的胆色素被吸收,代之以胆囊所分泌的粘液,故引起胆汁颜色、性状和成份的变化,由于病变时间延长加上炎症反应,肝脏胆小管扩张严重,胆管周围嗜酸性粒细胞浸润,纤维组织增生,胆汁在肝脏淤积,引起肝脏损伤,肝脏的炎症反应越来越严重,致使胆囊收缩强烈,又引起胆管内炎性感染,胆囊出现严重病变,导致绝食、拉稀便等症状,以至功能丧失,衰竭死亡。综上所述,感染鸡是由肝胆管阻塞引起的一系列急慢性病变所致,而早期出现的感染鸡突发性死亡,其原因有待进一步研究。
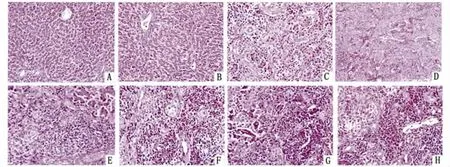
图7 鸡感染东方次睾吸虫囊蚴后肝脏病理组织学观察结果Fig.7 Histopathological change in the liver of chicken infected with Metorchis orientalis larvae图7.A正常鸡肝脏Fig.7-A Liver of chicken in normal control group图7.B感染后2~4h肝细胞结构完整,汇管区有少量炎症细胞Fig.7-B Structural integrity in liver cell,and a few inflammatory cells in the portal area at 2-4hours post-infection图7.C感染后8h肝细胞结构完整,汇管区炎症细胞增多,血窦扩张充血Fig.7-C Structural integrity in liver cell,increased inflammatory cell area in the portal area,dilatation and congestion in sinusoids at 8hours p.i.图7.D感染后48h肝细胞水肿明显,汇管区有大量炎症细胞浸润,肝内血窦及汇管区静脉扩张充血Fig.7-D Significant edema in liver cells at 48hours p.i.,consideriable inflammatory cell infiltration in portal area,dilatation and congestion in sinusoids and periportal vein in the liver图7.E感染后1周肝细胞水肿变性,部分肝实质细胞脂肪变性,胆小管广泛增生,嗜酸性粒细胞浸润Fig.7-E Hydropic degeneration in liver cell at 1weeks p.i.,fatty degeneration in part of the liver parenchymal cells,extensive hyperplasia in bile canalicular,infiltration of eosinophilia图7.F感染后2周肝细胞水肿变性,小叶间界限欠清楚,细胞索排列紊乱,胆小管广泛增生,嗜酸性粒细胞浸润Fig.7-F Hydropic degeneration in liver cell at 2weeks p.i.,interlobular boundary are unclear,derangement in cell cords,extensive hyperplasia in bile canalicular,infiltration of eosinophilia图7.G感染后4周肝细胞多灶性坏死,大量炎症细胞浸润,肝纤维结缔组织明显增生Fig.7-G Many focal necrosis in liver cells at 4weeks p.i.,considerable inflammatory cell infiltration,obvious proliferation in fibrous connective tissue in liver图7.H感染后6周肝细胞水肿严重,胆管增生,大量炎症细胞浸润,嗜酸性粒细胞,淋巴细胞大量增多,组织纤维化Fig.7-H Serious edema in liver cell at 6weeks p.i.,bile duct proliferation,considerable infiltration of inflammatory cells,eosinophilia and lymphocytes increase,tissue fibrosis
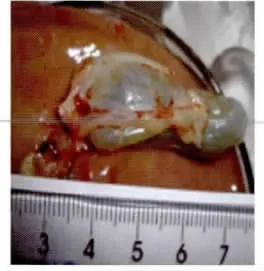
图8 感染2周后肝脏与胆囊Fig.8 Liver and gallbladder at 2weeks post-infection

图9 感染2周后胆囊内容物Fig.9 Gallbladder contents at 2weeks post-infection
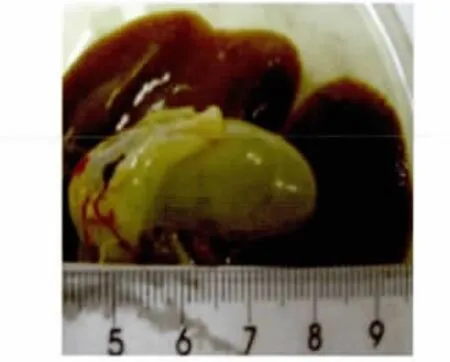
图10 感染4周后肝脏与胆囊Fig.10 Liver and gallbladder at 4weeks post-infection
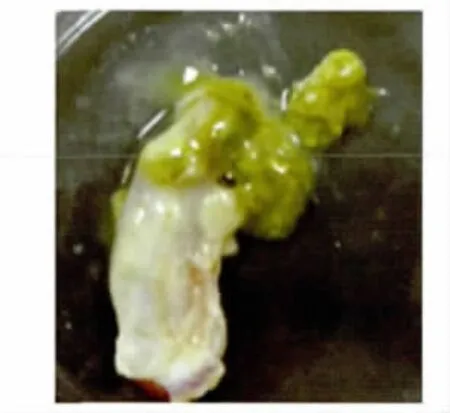
图11 感染4周后胆囊内容物Fig.11 Gallbladder contents at 4weeks post-infection
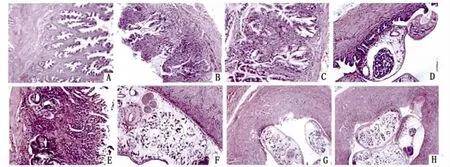
图12 .A正常胆囊,粘膜规则Fig.12-A Normal gallbladder and mucosae图12.B胆囊粘膜部分脱落,可见散在炎症细胞Fig.12-B Gallbladder mucosa shedding partially and scattered inflammatory cells图12.C胆囊粘膜脱落,可见炎症细胞浸润Fig.12-C Gallbladder mucosa shedding and inflammatory cell infiltration图12.D胆囊粘膜脱落较严重,粘膜结构不完整,大量炎症细胞浸润Fig.12-D Gallbladder mucosa shedding seriously,incomplete mucosa structure,and considerable inflammatory cell infiltration图12.E胆囊粘膜严重脱落,但尚有少量残存,肌层结构尚完整Fig.12-E Gallbladder mucosa shedding seriously with a small amount of remnants,while the muscular structure is intact图12.F胆囊粘膜完全脱落,结构遭到破坏,肌层有少量炎症细胞Fig.12-F Gallbladder mucosa shedding completely,the structure is destroyed,and there are a few of inflammatory cell in muscularis图12.G胆囊粘膜坏死脱落,肌层中等到大量炎症细胞浸润Fig.12-G Necrosis and exfoliation in gallbladder mucosa,and the inflammatory cell infiltration in muscularis图12.H胆囊粘膜坏死脱落,粘膜下血管充血明显,肌层大量炎症细胞浸润Fig.12-H Necrosis and exfoliation in gallbladder mucosa,significant congestion in submucosal vessels,and the muscular layer infiltration is with numerous inflammatory cells
随着感染时间的延长病变加重,从而使寄生环境越来越不适应于虫的生存,致虫死亡率逐步增多。因此不同阶段解剖取虫,显示随着感染时间的延长而虫的回收率呈下降趋势。陈诚等对东方次睾吸虫的囊蚴感染家禽15d左右查及虫卵[12]。本次研究显示该虫后尾蚴侵染宿主后发育迅速,感染2周后见虫个体发育明显不同步,大多数尚在继续发育,印证了15d左右检获虫卵只是少部分的虫发育成熟虫体所产的卵。在不同阶段观察虫体发育,发现发育过程腹吸盘由体中后部逐步移向体前方。早期童虫呈长椭圆形逐步发育形成长条形成虫,虫体前部结构简单,而体中后部子宫和体后部的睾丸均发达,这可能是子宫和睾丸发育过程向体部扩张,故造成腹吸盘由体中后部逐步向体前方移动的假象。
东方次睾吸虫的第二中间宿主主要为麦穗鱼等多种小型淡水鱼类,流行区常见当地居民捕捞小杂鱼喂鸡喂鸭,而不明原因的家养鸡鸭死亡,可能是食入含有东方次睾吸虫囊蚴的小杂鱼所致。由于东方次睾吸虫是鱼源性寄生虫,自然与生态环境对本虫的流行影响极大,切断了东方次睾吸虫自然疫源地形成的环节,也阻断了本病的流行与传播。因此对于东方次睾吸虫的各个流行环节,采取综合的防治措施。做好健康教育的宣传工作,不吃未煮熟的池塘鱼,对鸡,鸭,野鸡等粪便进行无害化处理,减少其流入水中,禁止用生鱼喂养家禽等,以防制该类寄生虫病的流行。
[1]Lin JX,Cheng YZ.Investigation on species of parasites in dog and cat in Fujian Province[J].Chin J Zoonoses,1986,2(1):28-29.(in Chinese)林金祥,程由注.福建省狗猫寄生蠕虫种类的调查[J].中国人兽共患病学报 (原中国人兽共患病杂志),1986,2(1):28-29.
[2]Cheng YZ,Li YS,Lin JX,etal.Survey of mixed infections of fish-borne trematodes in Pinyuan County and DNA (RAPD)analysis[J].Chin J Zoonoses,2000,16(3):52-55.(in Chinese)程由注,李友松,林金祥,等.广东省平远县鱼源性吸虫混合感染调查及DNA(RAPD)分析[J].中国人兽共患病学报(原中国人兽共患病杂志),2000,16(3):52-55.
[3]Lin JX,Cheng YZ,Li YS,etal.The discovery of natural infec-tion of human with Metorchis orientalis and the investigation of its focus[J].Chin J Zoonoses,2001,17(4):19-21.(in Chinese)林金祥,程由注,李友松,等.人体自然感染东方次睾吸虫的发现及其疫源地的调查研究[J].中国人兽共患病学报(原中国人兽共患病杂志),2001,17(4):19-21.
[4]Lin JX.Metorchis orientalis[M].In:Wen XT,Yu ES,Xu JG,ed.Contemporary zoonosis of word.Chengdu:Sichuan Science and Technology Press,2011:1192-1196.(in Chinese)林金祥.东方次睾吸虫病[M]//文心田,于恩庶,徐建国,等.当代世界人兽共患病学.成都:四川出版集团.四川科学技术出版社,2011:1192-1196.
[5]Xu YC.Case report of opisthorchiasis outbreak in ducks flock[J].Poultry,1982,16(1):30-31.(in Chinese)许耀成.鸭群暴发后睾吸虫病一例[J].家禽,1982,16(1):30-31.
[6]Ben QY,Hang QH.Metorchis orientalis outbreak in chick flock[J].Shanghai J Anim Husbandry Vet Med,1991,(2):43.(in Chinese)贲巧云,杭庆华.群鸡暴发东方次睾吸虫病[J].上海畜牧兽医通讯,1991,(2):43.
[7]Shen JF.Diagnosis and treatment of metorchisorientalis in duck[J].Chin J Vet Parasitol,1988,6(1):42.(in Chinese)申济丰.鸭东方次睾吸虫病的诊治[J].中国兽医寄生虫病,1988,6(1):42.
[8]Zhang ZR.Metorchis orientalis in ducklings[J].Mod J Anim Husbandry Vet Med,1985,6:25.(in Chinese)张正仁.雏鸭发生东方次睾吸虫病[J].现代畜牧兽医,1985,(6):25.
[9]Ren N.Chicken Metorchis orientalis case report[J].Chin J Zoonoses,1986,2(4):59.(in Chinese)任农.鸡东方次睾吸虫病例报告[J].中国人兽共患病学报(原中国人兽共患病杂志),1986,2(4):59.
[10]Chen KQ,Tang WF,Yao HJ.Pathological observation of Metorchi orientalis in duck[J].Shanghai J Anim Husbandry Vet Med,1989,6:16-17.(in Chinese)陈克强,唐文福,姚惠娟.鸭东方次睾吸虫病的病理学观察[J].上海畜牧兽医通讯,1989,(6):16-17.
[11]Zhao QH,Chen KQ,Mao QR.Pathohistological study on opisthorchiasis of ducks infected with Metorchis orientalis artificially[J].J Shanghai Agr Coll,1997,15(2):114-119.(in Chinese)赵秋华,陈克强,毛其仁.人工感染鸭东方次睾吸虫病的病理组织学研究[J].上海农学院学报,1997,15(2):114-119.
[12]Chen C,Zhang HM,Jiang H,etal.Susceptibility study of experimental animals to infection with Metorchi orientalis[J].Appl Prev Med,2008,14(2):80-83.(in Chinese)陈诚,张鸿满,江河,等.东方次睾吸虫的实验动物易感性研究[J].应用预防医学,2008,14(2):80-83.

