重组pET30a-EgM9蛋白高免兔血清对体外培养细粒棘球绦虫发育的影响
余婉蓉,班万里,王冰洁,潘星羽,幕永辉,刘 帅,吾力江·卡马力,徐 晶,喻昌盛,赵 莉*,张壮志*
(1.新疆农业大学动物医学学院,新疆乌鲁木齐 830052;2.新疆畜牧科学院兽医研究所 新疆畜牧科学院动物临床医学研究中心,新疆乌鲁木齐 830013;3.昌吉市动物疾病预防控制中心,新疆昌吉 831100)
棘球蚴病是由棘球绦虫的中绦期幼虫引起的一种人兽共患病,在我国以细粒棘球绦虫(Echinococcusgranulosus,Eg)和多房棘球绦虫(Echinococcusmultilocularis,Em)为主要病原[1,2]。犬既是细粒棘球绦虫传播的终末宿主,也是细粒棘球蚴病(包虫病)的主要传染源。我国是棘球蚴病的高发国家,其中以新疆、青海、西藏、四川等牧区发病率较高[3]。Zhang W等利用差异显著PCR筛选出3个成熟虫体与非成熟虫体差异表达的基因,即EgM家族基因(EgM4、EgM9、EgM123)[4],构建EgM4、EgM9、EgM123基因的原核表达载体,表达纯化蛋白,进行免疫试验,然后开展人工感染试验,结果显示EgM9最为显著,保护率达到97%~100%[5-9],效果最明显,说明EgM家族基因对细粒棘球绦虫终末宿主具有较好的免疫原性[10-11]。原核表达EgM9蛋白接种犬能明显减少犬体内细粒棘球绦虫成虫的数量和抑制虫体发育,说明EgM9基因可能与细粒棘球绦虫的成熟和卵的发育有关,但其具体作用机制尚不清楚[12]。论文通过表达纯化EgM9重组蛋白,免疫新西兰大白兔获得高免血清,在体外培养模型上,将高免血清作用于体外培养虫体,观察体外培养虫体的发育状况,通过Western blot检测虫体蛋白的免疫反应,通过RT-qPCR分析共培养虫体EgM9基因的表达情况,探索EgM9在虫体发育中的功能。
1 材料与方法
1.1 材料
1.1.1 蛋白、血清及虫体 pET30a-EgM9重组蛋白、EgM9高免鼠血清由国家动物包虫病参考实验室(新疆畜牧科学兽医研究所)提供;细粒棘球绦虫原头蚴采集于乌鲁木齐市华凌屠宰场。
1.1.2 实验动物 新西兰大白兔2只,雌性,2 kg,购自新疆医科大学实验动物中心。
1.1.3 主要试剂 RPMI1640培养液,青霉素-链霉素混合液,美国Hyclone公司产品;胎牛血清,美国BI公司产品;羊抗鼠IgG-RP,驴抗兔IgG-HRP,美国Thermo公司产品;脱脂奶粉,美国BD公司产品;弗氏完全佐剂,不完全佐剂,亚甲蓝、胃蛋白酶,牛磺胆酸盐T4009,美国Sigma公司产品;RNA提取试剂盒,天根生化科技(北京)有限公司产品;第一链cDNA合成Master Mix(去基因组DNA)反转录试剂盒,江苏康为试剂生物科技股份有限公司产品。
1.1.4 主要仪器 生物安全柜(SW-CJ-SFD),上海博训实业有限公司产品;37℃ CO2培养箱(HF212),上海力申科学仪器有限公司产品;恒温水浴锅(F12),德国Julabo公司产品;倒置显微镜(XDS-2000C),上海蔡康光学仪器有限公司产品;全波长酶标仪(Infinite F50),瑞士TECAN帝肯公司产品;蛋白电泳仪(PAC3000),美国Bio-Rad公司产品;半干转印仪(221BR 47894),美国Bio-Rad公司产品。
1.2 方法
1.2.1 高免兔血清的制备 将纯化过的重组蛋白pET-30a-EgM9与弗氏完全佐剂(首免)或弗氏不完全佐剂(二免、三免)等体积混合乳化,免疫新西兰大白兔。每次免疫间隔2周,首次免疫剂量为100 μg/只,之后免疫剂量为50 μg/只,每次免疫前进行耳缘静脉采血,收集血清备用。
1.2.2 ELISA检测血清效价 将纯化过的pET-30a-EgM9重组蛋白稀释成终浓度为3 μg/mL进行包被,以1.2.1制备的兔血清作为一抗,以驴抗兔IgG-HRP(1∶8 000)为二抗,采用间接ELISA法测定免疫后的血清效价;期间定期检测血清效价,血清效价下降则继续进行加免,收集1∶80 000以上的血清备用。
1.2.3 原头蚴的采集及体外培养 将采集回的患病羊肝脏用蒸馏水将表面清洗干净,用75%乙醇对表面进行消毒,吸出囊液,滤液置于50 mL离心管中自然沉淀。将沉淀物置于平皿中,用含双抗的生理盐水反复清洗其中的原头蚴,至液体澄清无杂质。将清洗好的原头蚴按照1∶10加入1%胃蛋白酶溶液,37℃水浴锅中消化30 min,待原头蚴自然沉淀,用含有双抗的生理盐水清洗3~4遍,洗去活力弱的原头蚴和未消化完全的组织碎片,吸取2 μL的原头蚴用0.1%亚甲基蓝测其活力,活力>99%可用于培养。将4 000~5 000枚原头蚴加入到细胞培养瓶中,加入含20%胎牛血清的RPMI-1640培养液中,放入37℃、5% CO2恒温培养箱中培养,观察有无污染,后每隔2 d换一次液,换液前后观察原头蚴的状态,待用。
1.2.4 高免兔血清作用于体外培养30 d虫体 将免疫前血清与高免血清经0.22 μm滤膜过滤,分装备用。将体外培养30 d的虫体按每孔150~200条培养于24孔培养板中,试验分3组,Ⅰ组为空白对照组,Ⅱ组为添加20%免疫前血清作用于体外培养虫体,Ⅲ组为添加20%高免血清作用于体外培养虫体。每日观察,在第6天拍照观察记录免疫前血清和高免血清对体外培养30 d虫体发育情况的影响,0.1%亚甲基蓝染色着色为死蚴,不着色为活蚴。计算每孔原头蚴死亡率(%),死亡率(%)=(死亡数/原头蚴总数)×100%。
1.2.5 SDS-PAGE、Western blot鉴定虫体蛋白的免疫反应性 试验分5组,前3组同上,Ⅳ组为自然感染原头蚴(PSC);Ⅴ组为自然感染细粒棘球绦虫成虫虫体,经超声破碎提取虫体蛋白。
1.2.5.1 直接ELISA法 用BCA试剂盒测定上述5组虫体蛋白浓度,经12% SDS-PAGE分离虫体蛋白,7 V、 2 h转硝酸纤维素膜(NC膜),5%脱脂奶粉4℃封闭过夜,加入驴抗兔二抗IgG-HRP室温孵育1 h,用4-氯-1-萘酚进行显色成像仪进行拍照分析。
1.2.5.2 间接ELISA法 Ⅰ组、Ⅱ组、Ⅲ组、Ⅳ组、Ⅴ组虫体蛋白和纯化的EgM9蛋白,转NC膜后,5%脱脂奶粉4℃封闭过夜,加入EgM9高免鼠血清室温孵育1 h,加入羊抗鼠IgG-RP室温孵育1 h,用4-氯-1-萘酚进行显色成像仪进行拍照分析。
1.2.6 RT-qPCR鉴定体外培养虫体EgM9基因表达状况 根据陈云英[13]细粒棘球绦虫体外不同发育时期EgM9基因差异表达研究中设计的引物,根据RNA提取试剂盒提取Ⅰ组、Ⅱ组、Ⅲ组、Ⅳ组虫体的RNA,根据第一链cDNA合成Master Mix(去基因组DNA)反转录试剂盒反转录合成cDNA,测定cDNA浓度后进行荧光定量PCR扩增。荧光定量PCR反应体系为20 μL,其中Mix 10 μL、上游引物0.8 μL、下游引物0.8 μL、模板1 μL、RNA free dd H2O 7.4 μL;PCR反应程序:95℃预变性3 min;95℃变性3 s,65℃退火30 s,共40个循环,每个样本重复3次,得出熔解曲线。
1.2.7 统计学分析 荧光定量PCR结果根据2-△△CT计算目的基因相对表达水平,根据SPSS软件进行多因素方差分析,以P<0.05为差异显著,P<0.01为差异极显著。
2 结果
2.1 重组蛋白纯化
SDS-PAGE结果表明pET-30a-EgM9重组蛋白大小为19.8 ku,与预期目的条带一致(图1)。Western blot试验结果表明,pET-30a-EgM9重组蛋白能被高免兔血清识别,且条带单一,有很好的免疫原性(图2)。
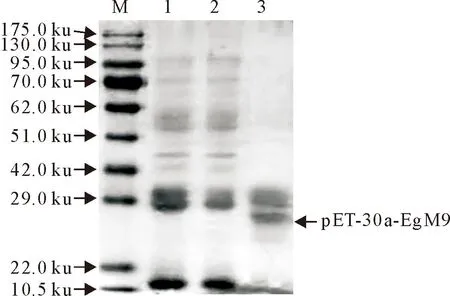
M.蛋白分子质量标准;1,2.未纯化前重组蛋白pET-30a-EgM9;3.纯化后重组蛋白pET-30a-EgM9

M.蛋白分子质量标准;1.重组蛋白pET-30a-EgM9
2.2 pET-30a-EgM9重组蛋白免疫兔后血清抗体效价检测
通过间接ELISA法检测兔血清中的抗体水平,结果显示,首免后EgM9重组蛋白诱导兔产生的IgG抗体水平变化小,但在第2次免疫后水平急剧升高,第3次免疫后又稍有上升,后抗体水平在加强免疫下,抗体水平持续维持在OD450≥2.30左右。
2.3 高免血清对体外培养30 d虫体发育的影响
高免兔血清作用于体外培养Eg30 d的虫体开展体外干预试验,第6天时,经0.1%亚甲基蓝染色,观察到的虫体死亡情况如下,Ⅰ组虫体死亡率为9.0%±1.769%,Ⅱ组虫体的死亡率为12.9%±1.718%,Ⅲ组虫体的死亡率为14.28%±2.96%。通过SPSS软件对3组虫体的死亡率进行方差分析结果得出P>0.05,表明3个组之间体外培养虫体的死亡率没有差异,但是Ⅲ组虫体虫体体节缩短,往成囊方向发展,虫体培养液中有许多脱落的头节小钩碎片。
2.4 SDS-PAGE、Western blot鉴定免疫反应性
2.4.1 SDS-PAGE、Western blot直接法鉴定免疫反应性 Ⅰ组、Ⅱ组、Ⅲ组、Ⅳ组、Ⅴ组虫体蛋白经过SDS-PAGE分离见图3A,从图中可以看出各组虫体蛋白带型基本相似,经过Western blot分析(图3B),Ⅰ组、Ⅳ组、Ⅴ组虫体蛋白未见条带Ⅱ组Ⅲ组虫体蛋白在51 ku~62 ku处有明显条带见,且Ⅲ组虫体蛋白的条带最明显,颜色更深特异性更强。

M.蛋白分子质量标准;1.Ⅳ组虫体蛋白;2.Ⅴ组虫体蛋白;3.Ⅰ组虫体蛋白;4.Ⅲ组虫体蛋白;5.Ⅱ组虫体蛋白M.Protein molecular weight Marker; 1-5.The proteins of Ⅳ,Ⅴ,Ⅰ,Ⅲ,Ⅱ groups
2.4.2 SDS-PAGE、Western blot间接法鉴定免疫反应性 Ⅰ组、Ⅱ组、Ⅲ组、Ⅳ组、Ⅴ组虫体蛋白与EgM9蛋白经SDS-PAGE分离见图4A,经Western blot分析Ⅰ组,Ⅱ组、Ⅴ组虫体蛋白及EgM9蛋白在22 ku~29 ku处有明显条带(图4B),且EgM9蛋白的条带颜色更深,而Ⅲ组和Ⅳ组虫体蛋白未出现条带。

M.蛋白分子质量标准;1.Ⅰ组虫体蛋白;2.Ⅱ组虫体蛋白;3.Ⅴ组虫体蛋白;4.Ⅳ组虫体蛋白;5.Ⅲ组虫体蛋白;6.EgM9重组蛋白M.Protein molecular weight Marker; 1-5.The proteins ofⅠ,Ⅱ,Ⅴ,Ⅳ,Ⅲ groups; 6.EgM9 protein
2.5 统计学分析RT-qPCR结果
荧光定量PCR结果经2-△△CT计算EgM9基因的表达差异,根据SPSS软件进行方差分析Ⅳ组虫体与Ⅰ组、Ⅱ组、Ⅲ组虫体的EgM9基因表达量差异极显著(P<0.01),且Ⅲ组虫体的EgM9基因表达量最高,与Ⅰ组、Ⅱ组虫体的EgM9基因表达量差异极显著(P<0.01)。

表1 qPCR经2-△△CT计算EgM9基因的表达结果
3 讨论
1994年Heath D D就利用六钩蚴作为抗原免疫羊,获得的抗血清通过亲和纯化分出5个蛋白区域的抗体,分别在体外与六钩蚴培养,发现小于20 ku和23 ku~25 ku蛋白质制备的抗体均能杀死六钩蚴[14-15]。David 发现Eg95的抗血清对六钩蚴的杀死率达到 99.8%[16]。本研究通过pET-30a-EgM9重组蛋白免疫新西兰大白兔,获得高免血清,细粒棘球绦虫原头蚴经体外培养30 d后加入免疫前兔血清(Ⅱ组)和抗pET30a-EgM9重组蛋白高免兔血清(Ⅲ组)作用于体外培养细粒棘球绦虫虫体。结果发现,试验组Ⅱ组、Ⅲ组体外培养虫体的死亡率与Ⅰ组(空白对照组)虫体死亡率无显著性差异,与赵莉[17]等EgM123重组蛋白抗血清对多房棘球绦虫杀伤结果不同,造成其原因可能应为所选取的体外培养虫体的天数不同,本次选取的是体外培养30 d的虫体,随着体外培养时间的延长,可能虫体发育系统更为成熟,抵御外界环境的刺激能力更强。Western blot直接法中,虫体蛋白与驴抗兔二抗IgG-HRP直接反应,结果显示,Ⅱ组和Ⅲ组有条带,且Ⅲ组(加入20%高免兔血清共培养组)的反应更加清晰,出现特异性条带,说明pET-30a-EgM9重组蛋白高免兔血清可以通过某种形式进入体外培养虫体体内和细粒棘球绦虫的虫体蛋白形成复合体。间接法中通过加入pET-30a-EgM9重组蛋白高免鼠血清,结果显示,Ⅴ组虫体蛋白出现了特异性条带,而Ⅳ组(PSC)不出现条带,验证了Zhang W B[10]等EgM9蛋白是成虫特有蛋白,表明EgM9可以作为疫苗候选基因进行研究。Ⅰ组、Ⅱ组、Ⅳ组、虫体蛋白及EgM9重组蛋白出现特异性条带,而Ⅲ组(加入20%高免兔血清共培养组)未出现条带,表明EgM9抗原表位可能被高免兔血清中抗体占据,所以在加入高免鼠血清进行抗原表位识别时,未出现特异性条带。陈云英[13]等人通过对体外培养原头蚴各个阶段的虫体EgM9基因之间的表达进行研究发现,EgM9基因随着培养天数的增加而增加。本研究通过对原头蚴和体外培养30 d虫体的EgM9基因表达差异进行分析比较验证了这一结论。Ⅲ组的EgM9表达量最高,其原因可能是高免血清中的EgM9抗体可以刺激虫体EgM9抗原的产生,从而导致EgM9基因表达水平升高。综上所述,pET-30a-EgM9重组蛋白高免兔血清通过与体外培养30 d虫体共培养,EgM9抗体可以结合虫体中EgM9的表达蛋白,且形成复合物,进而证实了EgM9基因是虫体性成熟发育的调控基因之一。

