钯催化膜上对硝基苯酚加氢本征动力学
李汉阳,孙晓旭,姜 红,陈日志
(1.南京工业大学材料化学工程国家重点实验室,江苏 南京 210009;2.南京工业大学江苏省工业节水减排重点实验室,江苏 南京 210009)
纳米催化剂具有比表面积大、催化性能优异等特点,从而引起广泛的关注[1-3]。纳米催化剂在液相反应体系中的使用状态可分为悬浮态和负载型,其中悬浮态的催化效率要优于负载型催化剂,但存在着细小催化剂颗粒与产品分离的问题[4]。为解决这一问题,研究者设计并开发了反应-陶瓷膜分离耦合技术,基于陶瓷膜的高效筛分性能有效地解决了细小催化剂的分离难题,但存在催化剂吸附、膜污染等问题[5,6]。前期工作[7]以陶瓷膜为载体,将纳米钯颗粒负载于陶瓷膜的表面构成钯/陶瓷膜催化剂,并用于对硝基苯酚液相加氢制备对氨基苯酚,避免了细小的钯催化剂与产品分离问题,但由于采用常规的浸渍法,纳米钯颗粒仅负载于陶瓷膜的膜层,而在陶瓷膜的支撑体中未发现钯颗粒,限制了纳米钯的负载量。本工作在前期工作基础上,设计了强制对流装置,采用强制对流方法将纳米钯颗粒负载于陶瓷膜的表面及孔道中,以提高陶瓷膜上钯颗粒的负载量,构成钯催化膜。制备催化膜并用于对硝基苯酚还原加氢制备对氨基苯酚的研究很多[8-10],但是动力学研究还未见报道。本工作主要在所制备的钯催化膜上研究对硝基苯酚加氢制备对氨基苯酚的本征动力学,构建本征动力学模型,为钯催化膜及膜反应器的进一步开发提供依据。
1 实验部分
1.1 钯催化膜制备与表征
采用强制对流方法制备钯催化膜,所用装置见图1。装置主要由3 部分组成:原料液槽、膜组件和蠕动泵。原料液槽为带夹套的1 L 玻璃容器。膜组件长180 mm,膜管用封头和法兰固定于膜组件内部。
所用陶瓷膜为单管对称氧化铝膜(长180 mm,外径12 mm,内径8 mm),由南京九思高科技有限公司提供。
钯催化膜制备过程分为3 步:膜表面改性、钯盐浸渍和还原。膜表面改性:室温下配制100 mL 浓度为6 g/L 的N-(β-氨乙基)-γ-氨丙基三甲氧基硅烷(KH792)/二氯甲烷溶液于原料槽中,开启蠕动泵使硅烷改性溶液经图1所示的膜组件进料口到达膜组件中陶瓷膜的外表面,并经孔道流入内表面,由膜组件出料口流回原料液槽,整个改性过程常温,并持续1 h,然后取出膜管,并用无水乙醇冲洗自然晾干。钯盐浸渍:将改性后的陶瓷膜固定于膜组件中,并配制浓度为0.015 mol/L 的乙酸钯/丙酮溶液100 mL 置于原料槽中,开启蠕动泵使乙酸钯溶液强制流过陶瓷膜孔道,与膜表面改性过程一致,控制浸渍温度30 ℃,浸渍时间12 h,将膜管取出并于室温干燥1 h。还原:将乙酸钯浸渍后的陶瓷膜管固定于膜组件中,并配制275 mL 浓度为0.04 mol/L 的水合肼还原液置于原料槽中,开启蠕动泵使水合肼还原液强制流过陶瓷膜孔道,控制还原温度为30 ℃与还原时间1 h,去离子水冲洗膜管并浸泡15 min,晾干备用。
采用高倍透射电镜(HRTEM,JEM-2010)表征钯催化膜中钯颗粒的粒径,刮取钯催化膜表面与断面的粉末放于样品管中,加入适量无水乙醇超声分散,将分散液滴加到覆有碳膜的铜网上,进行HRTEM 测试。
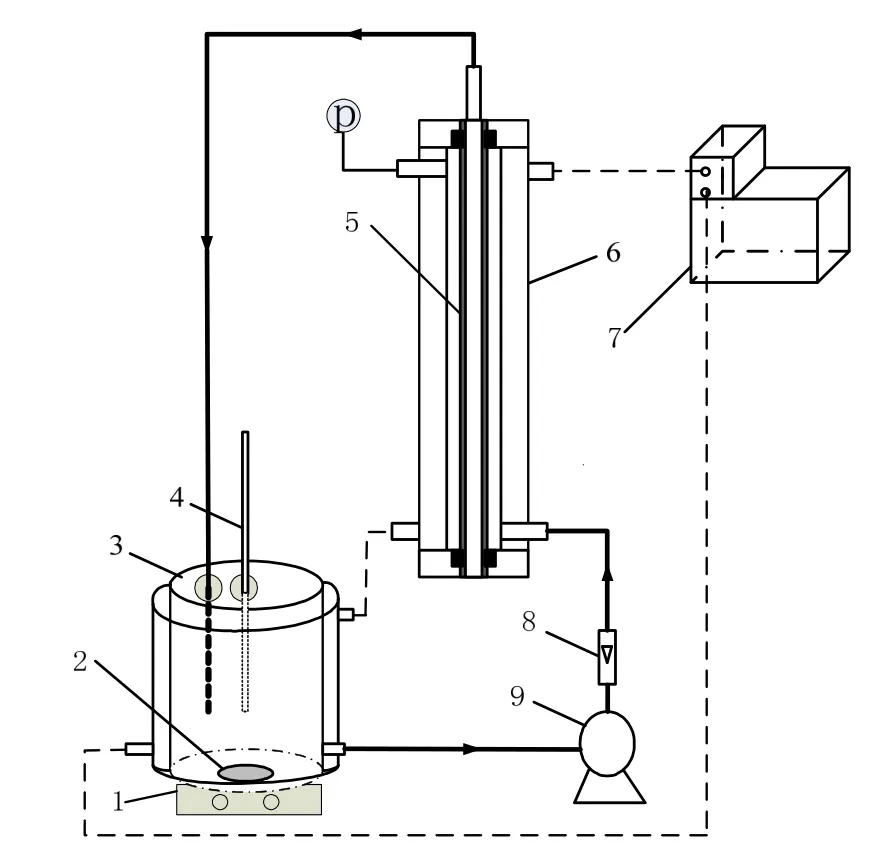
图1 强制对流制备钯催化膜装置Fig.1 Schematic of set-up for preparation of palladium catalytic membrane by the flow-through method
1.2 对硝基苯酚催化加氢反应
对硝基苯酚在钯催化膜催化作用下经硼氢化钠还原加氢制备对氨基苯酚,其反应式如下:
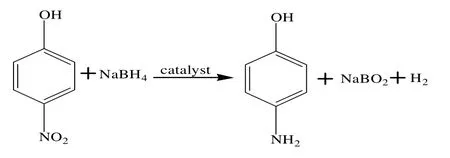
对硝基苯酚加氢反应在图1所示的装置中进行。在原料液槽中加入一定量的对硝基苯酚和20 mL无水乙醇,开动磁力搅拌器,待对硝基苯酚完全溶解后,加入480 mL 去离子水,然后加入一定质量的还原剂硼氢化钠,此时,开启蠕动泵,打开整个管路,反应开始,每隔一定时间段取样1 mL 分析。采用Aglient 1200 型高效液相色谱分析产物组成,并采用外标法定量。分析条件为:色谱柱ZORBAX Eclipse XDB-C18,250 mm×4.6 mm;柱温为35 ℃;流动相为甲醇与水的体积比为80∶20;流速为1 mL/min;检测波长为310 nm;进样量为2 µL。
1.3 动力学模型
幂函数动力学方程能够反映组分浓度和反应温度对反应速率的影响,能够较为精确地模拟实验数据[11,12],故采用幂函数方程来建立对硝基苯酚加氢的本征动力学模型并进行实验数据拟合。
钯催化膜上对硝基苯酚催化加氢反应按图1中的流程进行,其速率方程可表示为:

式中:CA和CB分别为反应体系中对硝基苯酚、硼氢化钠的浓度,mmol/L;R为气体常数,J/(mol·K);T为反应温度,K;Ea为反应活化能,J/mol;k为反应速率常数;k0为反应的指前因子;α和β为相应组分的反应级数。
通过改变对硝基苯酚浓度、硼氢化钠浓度以及反应温度等一系列单一因素,考察各种反应条件对对硝基苯酚反应速率的影响,并求取动力学参数。由于反应产物对氨基苯酚会继续氧化,故采用初始速率法[13]测对硝基苯酚的初始反应速率来求取反应动力学模型参数。
2 结果与讨论
2.1 本征动力学实验条件确定
钯催化膜上对硝基苯酚催化加氢是一个典型的液固两相催化反应,反应物料需流过陶瓷膜孔道并在孔道内的纳米钯颗粒表面上反应,故反应速率受物料扩散的影响,研究本征反应动力学时须消除扩散的影响[14]。对于粉体催化剂,通常通过减少催化剂粒度和增加搅拌速率消除内外扩散对反应的影响[12,15]。本工作通过增加蠕动泵的转动速率消除外扩散对反应的影响。固定反应温度30 ℃,对硝基苯酚浓度32 mmol/L,硼氢化钠浓度102 mmol/L,蠕动泵转速为30~70 r/min,考察蠕动泵转动速率对硝基苯酚初始反应速率的影响,结果见图2。由图可知,蠕动泵转动速率显著影响对硝基苯酚的初始反应速率,随转动速率的增加,对硝基苯酚的初始反应速率逐渐增加,当转动速率大于50 r/min 时,对硝基苯酚的初始反应速率基本不变,说明外扩散对反应的影响已基本消除。因此,后续实验中蠕动泵转速确保大于50 r/min。
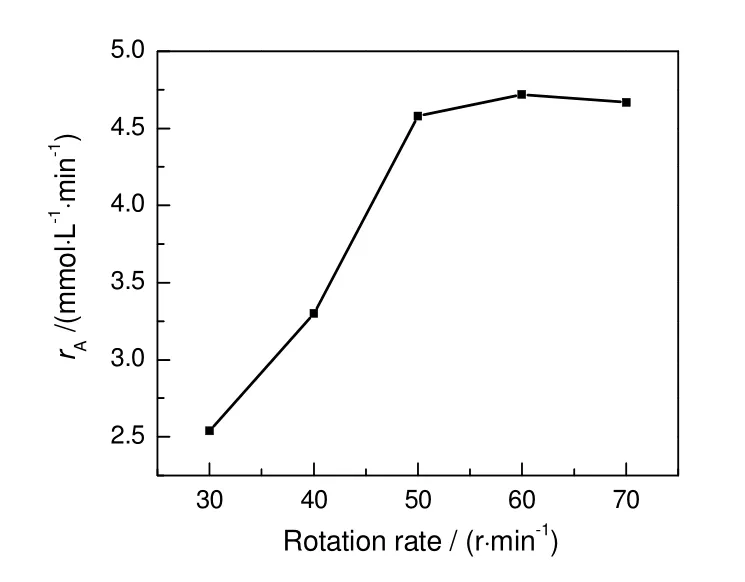
图 2 转速对初始反应速率的影响Fig.2 Effect of rotation rate on nitial reaction rate

图3 钯催化膜的TEM 结果Fig.3 TEM image of powder from as-prepared palladium catalytic membrane
影响内扩散的主要因素是催化剂粒度,本实验中钯催化剂粒径约为5 nm(图3),如此小的颗粒可通过Mears 准则来判断此催化剂中是否存在内扩散影响[16,17]。即当时,表明对于n级反应内扩散对反应速率的影响可以忽略。式中,Φ为改型Thiele 模数;(rA)obs为表观反应速率,mol/(L·min);L为催化剂颗粒的特征长度(此处为颗粒的直径),cm;De为反应物在催化剂颗粒中的有效扩散系数,cm2/min;为反应物在催化剂表面的浓度,mol/L;n为反应级数,0~3。在对硝基苯酚加氢反应体系中,rAobs,L,De和的数量级分别为10-3,10-7,10-5~10-4和10-3~10-2,因此,改型Thiele 模数的数量级为10-11~10-9,远小于,其内扩散影响可忽略。
2.2 本征动力学方程建立
2.2.1 对硝基苯酚浓度的影响
固定反应温度30 ℃,蠕动泵转速50 r/min,硼氢化钠浓度102 mmol/L,考察对硝基苯酚浓度对对硝基苯酚初始反应速率的影响,结果如表1所示。可见,在实验考察的范围内,初始反应速率随对硝基苯酚浓度的增加而基本不变。

表1 对硝基苯酚浓度对初始反应速率的影响Table 1 Effect of p-nitrophenol concentration on initial reaction rate
反应开始时CB为定值,令km=,则催化反应速率方程式(1)可改写为:

对式(3)两边取对数得:

将表1数据代入式(4),并作图。该拟合所得直线的斜率即为反应级数α,从图4的结果可以得到α为0,故在实验范围内对硝基苯酚对其初始反应速率几乎无影响[4,18],因此可认为该反应对于对硝基苯酚是0 级。
2.2.2 硼氢化钠浓度的影响
固定反应温度30 ℃,蠕动泵转速50 r/min,对硝基苯酚浓度32 mmol/L,考察硼氢化钠浓度对对硝基苯酚初始反应速率的影响,结果见表2。在实验考察的范围内,硼氢化钠浓度显著影响对硝基苯酚初始反应速率,随着硼氢化钠浓度的增加,初始反应速率会增大。
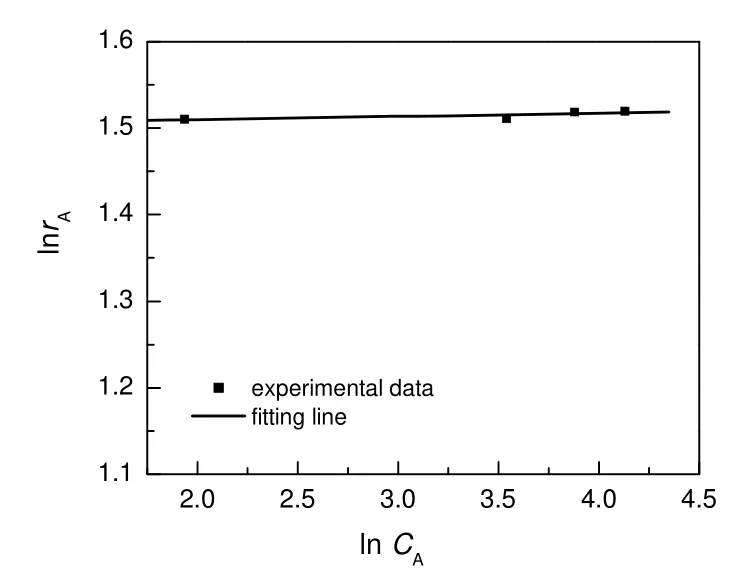
图 4 对硝基苯酚浓度对初始反应速率的影响Fig.4 Effect of p-nitrophenol concentration on initial reaction rate

表2 硼氢化钠浓度对初始反应速率的影响Table 2 Effect of sodium borohydride concentration on initial reaction rate

对式(5)两边取对数得:

将表2数据代入式(6),并作图,结果如图5所示。该拟合所得直线的斜率即为反应级数β,从拟合的结果得知β为0.75,即该反应对于硼氢化钠的反应级数为0.75。
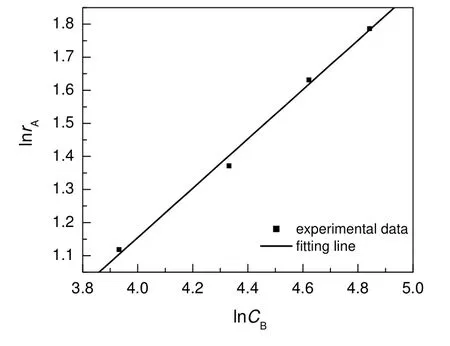
图5 硼氢化钠浓度对初始反应速率的影响Fig.5 Effect of sodium borohydride concentration on initial reaction rate
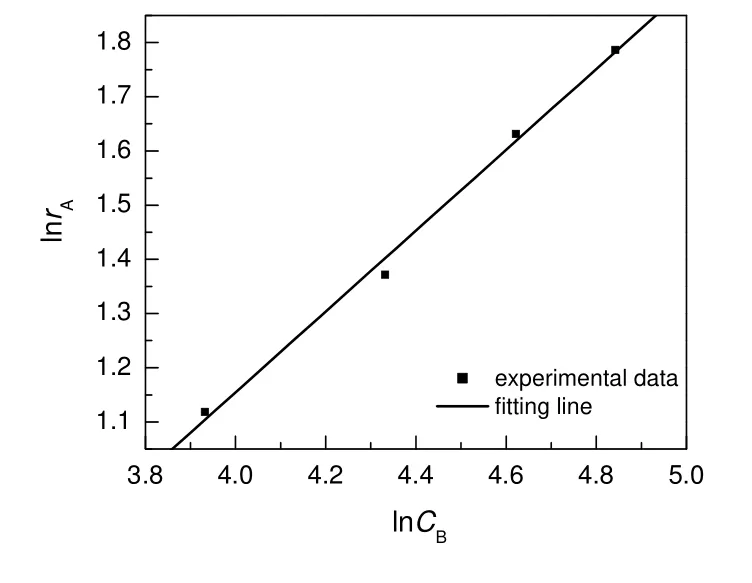
图6 反应速率常数与温度的关系Fig.6 Relationship between reaction rate constant and temperature
由以上分析得到钯催化膜上对硝基苯酚催化加氢的速率方程为:

2.2.3 反应活化能的计算
在蠕动泵转速50 r/min,对硝基苯酚浓度32 mmol/L,硼氢化钠浓度102 mmol/L 的条件下,分别测得不同温度下的对硝基苯酚初始反应速率,根据式(7)计算出相应反应温度的速率常数,见表3。

表3 不同温度下的反应速率常数Table 3 Reaction rate constant at different temperature
将表3数据带入阿伦尼乌斯方程(8),并作图(图6)。由图可知,lnk与T-1呈线性关系,其线性关联系数R为0.97,与前期工作相似[20]。回归得该反应的活化能(Ea)为8.45 kJ/mol,低于文献报道的加氢反应活化能数据[19,20],可能是由于本研究中用的还原剂是硼氢化钠;指前因子(k0)为4.24 mmol0.25/(L0.25·min )。

因此,钯催化膜上对硝基苯酚催化加氢的本征动力学方程可表示为:

2.3 本征动力学方程的验证
采用本征动力学方程(9)计算对硝基苯酚初始反应速率,并与实验实测值进行比较,结果如图7所示。模型计算的对硝基苯酚初始反应速率值与实验实测值比较吻合,其平均相对误差约为5%。说明在实验范围内,得到的本征动力学方程(9)可以很好地描述钯催化膜上对硝基苯酚催化加氢的动力学行为。
3 结 论
在蠕动泵转速为50 r/min,反应温度为20~50 ℃,对硝基苯酚浓度为6.93~62.2 mmol/L,硼氢化钠浓度为51.0~127 mmol/L 的条件下,研究了钯催化膜上对硝基苯酚催化加氢的动力学行为,建立了本征动力学模型,该动力学模型能较好地描述反应特性。研究工作对钯催化膜及膜反应器的开发具有指导意义。
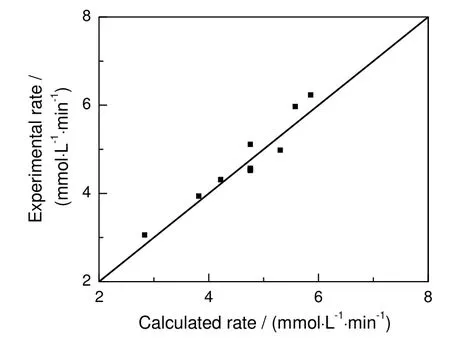
图7 初始反应速率的模型计算值与实测值比较Fig.7 Comparison of calculated and experimental initial reaction rate
[1]Wu H, Zhuo L M, He Q, et al.Heterogeneous hydrogenation of nitrobenzenes over recyclable Pd(0) nanoparticle catalysts stabilized by polyphenol-grafted collagen fibers[J].Applied Catalysis A:General, 2009, 366(1):44-56.
[2]Ouyang L, Dotzauer D M, Hogg S R, et al.Catalytic hollow fiber membranes prepared using layer-by-layer adsorption of polyelectrolytes and metal nanoparticles[J].Catalysis Today.2010,156(3-4):100-106.
[3]Chen R Z, Jiang Y G, Xing W H, et al.Preparation of palladium nanoparticles deposited on a silanized hollow fiber ceramic membrane support and their catalytic properties[J].Industrial and Engineering Chemistry Research, 2013, 52(14):5002-5008.
[4]Du Y, Chen H L, Chen R Z, et al.Synthesis ofp-aminophenol fromp-nitrophenol over nano-sized nickel catalysts[J].Applied Catalysis A:General, 2004,277(1-2):259-264.
[5]邢卫红, 金万勤, 陈日志, 等.陶瓷膜连续反应器的设计与工程应用[J].化工学报, 2010, 61(7):1666-1672.Xing Weihong, Jin Wanqin, Chen Rizhi, et al.Design and application of continuous ceramic membrane reactor[J].CIESC Journal, 2010,61(7):1666-1672.
[6]Chen R Z, Du Y, Xing W H, et al.Effect of initial solution apparent pH on the performance of submerged hybrid system for thep-nitrophenol hydrogenation[J].Korean Journal of Chemical Engineering, 2009, 26(6):1580-1584.
[7]Chen R Z, Jiang Y G, Xing W H, et al.Fabrication and catalytic properties of palladium nanoparticles deposited on a silanized asymmetric ceramic support[J].Industrial &Engineering Chemistry Research, 2011, 50(8):4405-4411.
[8]Ouyang L, Dotzauer D M, Hogg S R, et al.Catalytic hollow fiber membranes prepared using layer-by-layer adsorption of polyelectrolytes and metal nanoparticles[J].Catalysis Today, 2010, 156(3-4), 100-106.
[9]Dotzauer D M, Bhattacharjee S, Wen Y, et al.Nanoparticle-containing membranes for the catalytic reduction of nitroaromatic compounds[J].Langmuir, 2009, 25(3):1865-1871.
[10]Domènech B, Mũnoz M, Muraviev D N, et al.Catalytic membranes with palladium nanoparticles:From tailored polymer to catalytic applications[J].Catalysis Today, 2012, 193(1):158-164.
[11]曹向禹, 崔崇威, 黄君礼.硫代硫酸钠还原二氧化氯的动力学[J].高校化学工程学报, 2007, 21(5):803-807.Cao Xiangyu, Cui Chongwei, Huang Junli.Kinetics of chlorine dioxide reduction by thiosulfate[J].Journal of Chemical Engineering of Chinese Universities, 2007, 21(5):803-807
[12]李朝辉, 卜 真, 陈日志, 等.TS-1 催化丙酮氨氧化制丙酮肟的本征动力学研究[J].高校化学工程学报, 2009, 23(3):423-427 Li Zhaohui, Bu Zhen, Chen Rizhi, et al.Intrinsic kinetics of ammoximation of acetone with hydrogen peroxide catalyzed by TS-1[J].Journal of Chemical Engineering of Chinese Universities, 2009, 23(3):423-427.
[13]天津大学物理化学教研室.物理化学(下册) [M].第3 版.北京:高等教育出版社, 1993:458-461.
[14]卢长娟, 陈日志, 金万勤, 等.TS-1 催化苯酚羟基化制苯二酚的本征动力学研究[J].高校化学工程学报, 2008, 36(6):38-41.Lu Changjuan, Chen Rizhi, Jin Wanqin, et al.Intrinsic kinetics of hydroxylation of phenol to catechol with TS-1 peroxide catalyst[J].Journal of Chemical Engineering of Chinese Universities, 2008, 36(6):38-41.
[15]Raweewan K, Santi K, Pramoch R, et al.Kinetic modeling of phenol hydroxylation using titanium and tin silicalite-1s:effect of tin incorporation[J].Chemical Engineering Journal, 2007, 129(1-3):21-30.
[16]Mears D E.Test for transport limitations in experimental catalytic reactors[J].Industrial &Engineering Chemistry Process Design Development, 1971, 10(4):541-547.
[17]Froment G F, Bischoff K B.Chemical reactor analysis and design[M].New York:John Wiley &Sons:1979:190-200.
[18]Vaidya M J, Kulkarni S M, Chaudhari R V.Synthesis ofp-aminophenol by catalytic hydrogenation ofp-nitrophenol[J].Organic Process Research and Development, 2003, 7(2):202-208.
[19]Taghavi F, Falamaki C, Shabanov C, et al.Kinetic study of the hydrogenation ofp-nitrophenol top-aminophenol over micro-aggregates of nano-Ni2B catalyst particles[J].Applied Catalysis A:General, 2011, 407 (1-2):173-780.
[20]姜元国, 李汉阳, 孙晓旭, 等.钯/陶瓷膜催化剂上对硝基苯酚加氢宏观动力学[J].化学工程, 2013, 41(4):49-52.Jiang Yuanguo, Li Hanyang, Sun Xiaoxu, et al.Macro-kinetics ofp-nitrophenol hydrogenation on Pd/ceramic membrane catalysts[J].Chemical Engineering, 2013, 41(4):49-52.

