哈密马奶酒中7 株乳酸菌分离株发酵性能研究
张伟钦 妥彦峰 许 倩 王 叶
(1 塔里木大学生命科学学院/南疆特色农产品深加工兵团重点实验室,新疆 阿拉尔843300)(2 光明乳业研究院乳品生物技术国家重点实验室,上海 200070)
乳酸菌(Lactic acid bacteria,LAB)是人体肠道中的正常菌群,并且作为发酵剂在发酵乳制品生产中普遍使用,具有长期的安全食用史[1]。乳酸菌不但赋予发酵食品特有的风味,还具有一定的益生功能,Metchnikoff 在1908年首次提出摄食发酵食品对人体具有保健功能,而发酵食品的保健功能得益于其中的微生物,现已清楚发酵食品中的乳酸菌对人体具有多种保健功能,如提高机体免疫力[2],防止肠致病性微生物感染[3],防止诱变剂损伤机体和预防肿瘤的发生[4]。
新疆哈萨克族百姓长期制作和食用传统发酵乳制品,如马奶酒、奶疙瘩、酸奶等,这些乳制品中含有丰富的乳酸菌资源。其中马奶酒是以新鲜马奶为原料,经乳杆菌属细菌和酵母等微生物共同自然发酵形成的酸性低酒精度乳饮品。在马奶发酵成熟过程中,乳杆菌属细菌和酵母构成其优势微生物类群,赋予马奶酒独特的风味特征[5]。
从传统发酵马奶酒中可以分离筛选获得具有益生功能及优良发酵性能的乳酸菌菌株。本研究从新疆哈密地区哈萨克族牧民家庭采集4 份马奶酒样品,对所分离出的乳酸菌进行了产酸、后酸化、耐酸性能及耐胆盐能力筛选试验,旨在筛选出产酸能力,耐酸及耐胆盐性能强,后酸化能力弱的乳酸菌株,为进一步开发乳酸菌发酵剂提供支持。
1 材料与方法
1.1 材料
1.1.1 样品与供试菌株
4 份马奶酒样品均采自新疆维吾尔族自治区哈密巴里坤地区牧民家庭,是由哈萨克族牧民家庭用传统工艺酿造。试验所用菌株为样品中分离出的7株乳酸菌。
1.1.2 培养基
乳酸菌株的分离及富集培养采用MRS 培养基[6]。产酸能力测定试验采用12%(w/v)脱脂乳培养基。
1.1.3 主要仪器与设备
LDZX-40BI 立式自动电热压力蒸汽灭菌器、SW-CJ-1F 超净工作台、BX 50 奥林巴斯光学显微镜,恒温培养箱,pH 计等。
1.2 方法
1.2.1 乳酸菌株的筛选
1.2.1.1 将样品于无菌条件下进行10 倍梯度稀释,取10-3、10-4两个稀释度,各取0.1 mL 稀释液涂布于MRS 固体平板培养基,置于37℃恒温培养箱中培养48 h。
1.2.1.2 观察菌落,将菌落较小,直径约1~3 mm,圆形隆起,表面光滑或稍有粗糙,呈乳白色,灰白色或暗黄色的特征性菌落划线接种到MRS 固体平板培养基进行进一步纯化,对再次长出的特征性菌落进行革兰氏染色,确定是否为纯菌。对分纯的菌株进行革兰氏染色、过氧化氢酶试验,革兰氏染色阳性、过氧化氢酶试验阴性的菌株初步确定为乳酸菌。分离获得的乳酸菌在MRS 液体培养基中传代培养,并于4℃保存待用。临用前活化传代2 次,使菌株活力恢复。
1.2.1.3 将传代后的乳酸菌菌株接入脱脂乳培养基,于37℃培养,选择能够使脱脂乳10 h 内凝乳,表面无乳清析出或少量乳清析出的菌株,进行后续试验。
1.2.2 乳酸菌株的产酸能力测定
将乳酸菌株按2%接种量接种至灭菌脱脂乳培养基,于37℃恒温培养箱培养,每隔1 h 取两个平行样品测定滴定酸度,连续测定8 h,并作酸度随时间变化的曲线图。以此来判断乳酸菌的产酸能力[11]。滴定酸度测定方法见国家标准GB/T 5409-1985[7]。
1.2.3 乳酸菌株后酸化能力测定
将乳酸菌株按2%接种量接种至灭菌脱脂乳培养基,37℃培养至凝乳后置于4℃冰箱保存。测定凝乳在冷藏第12、24、36、48、60、72、84 h 时的滴定酸度[7],每次测定两个平行样品。通过计算酸奶在冷藏过程酸度的增加值来判断乳酸菌后酸化能力的强弱。
1.2.4 乳酸菌株耐胆盐能力测定
将活化后的菌株按2%接种量接种至胆盐浓度分别 为0.0%、0.1%、0.2%、0.3%、0.4%、0.5%的MRS 液体培养基中,置于37℃培养箱培养,每隔1 h 采用涂布法做菌落计数,每个稀释度做两个平行,连续测定4 h,根据菌落数的变化确定菌株耐胆盐能力。
1.2.5 乳酸菌株耐酸能力测定
将活化后的菌株按2% 接种量接种至pH 为2.5的MRS 液体培养基中,置于37℃培养箱培养,每隔1 h 采用涂布法做菌落计数,每个稀释度做两个平行,连续测定3 h,根据菌落数的变化确定菌株耐酸能力。
2 结果与分析
2.1 乳酸菌株的筛选
经形态观察、革兰氏染色及过氧化氢酶试验,共筛选得到7 株乳酸菌(编号为M3.2、M3.3、M3.4、M4.2、M4.6、M4.7、M4.8),均为革兰氏阳性、过氧化氢酶阴性,长杆状或短杆状,且凝乳状态良好,初步确定为乳杆菌属细菌。
2.2 乳酸菌的产酸能力
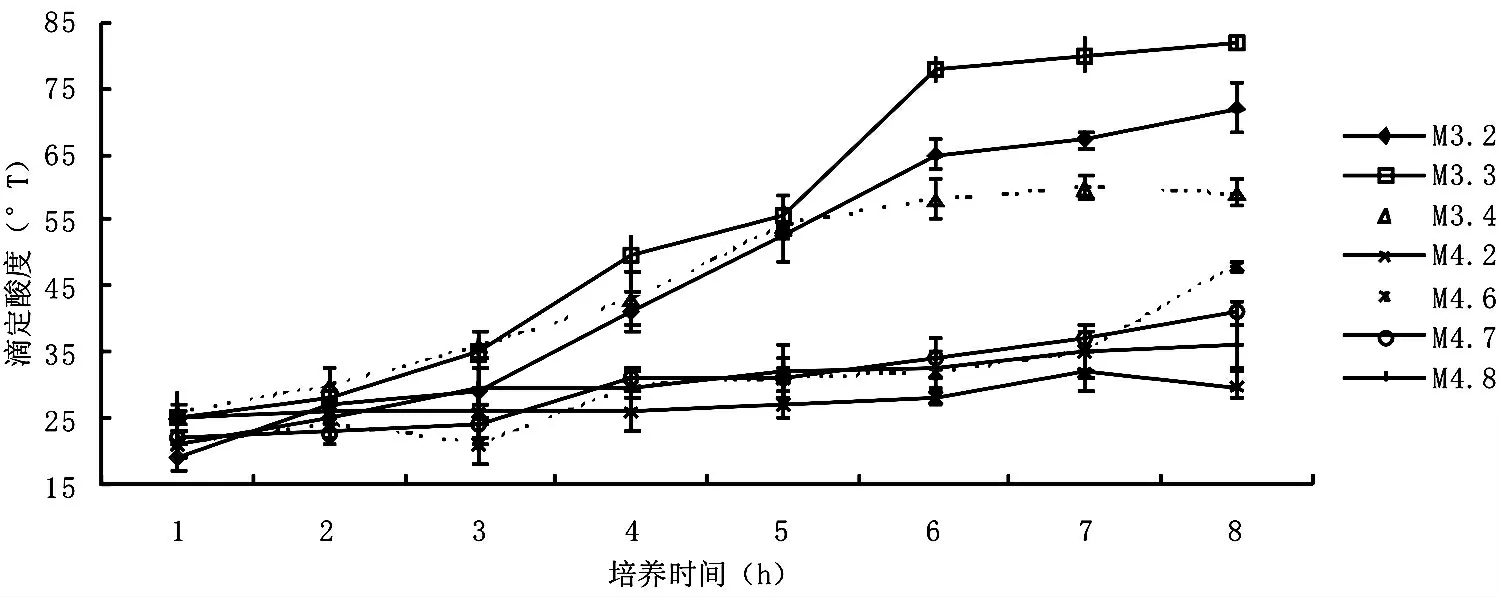
图1 所分离乳酸菌株的产酸能力曲线
乳酸菌株的产酸能力高低影响酸奶加工周期的长短、生产效率的高低和风味的优劣,是一个重要的质量指标。本试验通过绘制乳酸菌株在脱脂乳凝乳过程中酸度随时间变化的曲线来确定菌株产酸能力的强弱。
从7 株乳酸菌株产酸曲线图(图1)可以看出,前3 h 乳酸菌产酸速率很低,3~6 h,M3.2、M3.3、M3.4 产酸速率增大;M4.2、M4.6、M4.7、M4.8 产酸速率相对缓慢平稳;6~8 h,M3.2、M3.3、M3.4 产酸速率降低,酸度达到高峰,趋于稳定;M4.2、M4.7、M4.8 产酸速率依旧缓慢平稳;M4.6 产酸速率增大。综上,7 株乳酸菌产酸能力强弱顺序为:M3.3>M3.2 >M3.4 >M4.6 >M4.7 >M4.8 >M4.2。
2.3 乳酸菌后酸化能力
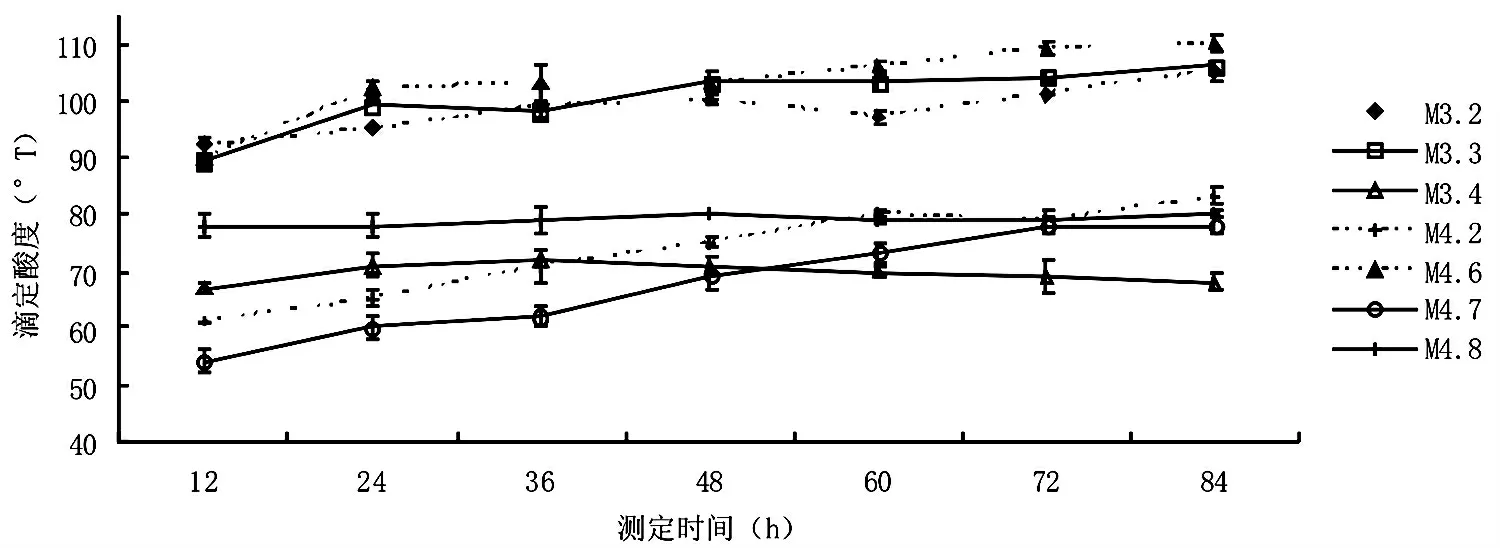
图2 所分离乳酸菌株的后酸化性能曲线
优良酸奶发酵剂的乳酸菌株应具备后酸化性能弱的特点。后酸化能力弱的发酵剂,一般在5℃贮藏3 周后,滴定酸度仅增加7.5~10.0 °T[8]。经过84 h的冷藏,7 株乳酸菌发酵酸奶的酸度有所变化,但变化不大,呈缓慢上升趋势(图2)。从酸奶冷藏过程中的酸度变化可以看出,M4.7 酸度增加24 °T,M4.2 酸度增加22 °T,M4.6 酸度增加21 °T,M3.3酸度增加17 °T,M3.2 酸度增加10 °T,M3.4 酸度增加5 °T,M4.8 酸度增加2 °T,从几株菌后酸化过程中滴定酸度的差值可看出,M3.2、M3.4、M4.8 后酸化能力较弱。
2.4 乳酸菌株耐胆盐能力的测定
健康人体肠道中胆盐浓度在0.1%~0.5%范围,本试验通过调节MRS 培养基中胆盐浓度,模拟人体肠道环境。食物通过人体肠道的时间,最长为4 h,4 h 后菌株仍存活,菌株的耐胆盐能力越强。具有较强胆盐耐受性的菌株,可在肠道存活,从而发挥益生功能。
所分离乳酸菌耐胆盐的测定结果见表1。当胆盐浓度分别为0.3%、0.4%、0.5%时,7 株菌仅在第0 h 时测得有活菌存在,第1~4 h 均无活菌存在,故相应数据未在表1 中列出。除菌株M4.8,其它菌株在胆盐浓度为0.1%时保持4 h,均有不同程度的增殖,说明菌株M3.2、M3.3、M3.4、M4.2、M4.6 和M4.7 均可在0.1%胆盐浓度条件下存活,并有一定量的增殖;当菌株在胆盐浓度为0.2%时保持4 h,菌株M3.2、M4.2 和M4.6 均有存活,而其它菌株均无存活,因此菌株M3.2、M4.2 和M4.6 具有较好的胆盐耐受能力。
2.5 乳酸菌株耐酸能力的测定
乳酸菌口服进入宿主后的生存障碍首先是胃的低pH 值。单胃动物胃液的pH 随饮食变化波动很大,胃液pH 一般在2.0 左右,进食后pH 可达3.0~5.0 之间,食物被胃消化大约需要2~4 h。所以本试验选择将MRS 培养基pH 值调为2.5,乳酸菌培养时间为3 h,模拟菌株在人体胃环境的生长情况,筛选具有耐酸能力的菌株,结果见表2 所示。
在pH2.5 条件下保持1 h,所有菌株均有不同程度的增殖;在pH2.5 条件下保持3 h,菌株M3.2、M3.4、M4.2 和M4.7 均有存活、耐酸性较好,而菌株M3.3、M4.8、M4.6 不能存活。
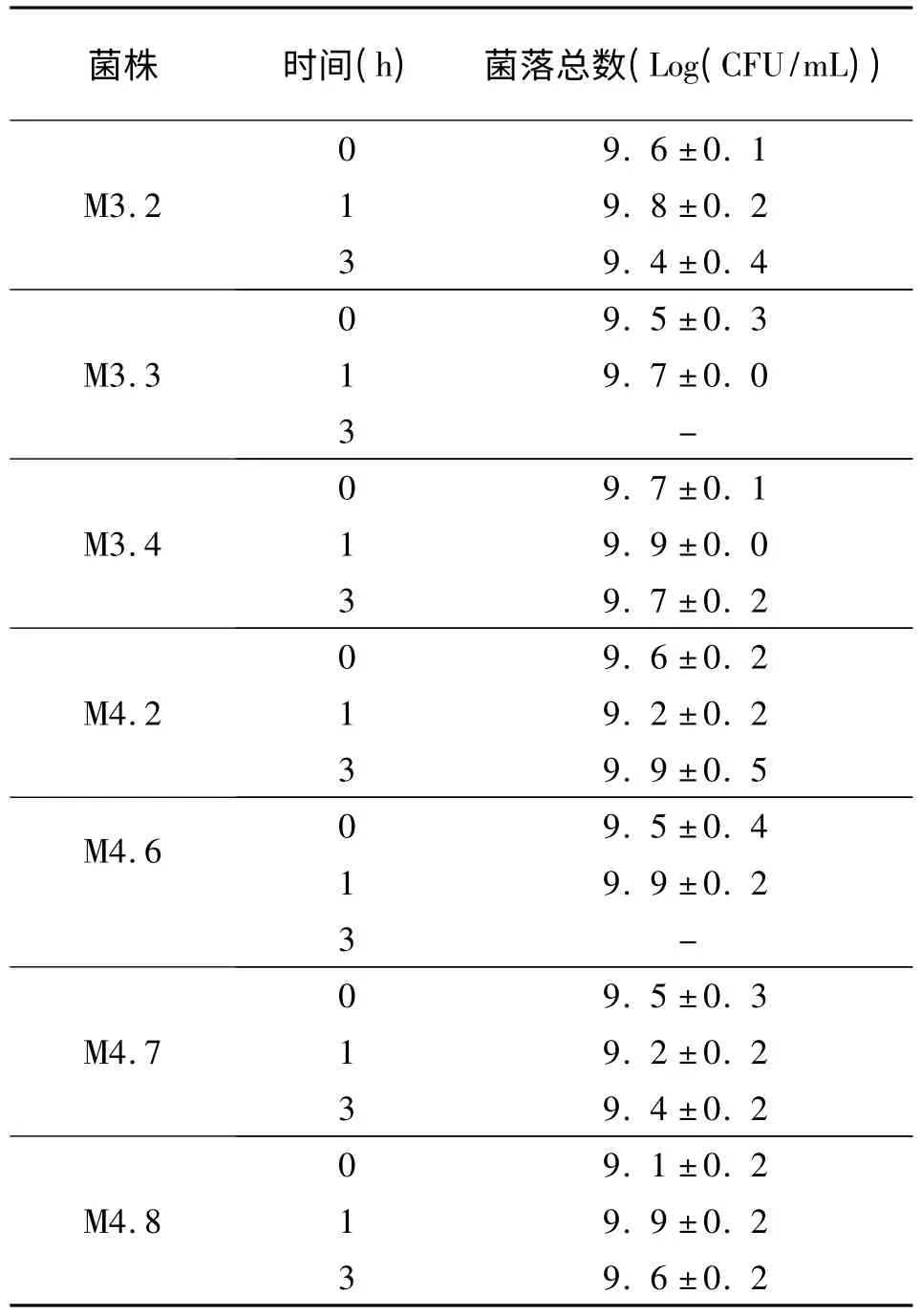
表2 所分离乳酸菌株耐酸能力测定
3 结论
从新疆哈密地区采集的4 份马奶酒样品中共筛选出7 株乳酸菌,M3.2、M3.3、M3.4 产酸能力较强,M3.2、M3.4、M4.8 后酸化能力较弱,M3.2、M4.2 和M4.6 耐胆盐能力较强。M3.2、M3.4、M4.2 和M4.7 耐酸能力较强。四种性能测定中,M3.2 菌株满足了产酸能力强,后酸化能力弱,耐胆盐及耐酸能力强的特性,还需要进行菌株对发酵乳质构、风味影响的研究,以及不同菌株混合发酵性能的测定,为制备混合型酸奶发酵剂提供理论依据。
[1]Ahrne S,Nobaek S,Jeppsson B,et al.The normal Lactobacillus flora of healthy human rectal and oral mucosa[J].Journal of Applied Microbiology,1998,85:88-94.
[2]Tuo Y F,Zhang L W,Han X,et al.In vitro assessment of immunomodulating activity of the two Lactobacillus strains isolated from traditional fermented milk[J].World Journal of Microbiology & Biotechnology,2011,27:505-511.
[3]Reid G,Jass J,Sebulsky M T,et al.Potential uses of probiotics in clinical practice[J].Clinical Microbiology Reviews,2003,16:658-672.
[4]Tuo Y F,Zhang L W,Yi H X,et al.Antiproliferative effect of wild Lactobacillus strains isolated from fermented foods on HT-29 cells[J].Journal of Dairy Science.2010,93(6):2362-2366.
[5]孟和毕力格,乌日娜,王立平,等.不同地区马奶酒中乳杆菌的分离及其生物学特性的研究[J].中国乳品工业,2004,32(11):6-11.
[6]陈天寿.微生物培养基的制造与应用[M].第1 版.北京:中国农业出版社,1995:301-383.
[7]GB/T 5409-1985.牛乳检验方法[S].
[8]许本发.酸奶和乳酸菌饮料加工[M].第1版.北京:中国轻工业出版社,1994:32-36.

