皖南地区眼镜蛇毒活性组分镇痛效应的初步研究*
闵志雪, 黄 璐, 孙 瑶, 包鹏举,2, 王海华,2, 张根葆△
疼痛是脑对急性或慢性组织损伤所引起的伤害性传入进行抽象和概括后所形成的不愉快感觉,常常伴有复杂的自主神经活动、运动反射、心理和情绪反应。药物是疼痛治疗最常用和最基本的方法。目前缺乏作用强、不成瘾、可长期安全服用的镇痛药。因此镇痛效果良好而不具成瘾性的镇痛药的开发研究一直是疼痛控制的路径之一。
二十世纪初,人们就开始应用蛇毒治疗疼痛,与传统药物相比,蛇毒镇痛镇痛时间长,无成瘾性和耐药性,用量少,对顽固性疼痛、神经性疼痛和癌性疼痛都有效[1]。自发现粗毒具有镇痛活性以来,国内外分离纯化发现约百余种镇痛组分,从成分复杂的粗毒中分离纯化寻找可靠的纯度较高而效果良好的镇痛组分,并对其结构性质、作用机制进行研究具有重要意义。皖南地区地处亚热带,气候温和,丘陵山地偏多,蛇的蕴藏量相当丰富。关于皖南地区眼镜蛇毒镇痛组分尚未见报道,因此对皖南地区眼镜蛇毒中镇痛成分进行研究开发和应用是一个很有价值的研究方向。
材料和方法
1 材料
1.1 主要仪器与试剂 AKTA prime蛋白质纯化系统(Pharmacia),pHs-3B型 pH计(上海雷磁仪器厂),RB智能热板仪(四川成都仪器厂),眼镜蛇毒由皖南医学院蛇毒研究所提供,P/ACE MDQ高效毛细管电泳液(贝克曼库尔特公司),SP Sephadex C-50和Sephadex G-50为Pharmacia产品;透析袋,截留相对分子量3 500(Sigma),盐酸吗啡(morphine chloride)注射液(批号101006-1)购自沈阳第一制药厂,低分子量标准蛋白购自上海生工公司。其余试剂均为国产分析纯。
1.2 动物 昆明种小鼠244只,体重(20±2)g,由南京青龙山动物繁殖场提供(批号为SCXK苏2007-0001),适应性喂养1周。动物实验符合实验动物伦理规定。
2 方法
2.1 眼镜蛇毒镇痛因子(cobra venom analgesic factor,CVAF)的分离纯化和保存 纯化方法参考童富淡等[2],对皖南地区眼镜蛇粗毒使用阳离子交换色谱(cation-exchange chromatography,CEC)和分子排阻层析(size exclusion chromatography,SEC)进行分离纯化,取0.5 g眼镜蛇毒冻干粉对眼镜蛇粗毒进行预处理后溶于0.01 mol/L磷酸盐缓冲液(pH 6.0)中,6 000 r/min、4 ℃离心15 min,取上清0.22 μm 滤膜过滤后备用。平衡后过SP Sephadex C-50阳离子交换色谱,柱规格为1.7 cm ×40.0 cm,洗脱液0.01 mol/L磷酸盐缓冲液,pH=6,流速为1 mL/min,每管6 mL,分段梯度洗脱;测定A280,绘制洗脱曲线,收集各峰洗脱液。使用小鼠热板法筛选镇痛活性明显的组分进行Sephadex G-50纯化,柱规格为1.6 cm×50.0 cm,洗脱液为生理盐水,流速为 0.5 mL/min,直线洗脱。脱盐、脱水后将洗脱液配成一定的浓度分装于冻干管中(每管1 mL),4℃下放置30 min后,转至-20℃下保存30 min,再置于-80℃中预冻3 h,最后经冷冻干燥机真空冻干24 h。将制成的蛇毒冻干粉于-20℃中密封保存。
2.2 CVAF的纯度和相对分子量测定
2.2.1 SDS-PAGE 采用不连续缓冲系统进行十二烷基酸钠-聚丙烯酰胺凝胶电泳(SDS-PAGE),分离胶(T=20%,pH 8.8)和浓缩胶(T=5%,pH 6.8),以Tris-HCl溶液为缓冲系统,向加样槽孔中加入20 μL制备好的样品以及6 μL超低分子量蛋白质marker;电泳装置与电源相连,浓缩胶上所加电压90 V,当染料前沿进入分离胶后,把电压提至140 V,继续电泳至溴酚蓝到达分离胶的底部,关闭电源;电泳完毕后,小心取出凝胶,置于染色液中染色过夜;染色完毕后,将凝胶置于脱色液中脱色,并轻轻晃动至蓝色背景消失为止。凝胶扫描,记录条带,计算Rf值,用分子量的对数作图,以marker为对照,计算样品分子量。
2.2.2 毛细管区带电泳法(capillary zone electrophoresis,CZE) 电泳分离条件:0.05 mol/L pH 7.4的Tris-HCl缓冲液,1 mL样品(浓度为1 g/L)放入4℃样品盒中,压力(20 psi)进样5 s,毛细管长60.2 cm,有效内径50 cm×75 μm,检测波长198 nm,运行电压25 kV,卡盒温度25℃,运行时间15 min。
2.3 CVAF的镇痛活性测定
2.3.1 热板法 选取18~22 g昆明种雌性小鼠50只,基础痛阈大于5 s小于30 s,测量2次取平均痛阈作为基础痛阈,按痛阈区组随机化分成生理盐水正常对照组、盐酸吗啡阳性对照组和CVAF实验组(高剂量组、中剂量组和低剂量组),每组10只。生理盐水组腹腔注射0.2 mL生理盐水;盐酸吗啡组腹腔注射0.2 mL盐酸吗啡(剂量5 mg/kg);CVAF组腹腔注射 0.2 mL CVAF,剂量分别为 0.03 mg/kg、0.1 mg/kg和0.3 mg/kg。以舔后足为痛反应指标,以小鼠痛反应时间为痛阈,观察痛阈变化。痛阈提高率(%)=(给药后痛阈-给药前基础痛阈)/生理盐水组痛阈×100%。
2.3.2 醋酸扭体法 选取18~22 g昆明种小鼠50只,随机化分为生理盐水正常对照组、盐酸吗啡阳性对照组和CVAF实验组(高剂量组、中剂量组和低剂量组),每组10只。室温22~26℃。生理盐水组腹腔注射0.2 mL生理盐水;盐酸吗啡组腹腔注射0.2 mL盐酸吗啡(剂量5 mg/kg);CVAF组腹腔注射0.2 mL CVAF,剂量分别为0.03 mg/kg、0.1 mg/kg 和 0.3 mg/kg,1 h 后 ip 0.8%醋酸0.1 mL/10 g,以小鼠腹部内凹、躯干与后肢伸张、臀部高起、后肢伸长等行为反射称为完整扭体反应1次。观察15 min以内扭体次数。计算扭体反应抑制率。抑制率(%)=(空白组扭体数 -给药组扭体数)/空白组扭体数 ×100%。
3 统计学处理
数据以均数±标准差(mean±SD)来表示,多组均数比较用单因素方差分析(One-way ANOVA),两两比较用SNK法,以P<0.05为差异有统计学意义。使用SPSS 16.0统计软件处理。
结 果
1 CVAF的分离纯化
经SP Sephadex C-50阳离子交换色谱后呈5个峰(图1),小鼠热板法预实验结果显示第5峰镇痛活性明显,取第5峰经Sephadex G-50进一步纯化,得到3个峰,预实验结果显示第2峰具有镇痛活性,收集第2峰洗脱液,装透析袋,脱盐、脱水、冻干后呈粉末状。
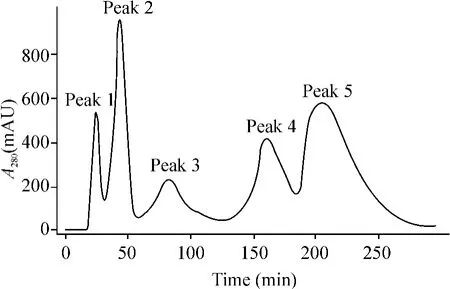
Figure 1.Cation-exchange chromatography of crude snake venom on SP Sephadex C-50图1 粗蛇毒的SP Sephadex C-50阳离子交换色谱图
2 SDS-PAGE凝胶垂直电泳
结果显示CVAF相对分子质量为6 500 D,呈单一条带,见图2。

Figure 2.SDS-PAGE analysis of CVAF.图2CVAF的SDS-PAGE凝胶垂直电泳分析
3 毛细管区带电泳
结果显示CVAF样品为单峰,与SDS-PAGE凝胶垂直电泳结果基本一致,见图3。
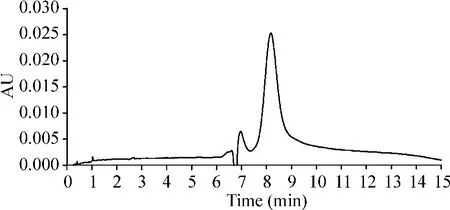
Figure 3.Capillary zone electrophoresis analysis of CVAF.图3 CVAF的毛细管区带电泳分析
4 镇痛活性测定
4.1 热板法 在小鼠热板法实验中测定热刺激反应显示吗啡组在给药0.5 h后达高峰,6 h镇痛作用消失;0.5 h时0.3 mg/kg CVAF组小鼠痛阈与吗啡组相比无统计学意义(P>0.05),0.03 mg/kg、0.1 mg/kg和0.3 mg/kg CVAF在给药后痛阈提高百分率分别为9.31%、53.78%和79.23%;2 h时CVAF 0.3 mg/kg组小鼠痛阈与吗啡组相比差异无统计学意义(P> 0.05);0.03 mg/kg、0.1 mg/kg和0.3 mg/kg CVAF在给药后痛阈提高百分率分别为11.23%、74.44%和117.44%,6 h时0.3 mg/kg的CVAF组小鼠痛阈与吗啡组相比有统计学意义(P<0.05);0.03 mg/kg、0.1 mg/kg和 0.3 mg/kg CVAF 在给药后痛阈提高百分率分别为62.81%、95.58%和155.86%;0.03 mg/kg、0.1 mg/kg和 0.3 mg/kg的CVAF在给药后8 h小鼠痛阈提高百分率分别为42.08%、67.86%和136.17%。CVAF的镇痛作用自0.5 h开始,且持续8 h仍存在。上述结果显示CVAF能使小鼠对热刺激的反应时间延长,且具剂量相关性,见图4。
4.2 醋酸扭体法 在醋酸扭体实验中,腹腔注射0.03 mg/kg、0.1 mg/kg 和0.3 mg/kg CVAF 后,随着剂量增加,0.1 mg/kg和0.3 mg/kg小鼠扭体次数与对照组相比,差异显著(P<0.01);0.3 mg/kg小鼠扭体次数与吗啡组相比无明显差异(P>0.05)。小鼠扭体抑制率分别为27%、50%和70%,说明CVAF能降低小鼠对化学刺激引起的敏感性,见表1。
讨 论

Figure 4.Analgesic effect of CVAF examined by hot-plate test.Mean ±SD.n=10.*P <0.05,**P <0.01 vs NS group;#P <0.05,##P <0.01 vs morphine group.图4 热板法测定CVAF对小鼠痛阈的影响
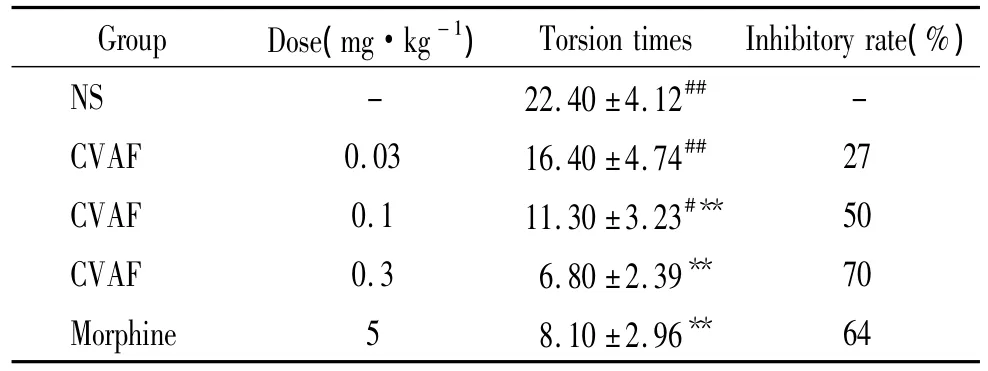
表1 CVAF组分对小鼠醋酸扭体次数的影响Table 1.The effect of CVAF on mice in acetic acid writhing test(mean±SD.n=10)
皖南地区蛇毒资源丰富,蛇毒中有效成分的开发和应用具有广阔的应用前景。蛇毒是一种天然生物毒库,具有抗凝[3]、镇痛[4]、抗肿瘤等[5]广泛的生物学及药理学活性。疼痛是多种疾病引起的常见临床症状,已成为继呼吸、脉搏、体温和血压之后的“第五大生命指征”。临床常用的镇痛药主要为非甾体类抗炎药和阿片类强效镇痛药。前者以阿司匹林为代表,是弱镇痛药;后者以吗啡为代表,是强镇痛药。非甾体类抗炎药具有抗炎、退热和镇痛作用,临床用途较广,作为镇痛药主要用于慢性疼痛。其特点是镇痛作用温和,无成瘾性。缺点是镇痛强度不够,消化道不良反应较严重,个别药物有心血管不良反应、肝毒性或过敏反应。阿片类镇痛药是麻醉性镇痛药,临床限于急性锐痛的短期止痛,如外科手术和术后止痛、骨折及急性内脏绞痛,也用于一些终末期患者无法治疗的顽固性疼痛,如晚期癌症的剧烈疼痛。其特点是起效快,镇痛作用强。缺点是具有成瘾性,耐受性,引起呼吸抑制、内分泌机能减退等严重不良反应[6]。目前缺乏作用强但不成瘾,可长期安全服用的镇痛药。1936年Macht等曾报道与强镇痛类药物如吗啡相比,眼镜蛇毒治疗因癌组织压迫神经引起疼痛的晚期癌症病人有显著疗效。与强镇痛类药物如吗啡相比,眼镜蛇毒制剂无麻醉作用,作用持久,连续应用无耐受,不成瘾;相反地在出现疗效后用量可递减。但是镇痛作用起效较慢以及其它副作用限制其临床的应用。因此,成分复杂的粗毒中分离纯化出纯度较高而效果良好的镇痛组分,并对其结构性质、作用机制进行研究具有重要意义。本实验采用离子交换色谱和排阻层析结合的方法对皖南地区眼镜蛇粗毒进行分离纯化筛选得到一种镇痛因子CVAF,相对分子量为6.5 kD,从 SDS-PAGE电泳来看可呈单一主带,可认为达到电泳纯。
通过急性生理性疼痛模型小鼠热板法及化学致痛模型醋酸扭体实验发现纯化产物具有剂量依赖性的中枢和外周镇痛作用,热板法为热刺激疼痛模型,舔足底动作不仅是脊髓反应,而且与高级中枢有关。小鼠热板法是通过足部温度感受器感受热刺激,信息经躯体神经的传入,在有高位中枢参与下完成的躯体缩爪反应。热板法实验显示CVAF的镇痛作用自0.5 h开始,且持续8 h仍存在。扭体法中0.03 mg/kg、0.1 mg/kg和0.3 mg/kg CVAF 在给药后小鼠扭体抑制率分别为27%、50%和70%。呈现一定的量效关系,高剂量组镇痛效果优于吗啡组。提示CVAF对化学物质刺激致痛具有明显的镇痛作用。热板法和扭体法致痛的原因、性质、传导途径、强度各有差别,提示CVAF的镇痛作用机制十分复杂,可能涉及多种通路。疼痛的产生及调控是涉及多部位多机制的复杂过程,目前研究发现蛇毒镇痛可能与胆碱能系统[7-8]、NO/cGMP/PKG 信号转导通路[9-10]、巨噬细胞活性抑制[11]、内源性阿片系统等[12]有关,接下来我们将建立炎性痛和病理性神经痛模型,测定行为学和血清学指标,从而对其确切的镇痛机制做进一步的探讨,为临床镇痛应用奠定基础。
此外在本研究中,为了排除蛇毒自身毒副作用对动物的影响[13],我们使用功能观测组合检查方法观察实验动物的表现,发现治疗量的眼镜蛇毒镇痛因子对动物的自发活动、进食无明显影响,未发现异常的体位、活动水平和步态;未发现异常行为如强迫性噬咬、自残、转圈和后退等;未出现痉挛、震颤、流泪、红色泪液、流延、腹泻和嘶咬等表现,说明CVAF的镇痛效应可能与其毒性无关。
[1] Macht DI.Experimental and clinical study of cobra venom as an analgesic[J].Proc Natl Acad Sci U S A,1936,22(1):61-71.
[2] 童富淡,张海花,金苏华.眼镜蛇毒神经毒素和细胞毒素的分离纯化方法:中国,200510060668[P].2006-03-01.
[3] 李 曙,张根葆,洪 云,等.蛇毒PCA改善冠脉微血栓大鼠血液流变学的机制研究[J].中国病理生理杂志,2012,28(4):595-600.
[4] Chen RZ,Robinson SE.The effect of cholinergic manipulations on the analgesic response to cobra toxin in mice[J].Life Sci,1990,47(21):1949-1954.
[5] 吴敏燕,孔天翰,唐 娅,等.舟山眼镜蛇细胞毒素1对K562细胞的抑制作用[J].中国病理生理杂志,2011,27(7):1297-1301.
[6] Smith HS,Elliott JA.Opioid-induced androgen deficiency(OPIAD)[J].Pain Physician,2012,15(3 Suppl):ES145-ES156.
[7] Zhang Y,Zhang L,Wang F,et al.Activation of M3 muscarinic receptors inhibits T-type Ca2+channel currents via pertussis toxin-sensitive novel protein kinase C pathway in small dorsal root ganglion neurons [J].Cell Signal,2011,23(6):1057-1067.
[8] Zhang L,Zhang Y,Jiang D,et al.Alpha-cobratoxin inhibits T-type calcium currents through muscarinic M4 receptor and Go-protein βγ subunits-dependent protein kinase A pathway in dorsal root ganglion neurons[J].Neuropharmacology,2012,62(2):1062-1072.
[9] Maïga A,Mourier G,Quinton L,et al.G protein-coupled receptors,an unexploited animal toxin targets:exploration of green mamba venom for novel drug candidates active against adrenoceptors[J].Toxicon,2012,59(4):487-496.
[10] Lima FO,Souza GR,Verri WA Jr,et al.Direct blockade of inflammatory hypernociception by peripheral A1 adenosine receptors:involvement of the NO/cGMP/PKG/KATP signaling pathway[J].Pain,2010,151(2):506-515.
[11] Nunes FP,Zychar BC,Della-Casa MS,et al.Crotoxin is responsible for the long-lasting anti-inflammatory effect of Crotalus durissus terrificus snake venom:involvement of formyl peptide receptors[J].Toxcoin,2010,55(6):1100-1106.
[12] Picolo G,Giorgi R,Cury Y,et al.δ-Opioid receptors and nitric oxide mediate the analgesic effect of Crotalus durissus terrificus snake venom [J].Eur J Pharmacol,2000,391(1-2):55-62.
[13] 袁伯俊,廖明旭,李 波,等.药物毒理学实验方法与技术[M].第1版.北京:化学工业出版社,2007:464-467.

