p-p38 MAPK在A2AR敲除新生小鼠缺氧缺血脑区的表达及意义*
任素伟, 崔志慧, 黄托夫, 范海玲, 陈江帆, 王小同, 陈 翔△
(1温州医学院附属第二医院康复科,浙江温州325027;2波士顿大学分子神经药理学实验室,美国波士顿02118)
新生儿缺氧缺血性脑病(hypoxic-ischemic encephalopathy)是新生儿期的危重病,有较高的致死率和致残率,往往给家庭和社会造成沉重负担。目前,虽有大量相关研究,但临床上仍缺乏特异性治疗方法。缺氧缺血性脑损伤(hypoxic-ischemic brain damage,HIBD)的发病机制涉及多个环节,细胞凋亡被认为在未成熟脑神经细胞死亡中起主导作用[1-2],而caspase-3在未成熟脑HIBD后皮质及海马区神经细胞凋亡的进程中扮演重要角色[3]。Caspase-3在机体内以无活性的酶原形式存在,当受到缺氧等刺激时,将被激活,执行凋亡程序。细胞凋亡过程涉及多种信号通路的参与,p38 MAPK便是其中之一。作为重要的丝裂原活化蛋白激酶(mitogen-activated protein kinase,MAPK)家族成员,p38 MAPK信号通路激活主要参与不同刺激下的炎症反应、细胞凋亡过程等[4],如缺氧缺血等多种应激刺激可磷酸化 p38 MAPK,继而作为上游因子,诱导凋亡发生[5]。而缺氧缺血后,能量代谢紊乱,ATP大量降解,致使腺苷大量释放,选择性作用于腺苷受体,在已知的4种受体亚型(A1R、A2AR、A2BR和A3R)中,A2AR因其在中枢神经系统内复杂而重要的作用,成为关注热点。Melani等[6]发现选择性A2AR拮抗剂SCH58261可有效减少脑缺血后24 h的梗死面积,这一过程涉及pp38 MAPK的参与。研究表明,A2AR拮抗剂与A2AR基因敲除均在成年鼠局灶性脑缺血损伤中起神经保护作用[7-9];然而A2AR在新生鼠中HIBD的作用尚存争议:A2AR拮抗剂可减轻新生鼠HIBD后的脑损害,Ådén 等[10]却发现 A2AR 基因敲除加重了新生鼠HIBD后脑损伤程度。为此,本实验采用改良Rice法建立新生鼠HIBD模型,以对缺血刺激敏感的皮层及海马CA1区作为研究脑区,探讨 p-p38 MAPK在A2AR敲除新生小鼠HIBD后的表达及意义,旨在明确A2AR敲除对新生小鼠HIBD的作用及相关机制,为临床提供新的治疗靶点。
材料和方法
1 材料
1.1 动物 选择7日龄新生C57/BL6小鼠,雌雄不限,按以下标准筛选入组动物:(1)小鼠体重需在(3.0±0.5)g范围内;(2)平面翻正反射成绩高于正常值2倍或2倍以上的小鼠要剔除。
1.2 主要试剂和仪器 兔抗鼠 p-p38 MAPK(No.BS4766)多克隆抗体购自 Bioworld;anti-activated caspase-3 antibody(ab2302)购自Abcam;PV-6001二步法试剂盒、DAB底物液和苏木素复染剂均购自北京中杉金桥生物技术有限公司;TUNEL检测试剂盒和蛋白酶K均购自Roche;引物购自上海生工生物技术有限公司;TUNEL检测阳性对照制备试剂盒(C1082)和苏木素伊红染液购自江苏碧云天生物技术研究所;Olympus公司BX51光学显微镜拍摄照片;Image-Pro Plus 6.0(IPP 6.0;Media Cybernetics)彩色医学图像分析系统分析图片;自制小鼠缺氧装置。
2 方法
2.1 动物分组 将A2AR敲除(A2AR-/-,KO)及同期野生型(A2AR+/+,WT)C57/BL6新生小鼠分别按照完全随机分组方法分成假手术组(sham-operated,SKO和SWT)和模型组(model,MKO和MWT),模型组按HIBD后取标本时间不同又分为造模后1 d组(MKO1和MWT1)、3 d组(MKO3和 MWT3)和7 d组(MKO7和MWT7),共8个组,每组8只,共64只,进行尼氏染色、TUNEL及免疫组化指标检测。此外,KO及同期WT小鼠分别取假手术组各10只及模型组各30只于HIBD后1 d同时进行新生鼠短期神经行为学评定。
2.2 模型制备 采用改良Rice法建立新生小鼠HIBD模型。7日龄新生小鼠分离左侧颈总动脉,双重结扎,一次性缝合切口,返回母鼠身边喂养休息后,将其放入37℃恒温密闭透明缺氧瓶中,吸入8%O2和92%N2的混合气体1 h。假手术组模拟分离颈总动脉,但不结扎,无缺氧,在模型组HIBD后1 d与其同时进行新生鼠短期神经行为学评定。
2.3 神经行为学观察 (1)缺氧过程全程记录小鼠的体征变化,包括皮肤颜色变化、活动量、有无激惹或嗜睡等。(2)A2AR-/-及A2AR+/+小鼠均随机取假手术组10只及模型组30只,于造模后1 d评定神经反射[11]:a.翻正反射(righting reflex):从小鼠仰卧位置开始计时,到小鼠自行翻身成俯卧位、前后爪放平时计时停止;b.悬崖逃避反射(cliff aversion reflex):将小鼠前爪悬于桌面边缘之外,桌面离地1 m,记录小鼠扭转身体(>90°)离开桌面边缘所用的时间;c.趋地反射(geotaxis reflex):将小鼠头朝下置于倾斜度为40°的木板上,记录小鼠扭转身体(扭转角度>90°)为头朝上时所用的时间。若b和c项反射在20 s内不能完成,所用时间记为20 s。
2.4 PCR鉴定基因型 取0.5~1 cm小鼠尾巴加入240 μL裂解液和10 μL 蛋白酶 K,55 ℃水浴,振荡过夜;加入5 moL/L NaCl溶液盐析;离心后取上清液,加无水乙醇,离心沉淀 DNA;弃去上清,加70%乙醇混匀后离心;弃上清干燥,加1×TE溶解DNA,即可用作PCR反应模板。设计扩增片段长度分别为180 bp和330 bp的特异DNA序列作为引物,结果为180 bp的条带代表野生型;结果为2条分别为180 bp和330 bp的条带代表杂合型;结果为330 bp的条带代表敲除型。扩增片段长度为180 bp:正义链5'-AGC CAG GGG TTA CAT CTG TG-3',反义链 5'-TAC AGA CAG CCT CGA CAT GTG-3';扩增片段长度为330 bp:正义链5'-TCG GCC ATT GAA CAA GAT GG-3',反义链 5'-GAG CAA GGT GAG ATG AGA GG-3'。采用2%琼脂糖凝胶电泳,电压120 V,电泳30 min后凝胶成像系统观察PCR反应结果。
2.5 切片制备 每组小鼠至相应时点(假手术组同造模后1 d组同时取材),以10%水合氯醛麻醉后常规灌注、取脑,去除嗅球、小脑和脑干,多聚甲醛固定、脱水、石蜡包埋。于视交叉前缘行冠状位切片,片厚约4 μm,用于进行尼氏染色、TUNEL及免疫组化。
2.6 尼氏染色、TUNEL检测神经细胞凋亡 每只动物随机取切片5张,常规脱蜡水化,分别按照尼氏染液及TUNEL试剂盒所示步骤进行操作,封片后,在统一放大倍数(10×40)下,对海马CA1区和大脑矢状旁区皮质分别随机选取5个阳性视野,对每高倍视野内阳性细胞进行计数。
2.7 免疫组织化学法观察活化caspase-3和p-p38 MAPK的表达 每只动物随机取切片5张,采用免疫组化二步法检测活化caspase-3和p-p38 MAPK的表达。封片后,在统一放大倍数(10×40)下,对海马CA1区和大脑矢状旁区皮质分别随机选取5个阳性视野,用IPP 6.0分析软件行图像分析,测定吸光度(A)。
3 统计学处理
数据以均数±标准差(mean±SD)表示,并进行正态性检验,应用SPSS 16.0统计软件分析,多个样本间均数的比较用单因素方差分析,两连续型变量间的相关性采用Pearson线性相关分析,以P<0.05为差异有统计学意义。
结 果
1 神经行为学观察
1.1 缺氧过程的症状 缺氧10 min,动物开始烦躁不安;缺氧15~20 min,动物出现呼吸加深、加快,口周发绀;缺氧30 min,大部分动物开始站立不稳,偶有激惹现象;缺氧40~50 min,大部分动物活动明显减少、发绀明显;缺氧1 h,几乎所有小鼠出现不能翻身、嗜睡现象。
1.2 新生小鼠短期神经行为学评定 模型组小鼠完成翻正反射、悬崖逃避反射和趋地反射的时间都明显长于假手术组小鼠(P<0.01),MKO组较MWT组各反射完成的时间均稍长(翻正反射:P<0.01;趋地反射:P <0.01;悬崖逃避反射:P <0.05),见表1。

表1 A2AR敲除对新生小鼠HIBD后短期神经行为学的影响Table 1.The effect of A2AR knockout on the changes of early neurological behavior in neonatal mice after hypoxic-ischemic brain damage(mean±SD.n=10)
2 基因型鉴定
A2AR+/+:出现180 bp的条带,为野生型;A2AR+/-:出现2条分别为180 bp和330 bp的条带,为杂合型;A2AR-/-:出现330 bp的条带,为敲除型,见图1。
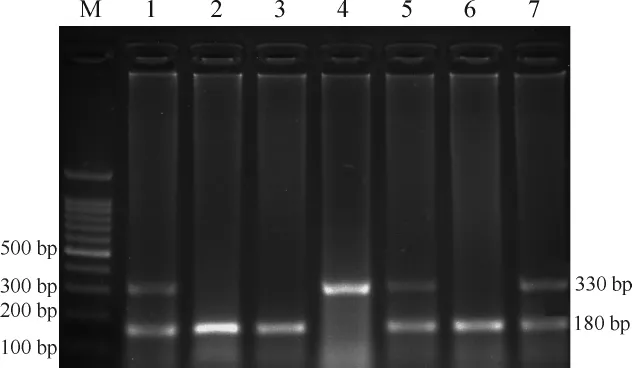
Figure 1.The result of genotype identification.M:marker;1:A2AR+/-;2:A2AR+/+;3:A2AR+/+;4:A2AR-/-;5:A2A R+/-;6:A2AR+/+;7:A2AR+/-.图1 基因型鉴定结果
3 尼氏小体定量分析结果
假手术组皮层、海马CA1区可见较多深蓝色尼氏小体,SKO组与SWT组比较差异无统计学意义。HIBD后尼氏小体数目明显减少,同基因型各时点比较均有显著差异(P<0.01),其中,又以HIBD后1 d组减少最为明显。HIBD后同一时点,KO小鼠皮层和海马CA1区尼氏小体均较WT小鼠显著减少(P<0.01),见图2、表2。
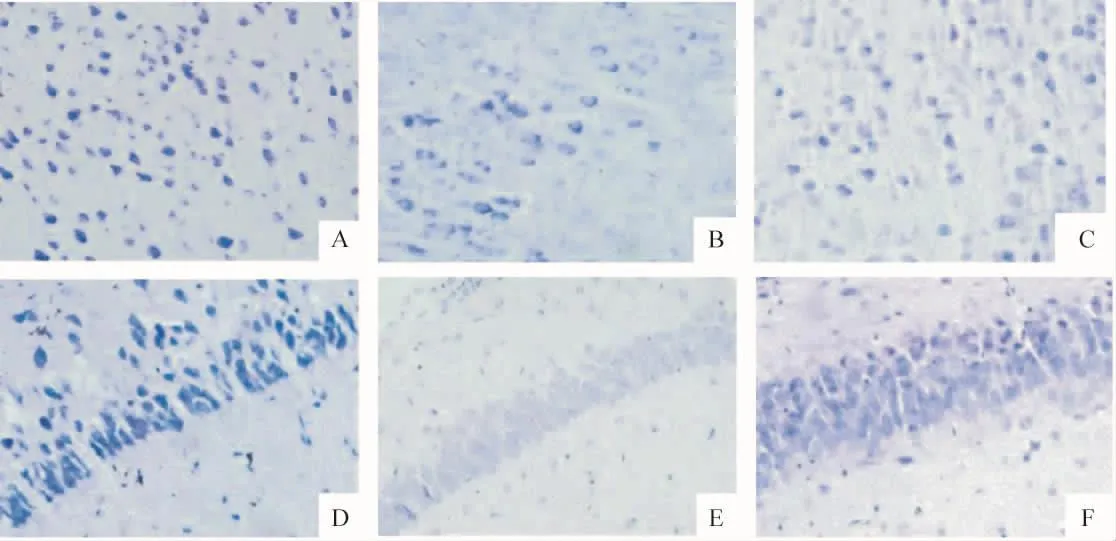
Figure 2.Nissl staining in the cortex and hippocampal CA1 region in neonatal mice after hypoxic-ischemic brain damage(×400).A:the cortex of SKO;B:the cortex of MKO1;C:the cortex of MWT1;D:the hippocampal CA1 region of SKO;E:the hippocampal CA1 region of MKO1;F:the hippocampal CA1 region of MWT1.图2 新生小鼠缺氧缺血侧皮层及海马CA1区尼氏染色结果
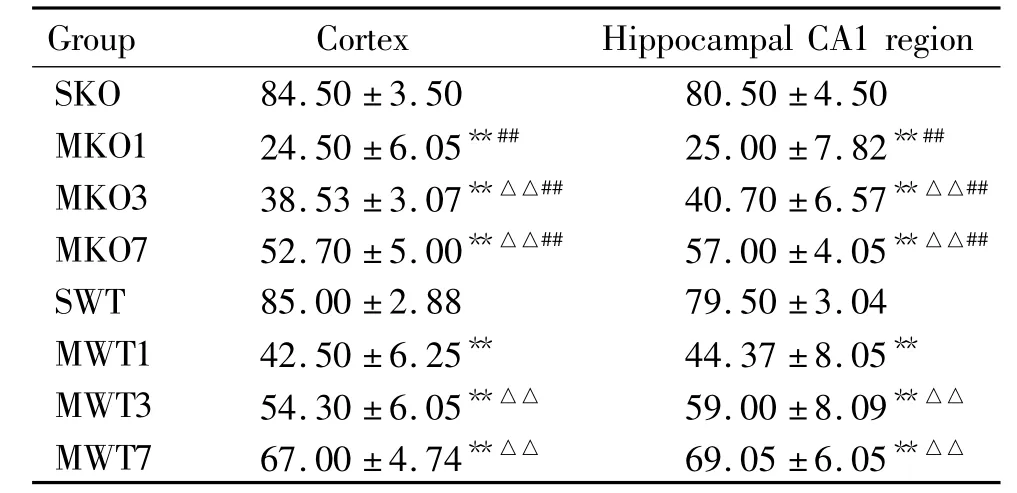
表2 新生小鼠缺氧缺血侧皮层及海马CA1区尼氏小体定量分析Table 2.Number of Nissl body in the cortex and hippocampal CA1 region in neonatal mice after hypoxic-ischemic brain damage(mean±SD.n=8)
4 TUNEL检测细胞凋亡结果
假手术组皮层和海马CA1区均偶可见极少量TUNEL阳性细胞表达,SKO组与SWT组比较,差异无统计学意义。HIBD后,缺氧缺血侧皮层和海马CA1区TUNEL阳性细胞表达均显著增加,1 d后达高峰,至7 d相比假手术组仍有显著差异(P<0.01),同基因型模型组各时点间比较均有显著差异(P<0.01),HIBD后同一时点,KO小鼠缺氧缺血侧皮层和海马CA1区TUNEL阳性细胞的表达均较WT小鼠显著增加(P <0.01),见图3、表3。
5 缺氧缺血侧皮层和海马CA1区活化caspase-3及p-p38 MAPK的表达

Figure 3.Apoptosis of the neurons in the cortex and hippocampal CA1 region in neonatal mice after hypoxic-ischemic brain damage detected by TUNEL assay(×400).A:the cortex of SKO;B:the cortex of MKO1;C:the cortex of MWT1;D:the hippocampal CA1 region of SKO;E:the hippocampal CA1 region of MKO1;F:the hippocampal CA1 region of MWT1.图3 TUNEL技术检测皮层及海马CA1区神经元凋亡

表3 新生小鼠缺氧缺血侧皮层及海马CA1区凋亡神经元的数目Table 3.Number of apoptotic neurons in the cortex and hippocampal CA1 region in neonatal mice after hypoxic-ischemic brain damage(mean±SD.n=8)
假手术组皮层和海马CA1区均偶可见极少量活化caspase-3及p-p38 MAPK表达,SKO组与SWT组比较,差异无统计学意义。HIBD后,缺氧缺血侧皮层和海马CA1区活化caspase-3及p-p38 MAPK的表达迅速增加,1 d后为高峰,之后逐渐降低,至7 d时相比对照组仍有显著差异(P<0.01),同基因型模型组各时点间比较,差异均显著(P<0.01)。HIBD后同一时点,小鼠缺氧缺血侧皮层和海马CA1区活化caspase-3的表达均较WT小鼠显著增加(P<0.01)。HIBD后同一时点,KO小鼠p-p38 MAPK表达均多于WT小鼠,其中HIBD后1 d、3 d两种基因型间均有显著差异(P <0.01),见图4、5 和表4。
6 活化caspase-3表达与p-p38 MAPK表达的相关性分析
各组小鼠皮层和海马CA1区活化caspase-3表达与p-p38 MAPK表达均呈显著正相关(皮层:r=0.957,P <0.01;海马 CA1 区:r=0.939,P <0.01)。

Figure 4.The expression of activated caspase-3 in the cortex and hippocampal CA1 region in neonatal mice after hypoxic-ischemic brain damage(×400).A:the cortex of SKO;B:the cortex of MKO1;C:the cortex of MWT1;D:the hippocampal CA1 region of SKO;E:the hippocampal CA1 region of MKO1;F:the hippocampal CA1 region of MWT1.图4 新生小鼠缺氧缺血侧皮层及海马CA1区活化caspase-3的表达

Figure 5.The expression of p-p38 MAPK in the cortex and hippocampal CA1 region in neonatal mice after hypoxic-ischemic brain damage(×400).A:the cortex of SKO;B:the cortex of MKO1;C:the cortex of MWT1;D:the hippocampal CA1 region of SKO;E:the hippocampal CA1 region of MKO1;F:the hippocampal CA1 region of MWT1.图5 新生小鼠缺氧缺血侧皮层及海马CA1区p-p38 MAPK的表达

表4 新生小鼠缺氧缺血侧皮层及海马CA1区活化caspase-3及p-p38 MAPK的表达Table 4.The expression of activated caspase-3 and p-p38 MAPK in the cortex and hippocampal CA1 region in neonatal mice after hypoxic-ischemic brain damage(mean±SD.n=8)
讨 论
缺氧缺血是新生儿脑损伤的常见原因,目前临床上尚无特效治疗方法,而其高致死率和致残率又决定了寻求新的治疗策略具有重要的临床意义。新生鼠脑组织发育不成熟,对缺氧缺血刺激的病理改变与成年鼠不尽相同,caspase-3在未成熟脑HIBD后神经细胞凋亡中扮演重要角色,而p38 MAPK磷酸化后可作为上游因子通过多种途径介导细胞凋亡。研究证实缺氧缺血后,p38 MAPK的抑制剂SB203580可以阻断Bax从胞质向线粒体的转移,减轻脑损害[12-13],提示p38 MAPK可能间接通过线粒体途径导致神经细胞凋亡。
A2AR作为腺苷4种受体亚型之一,在新生鼠HIBD中的作用尚存争议。我们的实验结论证实,A2AR敲除可加重新生鼠HIBD后的脑损害,影响其短期神经行为学,加速尼氏小体溶解或消失,增加皮层及海马CA1区的神经细胞凋亡。这一过程,伴随p-p38 MAPK及活化caspase-3表达的增加,且二者表达呈显著正相关。提示A2AR敲除可能通过磷酸化p38 MAPK,进而活化caspase-3,导致神经细胞凋亡。但HIBD后,仅在1 d、3 d这2个时点,2种基因型间pp38 MAPK的表达有显著差异,提示A2AR敲除通过磷酸化p38 MAPK影响神经细胞凋亡可能主要发生在脑缺氧缺血早期,这也提示通过A2AR相关制剂干预p38 MAPK在未成熟脑HIBD神经元凋亡中的作用应在HIBD早期进行,把握治疗时机对减轻脑损伤具有重要意义。
同时,我们的实验表明,尽管脑缺氧缺血后7 d,2种基因型间p-p38 MAPK的表达已没有统计学差异,但二者的神经元凋亡数目仍存在显著差异,提示除外p38 MAPK,A2AR敲除可能也通过激活其它路径上的蛋白加重脑损害。其中,JNK[14]、p53,NF-κB 等[15]因其在细胞凋亡中的重要作用,参与此过程中的可能性相对更大。继续探讨其它相关蛋白的表达,对深入阐明A2AR敲除加重新生鼠HIBD脑损伤的作用机制,具有重要意义。
我们的实验结论与A2AR敲除在成年鼠缺血损伤中的作用相矛盾,这可能与新生鼠脑组织发育不成熟有关。A2AR完全缺失可能导致新生鼠HIBD后突触前谷氨酸等兴奋性递质的过度释放,进而激活了p38 MAPK;而A2AR可影响IL-1、TNF-α等炎症因子的表达,炎症因子亦可作为上游因子激活MAPK家族成员[16],因此,A2AR敲除也可能通过增加炎症因子的表达导致p38 MAPK磷酸化增多。实验证实p-p38 MAPK下游可通过诱导Bax易位激活线粒体内源性途径和通过增加c-Fos启动外源性凋亡路径,这均可能是A2AR敲除导致新生鼠HIBD后p38 MAPK参与的凋亡通路。
我们的实验首次证实了p-p38 MAPK在A2AR敲除新生小鼠缺氧缺血脑皮层及海马CA1区呈高表达,且与活化caspase-3表达呈显著正相关,提示p-p38 MAPK可能参与了A2AR敲除增加神经细胞凋亡的过程,且以HIBD早期为著。但这一路径的中间过程仍有待深究,A2AR激活p38 MAPK的具体机制及p38 MAPK如何通过下游因子最终激活了caspase-3,仍需进一步阐述,从而为围产期HIBD的临床治疗提供实验依据。
[1] Gill MB,Perez-Polo JR.Hypoxia ischemia-mediated cell death in neonatal rat[J].Neurochem Res,2008,33(12):2379-2389.
[2] 陈敏榕,陈燕惠.缺氧缺血性脑损伤与凋亡的进展[J].中国病理生理杂志,2004,20(7):1318-1321.
[3] 贾瑞喆,蒋 犁,乔立兴,等.新生鼠缺氧缺血时天冬氨酸半胱氨酸蛋白酶-3表达的研究[J].中国病理生理杂志,2005,21(4):665-668.
[4] 张秀娥,成 蓓,彭 雯,等.p38MAPK信号通路在钙调磷酸酶促心肌凋亡中的作用[J].中国病理生理杂志,2008,24(2):266-269.
[5] Guo G,Bhat NR.p38α MAP kinase mediates hypoxia-induced motor neuron cell death:a potential target of minocycline's neuroprotective action[J].Neurochem Res,2007,32(12):2160-2166.
[6] Melani A,Gianfriddo M,Vannucchi MG,et al.The selective A2Areceptor antagonist SCH58261 protects from neurological deficit,brain damage and activation of p38MAPK in rat focal cerebral ischemia[J].Brain Res,2006,1073-1074:470-480.
[7] Chen JF,Huang Z,Ma J,et al.A2Aadenosine receptor deficiency attenuates brain injury induced by transient focal ischemia in mice[J].J Neurosci,1999,19(21):9192-9200.
[8] Chen JF,Pedata F.Modulation of ischemic brain injury and neuroinflammation by adenosine A2Areceptors[J].Curt Pharm Des,2008,14(15):1490-1499.
[9] Trincavelli ML,Melani A,Guidi S,et al.Regulation of A2Aadenosine receptor expression and functioning following permanent focal ischemia in rat brain[J].J Neurochem,2008,104(2):479-490.
[10] Ådén U,Halldner L,Lagercrantz H,et al.Aggravated brain damage after hypoxic ischemia in immature adenosine A2Aknockout mice[J].Stroke,2003,34(3):739-744.
[11] Bouslama M,Renaud J,Olivier P,et al.Melatonin prevents learning disorders in brain-lesion newborn mice[J].Neuroscience,2007,150(3):712-719.
[12] Ghatan S,Larner S,Kinoshita Y,et al.p38 MAP kinase mediates Bax translocation in nitric oxide-induced apoptosis in neurons[J].J Cell Biol,2000,150(2):335-347.
[13] Piao CS,Kim JB,Han PL,et al.Administration of the p38 MAPK inhibitor SB203580 affords brain protection with a wide therapeutic window against focal ischemic insult[J].J Neurosci Res,2003,73(4):537-544.
[14] 李 欣,魏红艳,胡春林,等.SAPK/JNK信号通路在脑梗死后神经元凋亡中的作用[J].中国病理生理杂志,2011,27(08):1552-1556.
[15] Nijboer CH,Heijnen CJ,Groenendaal F,et al.A dual role of the NF-κB pathway in neonatal hypoxic-ischemic brain damage[J].Stroke,2008,39(9):2578-2586.
[16] Wang XJ,Kong KM,Qi WL,et al.Interleukin-1 beta induction of neuron apoptosis depends on p38 miftogen-activated protein kinase activity after spinal cord injury[J].Acta Pharmacol Sin,2005,26(8):934-942.

