骨髓间充质干细胞通过上调EPO表达减轻缺氧损伤引起的PC12细胞凋亡*
莫世静, 童秀珍, 钟 茜, 邓宇斌,4△
(1中山大学中山医学院病理生理学教研室,广东广州510089;2中山大学附属第一医院血液科,广东广州510080;3中山大学肿瘤防治中心实验研究部,广东广州510060;4中山大学附属第一医院转化医学中心实验室,广东广州510080)
骨髓间充质干细胞(bone marrow mesenchymal stem cells,BM-MSCs)是一类存在于骨髓间质内的非造血干细胞,近年来已被广泛应用于缺血性脑卒中、脊髓损伤和缺血缺氧性神经细胞的治疗及修复。大量研究表明,移植的BM-MSCs能迁移至损伤局部微环境并分化为神经元样细胞或通过分泌各种营养因子等改善神经功能从而促进损伤修复[1-2]。然而,BM-MSCs究竟通过何种机制促进神经功能修复这一问题尚有争议,明确BM-MSCs的细胞保护作用机制能更加有利于BM-MSCs的移植治疗研究。促红细胞生成素(erythropoietin,EPO)是由肾小管细胞合成分泌的细胞因子超家族成员。EPO及其受体EPOR在红细胞、肝脏、肾脏和神经元等多种组织中广泛表达。本实验在前期研究的基础上,为了更好地阐明移植BM-MSCs对神经细胞的保护作用及机制,为BM-MSCs的进一步应用提供实验依据,应用体外氯化钴(CoCl2)缺氧损伤的细胞共培养模型,RT-PCR检测PC12细胞的Bcl-2和Bax表达,流式细胞术检测PC12细胞凋亡,Western blotting检测BM-MSCs的EPO表达,探讨BM-MSCs对CoCl2诱导的神经元样PC12细胞凋亡的保护作用及其可能机制。
材料和方法
1 材料和主要试剂
SPF级SD大鼠,80 g,购自中山大学实验动物中心,DMEM/F12和DMEM高糖培养基购自Gibco,胎牛血清(fetal bovine serum,FBS)购自Gibco,羊抗大鼠抗EPO购自R﹠D System。Hoechst 33258购于Sigma。PC12细胞购自美国模式培养物保藏所(A-merican Type Culture Collection,ATCC),Control siRNA及EPO siRNA购自Santa Cruz。
2 主要方法
2.1 大鼠BM-MSCs的分离和培养 大鼠断颈处死,75%乙醇浸泡5 min,无菌条件下取双侧股骨,彻底清除附着其上的肌肉组织,剪断干骺端暴露骨髓腔,DMEM/F12培养液反复冲洗骨髓腔至骨髓腔变白,制成单细胞悬液,1 000 r/min离心5 min,弃上清,加人含有10%胎牛血清的DMEM/F12培养液重悬细胞种植于25 cm2培养瓶中,37℃、5%CO2、饱和湿度下培养,3 d后更换培养液,去除未贴壁细胞,以后每3 d换液1次,按1∶2传代,取第5代BM-MSCs备用。
2.2 PC12细胞培养及分组 PC12细胞置于含10%的胎牛血清的DMEM高糖培养液中,37℃、5%CO2的饱和湿度下培养,细胞汇集至80%时进行传代接种后,将培养的细胞分别加入0.1、0.2、0.4、0.6、0.8 mmol/L CoCl2处理24 h或48 h,同时采用1∶50、1∶20、1∶15、1∶10 和 1∶5 细胞比的 BM-MSCs 与PC12细胞共培养。此外,将PC12细胞分为以下几组:BM-MSCs-siCTL共培养+CoCl2处理24 h组和BM-MSCs-siEPO共培养 +CoCl2处理24 h组,每组各设空白对照组和CoCl2单独处理24 h组。
2.3 MTT检测 将PC12细胞以4×104接种于96孔板,50 μL/well。在37 ℃、5%CO2条件下常规培养过夜后,按实验要求给予不同处理,处理完毕后,每孔加5 g/L MTT 20 μL,继续培养 4 h,吸出培养液,加150 μL DMSO,待其完全溶解后,用酶联免疫仪在波长490 nm处读取吸光度(A)。存活率(%)=(实验孔A值/对照孔A值)×100%。
2.4 Western blotting检测EPO蛋白表达 BM-MSCs接种于6孔板,给予0.6 mmol/L CoCl2分别处理24和48 h,处理完毕后,加入细胞裂解液,4℃裂解30 min,取蛋白液,采用BCA法进行蛋白定量。总蛋白经SDS-PAGE分离后,转移到NC膜上。用5%BSA封闭1 h,随后加入羊抗大鼠EPO抗体(1∶1 000),4℃过夜,用TBST洗3次,每次10 min。ECL法显色,用凝胶成像系统扫描分析结果。
2.5 流式细胞术检测细胞凋亡 收集处理后的PC12细胞至2 mL的离心管中,1 000 r/min离心5 min,弃去培养液。用PBS缓冲溶液洗涤1次,1 000 r/min离心5 min,用 loading buffer重悬细胞,加入Annexin V反应液室温下避光孵育10~15 min。流式细胞术(flow cytometry,FCM)分析凋亡情况。结果判断:在双变量流式细胞仪的散点图上,左下象限显示活细胞,为FITC-/PI-;右上象限是非活细胞,即坏死细胞,为FITC+/PI+;而右下象限为凋亡细胞,显现 FITC+/PI-。
2.6 Hoechst 33258染色 将 PC12细胞 (4×104cells/well)接种于6孔板,4%多聚甲醛固定细胞15 min,PBS洗3次,5 mg/L Hoechst 33258染色液染色15 min,室温下PBS洗3次,荧光显微镜观察细胞凋亡情况。细胞核出现弥漫均匀的低强度荧光记为正常细胞;细胞核呈浓染致密的固缩形态或者颗粒状荧光记为凋亡细胞。
2.7 RT-PCR检测 分别于处理前和处理后24 h用RT-PCR法检测。用0.6 mmol/L CoCl2及1∶15细胞比的BM-MSCs-siCTL或BM-MSCs-siEPO共培养处理PC12细胞,提取 PC12细胞总 RNA,测 A值计算RNA的纯度。逆转录后,取cDNA做PCR,引物设计如下:β-actin上游引物5'-GAACCCTAAGGCCAAC-3',下游引物 5'-TGTCACGCACGATTTCC-3',扩增片段305 bp。EPO上游引物5'-ATTTGCGACAGTCGCGTTCT-3',下 游 引 物 5'-GTATCCGCTTGAAGTGTTCG-3',扩增片段307 bp。Bcl-2上游引物5'-CGACTTTGCAGAGATGTCCA-3',下游引物 5'-ATGCCGGTTCAGGTACTCAG-3',扩增片段224 bp。Bax上游引物5'-AGACAGGGGCCTTTTTGTTAC-3',下游引物 5'-GAGGACTCCAGCCACAAAGAT-3',扩 增 片 段 482 bp。PCR反应条件为预变性94℃ 5 min,94℃ 30 s,60℃ 30 s,72 ℃ 1 min,最后72 ℃ 10 min。以 β-actin为内参照,30个循环,EPO、Bcl-2和Bax扩35个循环。产物琼脂糖凝胶电泳,EB染色,凝胶成像仪及Bio-ID软件进行图像和条带灰度值分析。
2.8 分光光度法检测caspase-9和-3活性 按不同条件处理PC12细胞,用胰酶消化,并收集至备用的细胞培养液中。600 r/min 4℃离心5 min收集细胞,小心吸除上清,同时确保尽量没有细胞被吸除,PBS洗涤1次。同前吸尽上清后,加入100 μL裂解液,重悬沉淀,冰浴裂解15 min。加入Ac-DEVD-pNA(2 mmol/L)后混匀,注意避免在混匀时产生气泡。37℃孵育60~120 min。发现颜色变化比较明显时可测定吸光度值。
3 统计学处理
数据采用SPSS 11.0统计软件进行分析。数据以均数 ±标准差(mean±SD)表示。组间比较行方差分析(ANOVA),以P<0.05为差异有统计学意义。
结 果
1 BM-MSCs共培养对CoCl2引起的PC12细胞活性下降的影响
0.1 、0.2、0.4、0.6 和 0.8 mmol/L CoCl2处理PC12细胞24 h和48 h,细胞活性分别为 (93.8±3.4)%、(91.7±3.1)%、(83.8±2.5)%,(44.0±7.5)%、(32.2±5.9)%和(90.0±4.0)%、(84.3±1.6)%、(68.7±2.9)%、(32.7±1.9)%、(25.4±0.9)%,见图1A。同时,0.6 mmol/L CoCl2处理24 h和48 h后,PC12细胞活性下降为 (43.0±6.4)%和(33.8±5.7)%,而BM-MSCs共培养使细胞活性分别上升至 (49.4±6.8)%、(63.5±6.2)%、(77.9±3.8)%、(69.2±4.1)%、(67.1±6.0)%和(43.5±1.4)%、(61.3±4.3)%、(75.2±9.7)%、(65.7±10.7)%、(64.7±10.2)%,其中1∶15细胞比的效果最明显,见图1B。上述结果表明:0.6 mmol/L CoCl2处理24 h和48 h明显降低PC12细胞活性(P<0.01),而BM-MSCs共培养可明显抑制CoCl2引起的PC12细胞活性下降,差异有统计学意义(P<0.01)。
2 EPO siRNA对BM-MSCs EPO表达的影响
如图2所示,BM-MSCs经0.6 mmol/L CoCl2刺激24 h后,EPO mRNA与蛋白表达水平明显上升,于48 h到达最高,与对照组相比,差异有统计学意义(P<0.01)。而EPO siRNA转染可明显抑制CoCl2引起的BM-MSCs EPO mRNA与蛋白表达(P<0.01)。
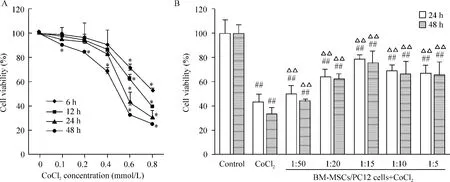
Figure 1.Effect of BM-MSCs on decreased viability of PC12 cells induced by CoCl2.A:PC12 cells were treated with CoCl2(0.1,0.2,0.4,0.6 and 0.8 mmol/L)for 6,12,24 and 48 h,and cell viability was assessed using MTT assay;B:the viability of PC12 cells co-cultured with BM-MSCs(BM-MSCs:PC12 cells=1∶50,1∶20,1∶15,1∶10 and 1∶5)and treated with CoCl2(0.6 mmol/L)was assessed 24 and 48 h later.Mean ± SD.n=3.*P <0.05 vs 0 mmol/L;##P <0.01 vs control;△△P <0.01 vs CoCl2.图1 BM-MSCs对CoCl2诱导的PC12细胞活性下降的影响
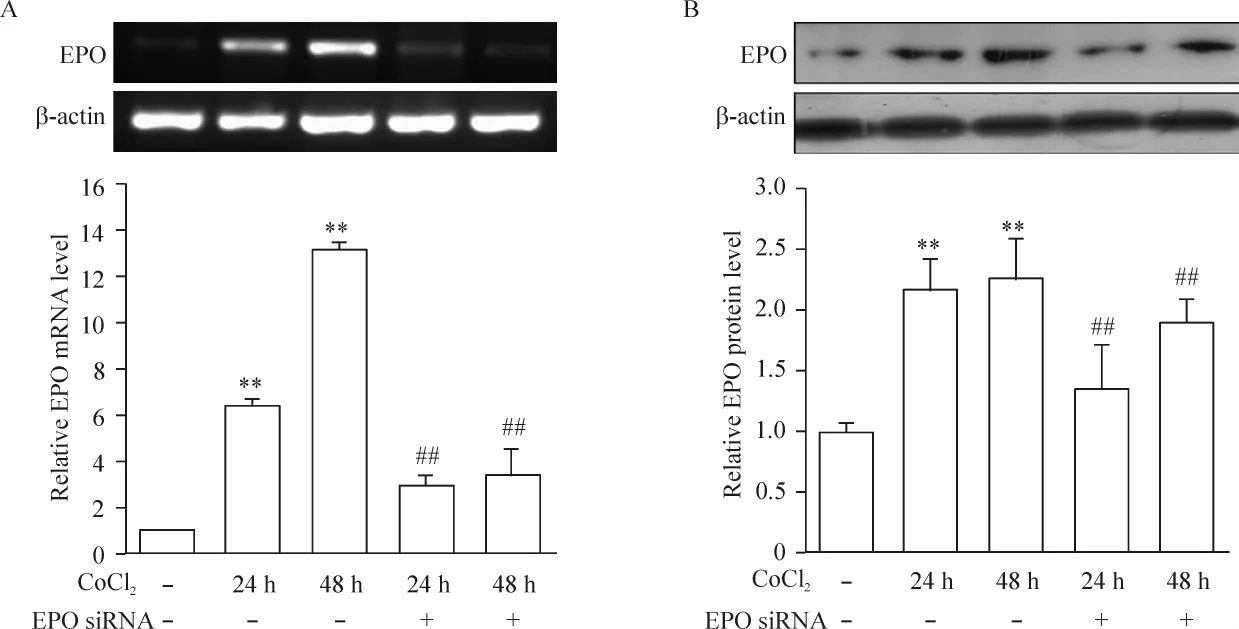
Figure 2.Effect of EPO siRNA on mRNA(A)and protein(B)expression of EPO in BM-MSCs treated with 0.6 mmol/L CoCl2for 24 and 48 h.Mean ± SD.n=3.**P <0.01 vs control(without treatment);##P <0.01 vs CoCl2at the same time point.图2EPO siRNA对BM-MSCs EPO表达的影响
3 EPO siRNA对BM-MSCs介导的PC12细胞保护作用的影响
Annexin V/PI双染色法显示24 h对照组PC12细胞早期凋亡率和晚期凋亡率分为(1.2±0.5)%和(2.2±0.4)%;0.6 mmol/L CoCl2处理PC12细胞24 h,凋亡率增加到(26.7±4.5)%和(34.6±5.7)%(P<0.01)。BM-MSCs-siCTL共培养可以减少CoCl2引起的细胞凋亡,使细胞凋亡率降低至(6.1±0.8)%和(14.5±1.1)%,而EPO siRNA可明显抑制BM-MSCs引起的细胞凋亡下降作用,细胞凋亡率由(18.8±1.8)%和(32.4±3.3)%仅降低至(13.3±1.5)%和(25.9±4.9)%(P<0.01),见图3。Hoechst 33258荧光染色显示正常组PC12细胞染色质分布均匀,为弥漫均匀的低强度荧光;CoCl2处理组细胞核呈浓缩致密的固缩形态或颗粒状荧光;BMMSCs-siCTL共培养组凋亡细胞较阳性对照组明显减少,而BM-MSCs-siEPO共培养组细胞核呈浓缩致密的固缩形态或颗粒状荧光的细胞明显增多(P<0.01),见图4。上述结果提示:BM-MSCs能有效抑制CoCl2的致细胞凋亡作用,BM-MSCs的抗凋亡作用可能与其上调EPO的表达有关。
4 Bcl-2和Bax的表达
PC12细胞经0.6 mmol/L CoCl2处理24 h,可观察到Bcl-2的表达下降和Bax的表达上升,与对照组相比,差异有统计学意义(P<0.01)。BM-MSCs共培养可以有效抑制CoCl2引起的Bcl-2表达下降和Bax表达上升(P<0.01)。BM-MSCs对PC12细胞基础的Bcl-2和Bax表达无明显影响(P>0.05)。EPO siRNA的应用则可以明显阻断BM-MSCs的作用(P<0.01),见图5。上述结果提示:BM-MSCs介导的细胞保护作用可能与其上调PC12细胞的Bcl-2表达和下调Bax表达有关。

Figure 3.Effect of EPO siRNA on the apoptosis of PC12 cells co-cultured with BM-MSCs detected by flow cytometry.PC12 cells were co-cultured with BM-MSCs-siCTL or BM-MSCs-siEPO at a ratio of 1∶15 and treated with CoCl2(0.6 mmol/L)for 24 h.Mean ± SD.n=3.**P <0.01 vs control;##P <0.01 vs CoCl2;△△P <0.01 vs CoCl2+BM-MSCs-siCTL.图3 流式细胞术检测EPO siRNA对与BM-MSCs共培养的PC12细胞凋亡的影响
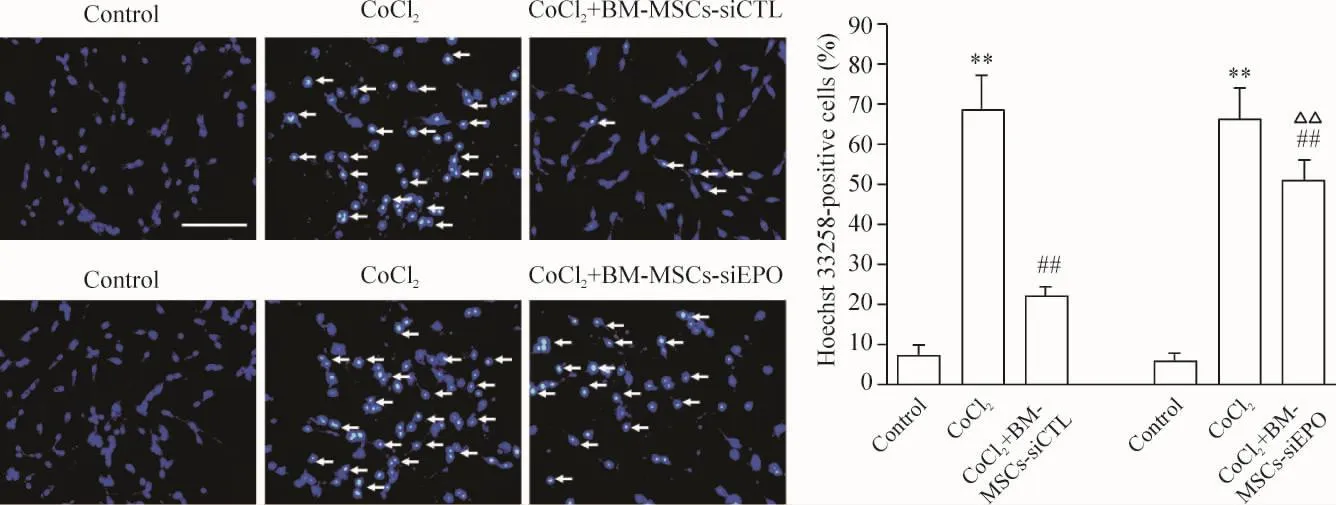
Figure 4.Representative photographs and quantitative analysis of apoptotic PC12 cells determined by Hoechst 33258 staining.Arrows indicate the apoptotic cells.Scale bar=50 μm.Mean ±SD.n=3.**P <0.01 vs control;##P <0.01 vs CoCl2;△△P <0.01 vs CoCl2+BM-MSCs-siCTL.图4 Hoechst 33258染色检测PC12细胞凋亡形态

Figure 5.Effects of BM-MSCs and EPO siRNA on the mRNA expression of Bcl-2(A)and Bax(B)in PC12 cells assessed by RT-PCR.PC12 cells were co-cultured with BM-MSCs,BM-MSCs-siCTL and BM-MSCs-siEPO in the presence of CoCl2(0.6 mmol/L)for 24 h.Mean ±SD.n=3.**P <0.01 vs control;##P <0.01 vs CoCl2;△△P <0.01 vs BM-MSCs+CoCl2.图5 BM-MSCs和EPO siRNA对PC12细胞Bcl-2及Bax表达的影响
5 Caspase-9和caspase-3的活性
PC12 细胞经0.6 mmol/L CoCl2处理 24 h,可观察到caspase-9和caspase-3的活性明显增强,与对照组相比,差异有统计学意义(P<0.01)。BM-MSCssiCTL共培养可以有效抑制CoCl2引起的caspase-9和caspase-3的活性增加(P<0.01)。EPO siRNA明显阻断BM-MSCs介导的caspase-9和caspase-3的活性下降(P<0.01),见图6。这一结果表明:BMMSCs介导的细胞保护作用可能与其下调PC12细胞caspase-9和caspase-3的活性有关。

Figure 6.Effects of BM-MSCs and EPO siRNA on the activity of caspase-9(A)and caspase-3(B)in PC12 cells assessed by fluorometric assay kits.PC12 cells were co-cultured with BM-MSCs-siCTL and BM-MSCs-siEPO in the presence of CoCl2(0.6 mmol/L)for 24 h.Mean± SD.n=3.**P <0.01 vs control;##P <0.01 vs CoCl2;△△P < 0.01 vs CoCl2+BM-MSCssiCTL.图6 BM-MSCs和EPO siRNA对PC12细胞caspase-9和caspase-3活性的影响
讨 论
缺血性脑卒中是一种病情严重、预后不良的神经系统损伤,也是一个复杂的病理生理过程,包括连续发生的原发性脑损伤和继发性脑损伤[3]。原发性脑损伤是缺血缺氧后当时被动发生的损伤,主要包括损伤局部神经元、胶质细胞及血管等支持结构的破坏;随后发生的是长达数日或数周的继发性损伤,继发性脑损伤的病理生理过程包括激活多个化学通路如缺血、缺氧、自由基产生、凋亡、变性受体上调及炎症级联反应,从而导致在原发性损伤中幸存的损伤区周围的各类细胞大量死亡,产生比原发损伤更严重的影响[3]。大量实验证实继发性脑损伤是引起大脑功能丧失的主要原因。因此,恢复缺血脑组织的供血供氧,促进神经功能修复成为缺血性脑卒中治疗的首要目标。
BM-MSCs作为一种获取方便,扩增容易,遗传背景稳定,免疫原性低的成体干细胞,已被广泛应用于移植治疗缺血性脑卒中[4]。大量研究表明BM-MSCs可迁移至脑损伤局部区域并通过其旁分泌机制增加某些神经营养因子如血管内皮生长因子(vascular endothelial growth factor,VEGF)、脑源性神经营养因子(brain-derived neurotrophic factor,BDNF)等的浓度,促进缺血性脑卒中的神经功能修复[5]。此外,EPO作为一种造血生长因子,不仅在多种细胞中广泛表达,而且广泛参与促红细胞生成、细胞扩增、血管形成,抗炎及抗凋亡过程[6-11]。生理情况下,EPO含量维持稳定,当受到缺氧性刺激时,EPO表达增加。调控EPO表达的主要元件为缺氧诱导因子(hypoxia-inducible factors,HIF)。当受到内外源性缺氧信号刺激时,HIF-1α脱离降解,激活EPO基因的缺氧反应元件(hypoxia responsive element,HRE),从而增强EPO的表达[12]。EPO的主要生理功能是促进红系祖细胞分裂、分化为成熟红细胞,以增加循环中红细胞数量。近年来有研究表明EPO可通过与其受体EPOR结合激活下游Janus激酶2(Janus kinas 2,JAK2)、信号转导和转录活化蛋白3(signal transducer and activator of transcription 3,STAT3)、磷脂酰肌醇3激酶 (phosphatidylinositol 3 kinase,PI3K)/蛋白激酶B(protein kinase B,PKB)、核因子κB(nuclear factor κB,NF-κB)等信号通路抑制神经元凋亡[13]。Wu等[14]的研究更是表明EPO具有明显抑制PC12细胞凋亡的作用。PC12细胞作为大鼠肾上腺嗜铬细胞瘤细胞株,具有合成、代谢及运输神经递质等特性,已被长期用作模拟神经系统损伤疾病的体外模型[15]。
细胞凋亡过程中,多个信号转导通路及转录因子被激活。其中Bcl-2家族成员被认为是调节线粒体外膜(mitochondrial outer membrane,MOM)通透性的关键因子,MOM可通过激活下游caspase-9并最终活化凋亡执行者 caspase-3,从而诱发细胞凋亡[16]。Bcl-2家族成员分为2类,一类具有抑制凋亡作用,如Bcl-XL和Bcl-2等,而另一类具有促凋亡作用,如Bax和Bak等。
在本实验中我们首先观察了不同细胞比的BMMSCs共培养对CoCl2引起的PC12细胞活性下降的影响,结果显示0.6 mmol/L CoCl2处理明显降低PC12细胞活性,而 BM-MSCs共培养可有效抑制CoCl2引起的PC12细胞活性下降。同时,我们还观察了0.6 mmol/L CoCl2诱导的BM-MSCs EPO mRNA与蛋白表达情况,结果显示BM-MSCs经0.6 mmol/L CoCl2刺激后,EPO mRNA与蛋白表达水平明显上升,而EPO siRNA可有效抑制EPO的表达水平。此外,FCM与Hoechst 33258染色结果表明BM-MSCs共培养减少了CoCl2诱导的PC12细胞凋亡,而这一抗凋亡作用可被EPO siRNA阻断,提示BM-MSCs介导的细胞保护作用与其上调EPO表达有关。此外,RT-PCR与caspase-9、-3活性检测结果显示EPO siRNA可明显阻断BM-MSCs介导的Bcl-2表达上调、Bax表达下调及caspase-9、-3活性下降。这些结果表明BM-MSCs的细胞保护作用可能与其上调PC12细胞的Bcl-2表达、下调Bax表达及降低caspase-9、-3活性有关。
综上所述,本文证实BM-MSCs共培养能有效抑制化学性低氧模拟剂CoCl2诱导的PC12细胞损伤,而EPO可能是介导这一作用的关键因子。这为BMMSCs应用于中枢神经系统损伤修复的治疗提供了新的实验依据。
[1] Parr AM,Tator CH,Keating A,et al.Bone marrow-derived mesenchymal stromal cells for the repair of central nervous system injury[J].Bone Marrow Transplant,2007,40(7):609-619.
[2] Deng YB,Ye WB,Hu ZZ,et al.Intravenously administered BMSCs reduce neuronal apoptosis and promote neuronal proliferation through the release of VEGF after stroke in rats[J].Neurol Res,2010,32(2):148-156.
[3] Faden AI.Experimental neurobiology of central nervous system trauma[J].Crit Rev Neurobiol,1993,7(3-4):175-186.
[4] Wang Y,Deng Y,Zhou GQ.SDF-1α/CXCR4-mediated migration of systemically transplanted bone marrow stromal cells towards ischemic brain lesion in a rat model[J].Brain Res,2008,1195:104-112.
[5] Hokari M,Kuroda S,Shichinohe H.Bone marrow stromal cells protect and repair damaged neurons through multiple mechanisms[J].J Neurosci Res,2008,86(5):1024-1035.
[6] Maxwell PH,Ferguson DJ,Nicholls LG,et al.Sites of erythropoietin production[J].Kidney Int,1997,51(2):393-401.
[7] Kertesz N,Wu J,Chen TH,et al.The role of erythropoietin in regulating angiogenesis[J].Dev Biol,2004,276(1):101-110.
[8] Liu X,Xie W,Liu P,et al.Mechanism of the cardioprotection of rhEPO pretreatment on suppressing the inflammatory response in ischemia-reperfusion[J].Life Sci,2006,78(19):2255-2264.
[9] Dzietko M,FelderhoffvMueser U,Sifringer M,et al.Erythropoietin protects the developing brain against N-methyl-D-aspartate receptor antagonist neurotoxicity[J].Neurobiol Dis,2004,15(2):177-187.
[10] Sekiguchi N,Inoguchi T,Kobayashi K,et al.Erythropoietin attenuated high glucose-induced apoptosis in cultured human aortic endothelial cells[J].Biochem Biophys Res Commun,2005,334(1):218-222.
[11] 陈远寿,潘贵书,秦 伟,等.促红细胞生成素上调海马pCREB表达和改善脑缺血小鼠认知功能[J].中国病理生理杂志,2011,27(4):722-726.
[12] Wang GL,Jiang BH,Rue EA,et al.Hypoxia-inducible factor 1 is a basic-helix-loop-helix-PAS heterodimer regulated by cellular O2tension[J].Proc Natl Acad Sci U S A,1995,92(12):5510-5514.
[13] van der Kooij MA,Groenendaal F,Kavelaars A,et al.Neuroprotective properties and mechanisms of erythropoietin in in vitro and in vivo experimental models for hypoxia/ischemia[J].Brain Res Rev,2008,59(1):22-33.
[14] Wu Y,Shang Y,Sun S,et al.Erythropoietin prevents PC12 cells from 1-methyl-4-phenylpyridinium ion-induced apoptosis via the Akt/GSK-3β/caspase-3 mediated signaling pathway[J].Apoptosis,2007,12(8):1365-1375.
[15] Hillion JA,Takahashi K,Maric D,et al.Development of an ischemic tolerance model in a PC12 cell line[J].J Cereb Blood Flow Metab,2005,25(2):154-162.
[16] Pereira WO,Amarante-Mendes GP.Apoptosis:a programme of cell death or cell disposal?[J].Scand J Immunol,2011,73(5):401-407.

