NALP3富含亮氨酸重复序列结构域识别人细胞周期蛋白H和禽冠状病毒蛋白*
颜 亮, 罗 滔, 蔡军伟, 毕志斐, 胡巢凤
(1暨南大学医学院病理生理学教研室,国家中医药管理局病理生理学实验室,广东广州510632;2南方医科大学病理生理学教研室,广东广州510515;3山西医科大学人体解剖学教研室,山西太原030001)
固有免疫(innate immunity)是多细胞生物抗御 病原体感染和抗肿瘤的第一道防线。固有免疫细胞通过表达模式识别受体(pattern-recognition receptors,PRRs)识别病原体相关分子模式(pathogen-associated molecular patterns,PAMPs),启动机体的生物防御机能。Toll样受体[1](Toll-like receptors,TLRs)是发挥固有免疫功能的关键PRRs,主要识别细胞外或作用于细胞表面的PAMPs,例如细菌脂多糖、肽聚糖、胞壁酸、病毒双链RNA、细菌鞭毛蛋白等,其对PAMPs的识别由TLRs胞外富含亮氨酸的重复序列(leucine rich repeats,LRR)完成[2]。
然而机体在病理条件下也会出现PAMPs相关分子和相似的危险信号,这些PAMPs相关分子和危险信号存在于细胞内,诱发炎症反应和警示组织损伤。阐明机体对这些细胞内危险信号的识别机制是一个根本性的问题。2000年Hoffman等[3-4]相继报道了人类常染色体显性遗传病家族性冷诱发荨麻疹(familial cold urticaria,FCU)和MW综合征(Muckle-Wells syndrome,MWS)的致病基因是编码NACHT,LRR and PYD domains-containing protein 3(NALP3)的CIAS1基因。CIAS1基因的突变还可引起慢性婴幼儿神经皮肤关节综合症[5],这些疾病实质上均为自身炎症性病变,以炎症复合体(inflammasome)过度激活和产生过量炎症细胞因子 IL-1β为特征。NALP3又称 cryopyrin或 PYPAF1/NLRP3,主要在白细胞中表达。NALP3的N端是重要的热蛋白样结构域(pyrin domain,PYD)[6],通过接头蛋白 ASC 与其下游的信号效应分子相联系。中部是核苷酸偶联结构域(domain present in NAIP,CIITA,HET-E and TP-1,NACHT)[7],具有同属蛋白寡聚化募集的功能。C端的LRR结构域与TLR胞外段结构相似,由多个重复结构单位呈大致相互反向平行的 β-折叠和 α-螺旋构成,具有分子之间相互作用和配体识别能力[8]。当细胞内信号分子被NALP3的LRR结构域(NALP3-LRR)识别后,引起NALP3的寡聚化和分子活化,与炎症性凋亡蛋白酶1形成炎症复合体,参与炎症细胞因子 IL-1β的生成和机体固有免疫调节[9]。
NALP3能被包括ATP、细菌毒素、病原体代谢产物、尿酸晶体、三硝基氯苯等激活[10-12],推测其机制与NALP3-LRR结构域对这些细胞内危险信号的识别有关,而NALP3发生基因突变引起自身炎症性病变则可能导致LRR结构域的识别功能紊乱和NALP3过度活化。至今关于内源性蛋白分子如何与NALP3-LRR结构域相互作用甚少见报道。本研究运用酵母双杂交技术,以人NALP3-LRR基因序列构建诱饵质粒,对人胚肺文库进行酵母双杂交文库筛选,寻找与NALP3-LRR结构域相互作用的蛋白质分子,为进一步阐明NALP3在固有免疫调节机制中的作用提供新的资料。
材料和方法
1 材料
pMyr人胚肺cDNA文库质粒(库容为4×108cfu/L)和pSos质粒(Stratagene),cdc25H酵母细胞、酵母转化、酵母质粒提取所需各种试剂及YPAD、SD/glucose(-UL)、SD/galactose(-UL)培养平板,XL1-Blue感受态菌及分子克隆所用的常规试剂均由天津赛尔生物技术有限公司提供。
2 方法
2.1 克隆NALP3-LRR的cDNA序列及构建含有NALP3-LRR序列的pSos诱饵质粒 人软骨组织通过液氮研磨,Trizol法提取总RNA,用Oligo dT为引物,MMLV逆转录酶进行逆转录反应。设计含有BamH I和Sal I酶切位点的PCR引物,克隆NALP3-LRR的cDNA序列。将回收的PCR产物与酶切后的线性质粒16℃连接过夜。提取质粒,酶切鉴定含有NALP3-LRR的阳性克隆。将NALP3-LRR序列与诱饵载体pSos连接,酶切鉴定选择适当的克隆经测序确认。
2.2 酵母转化和诱饵蛋白自激活实验 常规制备感受态细胞,行酵母转化实验。设置阳性对照组为pSos MAFB+pMyr MAFB和pSos MAFB+pMyr SB;阴性对照组为pSos MAFB+pMyr Lamin C和pSos Col I+pMyr MAFB,只有在galactose存在的前提下才能激活报告基因的表达。为了验证Bait蛋白NALP3-LRR是否具有自激活能力,设置转化组别为:pSos bait(用于排除bait蛋白自身可定位于膜上),pSos bait+pMyr SB(验证蛋白位于胞浆中),pSos bait+pMyr或pMyr Lamin C(排除bait蛋白可能与myristlyation signal结合)。将在 25 ℃ SD/glucose(-UL)平板上生长的酵母菌挑取在DDW中涡旋后各滴于 SD/glucose(-UL)和 SD/galactose(-UL)的平板上,25℃ 和37℃观察4~6 d。
2.3 感受态酵母菌的制备及质量评价 使用2个对照平板来检测温度敏感突变体的突变频率。第1对照组将75 μL用来制备酵母感受态的酵母培养物铺于YPAD完全培养平板上,在37℃孵育6 d,出现5个克隆(小于30个克隆),说明培养物中温度敏感突变体的数量合格。第2对照平板为共转化pSos和pMyr的酵母细胞,37℃孵育6 d,未出现克隆,符合要求。共转化了pSos和pMyr的酵母细胞,在25℃孵育的SD/glucose(-UL)平板上生长的克隆数为130左右。按公式计算转化效率为1.3×103cfu/μg,符合转化效率应在0.5 ×103~1 ×104cfu/μg的要求。
2.4 酵母的文库筛选实验 将NALP3-LRR-pSos质粒和pMyr人胚肺cDNA文库质粒共转化到酵母的感受态细胞中,将转化反应混合物铺在SD/galactose(-UL)琼脂平板上。25℃倒置孵育平板48 h,随后转入37℃孵育。7 d以后,从37℃半乳糖平板上的文库筛选转化物中挑取克隆,将细胞重铺在SD/glucose(-UL)琼脂平板上,在22~25℃孵育48 h。再将其分别重铺在2个SD/glucose(-UL)平板和1个SD/galactose(-UL)平板上,其中一个SD/glucose(-UL)平板在25℃孵育作为保存板,另外一个SD/glucose(-UL)平板和SD/galactose(-UL)平板在37℃孵育约48 h。48 h后观察各个平板的克隆生长情况,找出37℃下在SD/galactose(-UL)平板上生长、而在SD/glucose(-UL)平板上不生长的克隆。将这些克隆再次铺板,置不同温度培养,重复验证后视为可能的阳性克隆。
2.5 阳性克隆的酵母回交验证实验 扩增含有阳性克隆的酵母细胞后通过化学及物理裂解的方法提取其中的文库质粒DNA,转化上述质粒DNA至大肠杆菌后,分离纯化文库质粒DNA。酶切鉴定文库质粒DNA中所含外片段的大小进行比对分析。再次共转文库与诱饵DNA,对筛选得到的阳性克隆进行回交验证。最后测序分析阳性克隆的序列并做生物信息学分析。
2.6 NALP3-LRR与阳性克隆基因在293T细胞的共表达和免疫共沉淀验证 对经酵母文库筛选获得的阳性蛋白进行基因序列克隆,构建相应的真核表达载体,经酶切鉴定后送测序确认。用Lipofectamine 2000将含有相关阳性蛋白基因的真核表达载体与含有NALP3-LRR基因的真核表达载体共转染293T细胞,CO2培养箱37℃ 培养72 h后,裂解细胞提取蛋白。Western blotting检测相关蛋白在293T细胞中的表达。
分别将NALP3-LRR/pCD3-CMYC与CCNH/pCD3-HA、NALP3-LRR/pCD3-CMYC 与 AIBVORF1a/pCD3-HA、NALP3-LRR/pCD3-CMYC 与PALM3/pCD3-HA共转染293T细胞,48 h后收获细胞,加入细胞裂解缓冲液裂解细胞提取蛋白。取 c-Myc单抗交联蛋白A琼脂糖珠,用裂解缓冲液洗3次,将预处理过的蛋白A琼脂糖珠加入和抗体孵育过夜的细胞裂解液中,4℃ 缓慢摇晃孵育4 h,使抗体与蛋白A琼脂糖珠偶联。免疫沉淀反应后,4℃、3 000 r/min离心将琼脂糖珠离心至管底,小心吸去上清,琼脂糖珠用裂解缓冲液洗,最后加入2×SDS上样缓冲液,沸水煮5 min。配制分离胶为10%的SDS-PAGE凝胶,上样后100V电压电泳。电泳分离后的蛋白经电转移至硝酸纤维素膜上,浸入Blotto封闭液封闭非特异性结合位点,分别与Ⅰ抗和Ⅱ抗孵育,最后加入化学发光底物检测显影,凝胶成像系统拍照。
2.7 用分子模拟软件Discovery StudioTM(Accelrys)对NALP3-LRR进行三维结构模建,使用Vector NTI Suite软件、ExPASy的PROSITE数据库、DTU CBS服务器上的NetPhos 2.0 Server程序和Stanford大学开发的SAPS等工具和数据库分析NALP3-LRR序列的功能位点。
结 果
1 NALP3-LRR的cDNA序列克隆和NALP3-LRR-pSos诱饵质粒的构建
常规方法提取总 RNA,A260/A280=1.9,经1%琼脂糖凝胶电泳,28S/18S大约为1∶1~2∶1之间。PCR产物经酶切鉴定片段大小正确,见图1A。将NALP3-LRR序列与诱饵载体pSos连接,酶切后电泳鉴定,显示1、3、5号克隆含有大小正确的目的片段,见图1B,其中1号克隆经测序确认序列无误,读码框正确,用于后续实验。
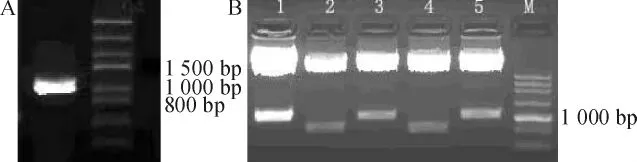
Figure 1.Identification of PCR clone of NALP3-LRR cDNA(A)and NALP3-LRR-pSos bait plasmid(B)by enzyme digestion with BamH I and Sal I.M:DNA marker.图1PCR克隆的NALP3-LRR cDNA序列和NALP3-LRR-pSos诱饵质粒的酶切鉴定
2 酵母转化和自激活实验
将cdc25H酵母细胞分别画线于 SD/-Trp、SD/-Leu、SD/-His、SD/-Ura和 YPDA,22 ~25 ℃下生长4~6 d。结果只在YPDA上长出克隆,其余SD平板上均无克隆出现。将cdc25H酵母细胞分别画线于2块YPDA平板,一个放于22~25℃培养,另一个放于37℃培养,共观察4 d,37℃条件下无菌落生长。
酵母转化对照实验表明,只有在galactose存在的前提下才能激活报告基因的表达,实际结果与预期结果相符,见表1。
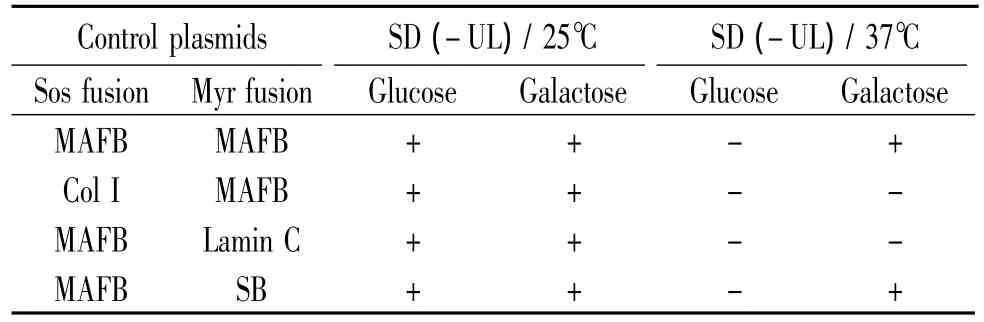
表1 酵母转化证实galactose的存在激活报告基因Table 1.Yeast transformation indicated galactose activated the reporter gene
自激活实验结果显示,2组转化后的酵母菌25℃在glucose和galactose平板上均有生长;37℃在glucose平板上,2组均无生长。在galactose平板上,NAPL3-LRR-pSos+pMyr SB生长,而NAPL3-LRR-pSos+pMyr Lamin C不生长,表明NALP3无自激活作用,可用于酵母文库筛选实验,见图2。
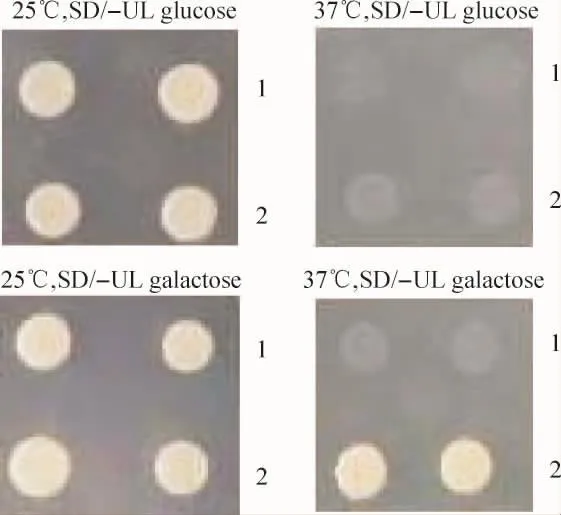
Figure 2.The growth of the co-transformants under different conditions for testing the possibility of self-activation by NALP3-LRR.1:NALP3-LRR-pSos+pMyr Lamin C;2:NALP3-LRR-pSos+pMyr SB.图2 自激活实验显示共转子在不同条件下的生长情况
3 从人胚肺cDNA文库筛选与NALP3-LRR相互作用的阳性克隆
将NALP3-LRR-pSos质粒和pMyr人胚肺cDNA文库质粒共转化后的酵母的感受态细胞按照方法2.4培养,找出37℃下在SD/galactose(-UL)平板上生长,而在SD/glucose(-UL)平板上不生长的克隆,再次验证后视为可能的阳性克隆,图3是部分阳性克隆的例子,可见第2号克隆在 SD/glucose(-UL)条件下,25℃能正常生长,37℃则无法生长。该克隆在SD/galactose(-UL)条件下,37℃也能生长。将选中的克隆重新培养筛选验证,共得到4个阳性克隆。扩增4个阳性克隆的酵母细胞提取其中含有的文库质粒DNA,转化大肠杆菌XL1-Blue感受态细胞后小量提取质粒。用EcoR I和Xho I双酶切鉴定,片段大小与预测相符。回交实验进一步证明所选克隆与NALP3-LRR在酵母细胞内有相互作用,见图4。

Figure 3.Identification and selection of a positive clone.图3 鉴别和挑选阳性克隆

Figure 4.Further confirmation of the positive clones by the yeast backcross verification.图4 回交实验进一步验证阳性克隆
阳性克隆经测序和生物信息学分析表明,克隆N1为人细胞周期蛋白H(Homo sapiens cyclin H,CCNH);克隆 N2为 Homo sapiens paralemmin-3(PALM3);克隆N5为KRAS,是Cytotrap系统中一背景性假阳性蛋白;克隆N6为禽传染性支气管炎病毒(avian infectious bronchitis virus,AIBV)Ca199毒株的ORF1a蛋白(AIBV-ORF1a)。
4 与NALP3-LRR相互作用的蛋白质在人肾上皮细胞的表达及免疫共沉淀验证
成功构建相应的真核表达载体NALP3-LRR/pCD3-CMYC、CCNH/pCD3-HA、PALM3/pCD3-HA 和AIBV-ORF1a/pCD3-HA,经酶切后均可见到大小正确的插入片段。测序结果显示序列正确,无任何突变或缺失,读码框正确。转染293T细胞后,经Western blotting获得单一清晰条带证实这些蛋白均能在人肾上皮细胞表达,见图5。
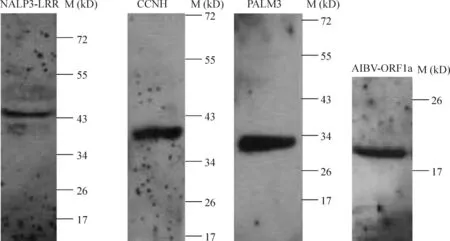
Figure 5.The expression of positive proteins in 293T cells detected by Western blotting.图5 蛋白印迹实验证实筛选的阳性蛋白均能在人肾上皮细胞293T表达
将真核表达载体NALP3-LRR/pCD3-CMYC分别与 CCNH/pCD3-HA、PALM3/pCD3-HA 和 AIBVORF1a/pCD3-HA共转染293T细胞后,细胞裂解物和经CMYC单抗琼脂糖珠结合的沉淀物均可检测到NALP3-LRR蛋白的存在(图略)。NALP3-LRR基因与CCNH基因共转染的细胞裂解物和NALP3-LRR基因与AIBV-ORF1a基因共转染的细胞裂解物经与CMYC单抗琼脂糖珠结合后,在琼脂糖珠结合物中均可检测到2种蛋白的存在,表明2种蛋白之间存在相互作用。NALP3-LRR与PALM3基因共转染的细胞裂解物与CMYC单抗琼脂糖珠结合后,在琼脂糖珠结合物中只能检测到NALP3-LRR的存在,未检出PALM3蛋白,表明2种蛋白之间没有相互作用,见图6。
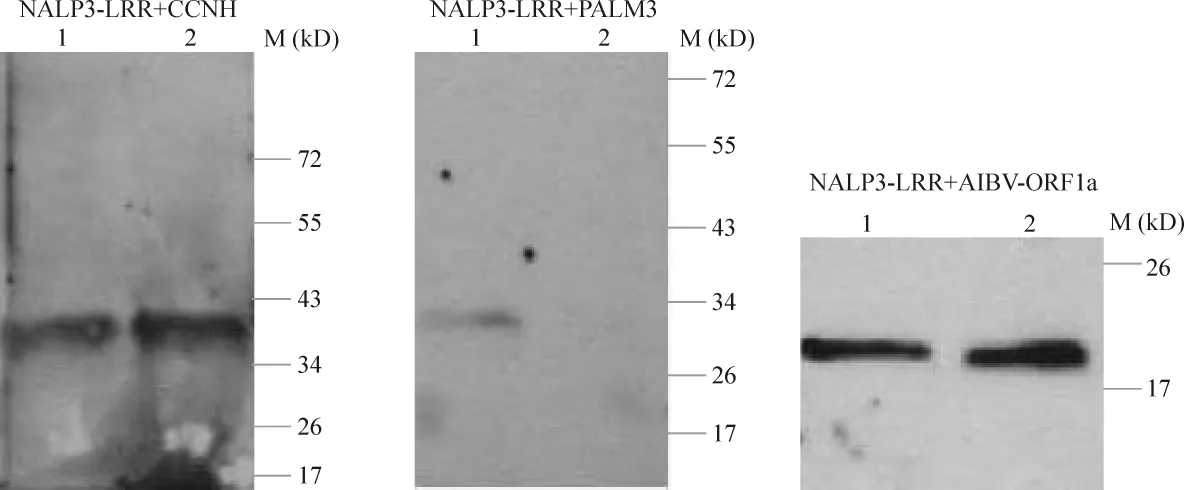
Figure 6.Co-immunoprecipitation of NALP3-LRR with the positive proteins.The anti-HA antibody was used as the first antibody for binding to the positive proteins.Lane 1:the sample was the cell lysate before co-IP by Sepharose 4B conjugated with the anti-CMYC antibody;Lane 2:the sample was the precipitates of the cell lysate after co-IP by Sepharose 4B conjugated with the anti-CMYC antibody.图6 免疫共沉淀实验确认与NALP3-LRR相互作用的蛋白
5 NALP3-LRR结构域的分子模拟和功能预测
虽然NALP3-LRR结构域富含亮氨酸,但无亮氨酸拉链结构。对NALP3的分子基序搜寻显示N-糖基化位点(N-glycosylation site)主要位于LRR结构域,原核生物膜脂蛋白脂质附着位点(prokaryotic membrane lipoprotein lipid attachment site)也位于LRR结构域(第831~841位氨基酸),并存在12个可能的磷酸化位点。分子结构保守性分析结果表明,LRR结构域在整个NALP3分子中保守性最高。对NALP3-LRR结构域的三维分子模建可见该结构域有典型的TLR胞外PAMPs识别的相似结构,其外缘为α螺旋,内缘为β折叠,两者交替反相折叠呈马蹄形。该区负电荷分布占明显优势,重心位于近羧基β折叠及β折叠的羧基端转弯部位,整个模建的负静电势分布呈拳击手套状,有正电势分布位于手套掌根部。
讨 论
运用酵母双杂交技术,本文首次发现在酵母细胞和人肾上皮细胞内,人NALP3-LRR结构域蛋白与人细胞周期蛋白H和禽传染性支气管炎病毒发生了相互作用。为了确保研究结果的准确性,在实验过程中采取了严格的质量控制措施,所有DNA克隆产物都在酶切鉴定后经序列测定确认,保证序列正确,无任何突变或缺失且读码框正确,能表达正确的蛋白质。酵母双杂交对人胚肺cDNA文库的筛选每个实验均设置严格对照,排除了NALP3-LRR蛋白自激活的可能性。对能与NALP3-LRR结构域蛋白相互作用的阳性克隆采用了重复实验、回转实验,最后共转染人肾上皮细胞293T通过免疫共沉淀检验方予确认。
NALP3是NALP分子家族的典型代表,其N端是PYRIN结构域,C端是LRR结构域,NACHT结构域位于分子的核心部位,这样的结构使其既有信号识别能力,又有自身寡聚化和与效应分子形成复合物的功能,是构成炎症复合体的重要成分。本实验室曾报道NALP3的NACHT结构域存在能与ATP和Mg2+结合的Walker A和Walker B基序,该基因的主要致病突变点与此结构有密切关系。同时发现LRR区域存在与Ca2+和多糖结合的位点[13]。
对PYRIN结构域的效应关联机制和NACHT结构域的同源寡聚化已有较多的研究资料,但至今尚缺少关于NALP3-LRR结构域识别PAMPs和与胞内危险信号相互作用的直接证据。虽然大量的研究已明确细胞内多种PAMPs和细胞损伤产生的信号分子可激活NALP3炎症复合体,这些信号分子是否通过LRR结构域进行识别尚属推测。本研究证明NALP3-LRR结构域能识别蛋白质分子,这种物理性相互作用对该结构域是NALP3分子的信号识别机构的观点提供了重要的证据。而我们对LRR结构域的分子模拟分析提示该区域是整个NALP3分子中保守性最高的部分,特殊的电荷分布使其易于通过电荷相互作用与其它分子相结合。LRR结构域的多个糖基化位点和磷酸化位点提示某种调节机制的存在。NALP3-LRR结构域和TLR胞外段能与PAMPs识别的LRR结构域相似[14],外缘为α螺旋,内缘为β折叠,两者交替反相折叠的马蹄形结构也易于形成口袋状的活性中心。
NALP3-LRR结构域能识别AIBV-ORF1a蛋白,和人们长期以来认为该分子结构是细胞内PAMPs感受器的推测相符。AIBV是冠状病毒(coronavirus)家族成员,属于包膜型正链RNA病毒,ORF1a基因是冠状病毒的保守基因。AIBV感染是对各种家禽威胁最大的呼吸系统传染致病原。基因组数据分析显示,SARS冠状病毒与AIBV冠状病毒北京分离株存在50%的同源性[15],SARS冠状病毒与多个AIBV病毒株存在不同程度的序列重组现象,氨基酸取代类型上也有较大的相似性[16]。科学家在研制针对SARS冠状病毒的疫苗时都重视借鉴过往制备AIBV疫苗的经验[17]。虽然AIBV并非人类的致病病毒,了解NALP3-LRR结构域识别AIBV病毒蛋白的意义,在于对呼吸系统有感染能力的冠状病毒对人类的威胁越来越大,本实验结果为探讨机体识别这一类病原体并启动固有免疫机制提供了新思路,对研究病毒性呼吸系统感染的治疗和相关疫苗的制备,以及对人类抗御传染性呼吸道致病原,提高自身抵抗力均有重要意义。
细胞周期蛋白H为单域结构,是动植物普遍存在的细胞周期蛋白,在细胞周期的各个时相均有表达,通过与CDK7结合形成CAK,促进多个CDK的磷酸化,参与细胞周期的调节。人细胞周期蛋白H能与P53蛋白直接相互作用,使之磷酸化,促进细胞增殖。至今,尚未有关于人细胞周期蛋白H直接参与固有免疫调节和炎症反应的报道。众所周知,增生是炎症反应的主要病理过程之一,大量研究资料表明,炎症反应影响细胞周期蛋白的表达[18];使用细胞周期抑制剂能减轻炎症性神经损伤和肺损伤;克氏锥虫感染可刺激细胞增生,细胞周期蛋白表达上调,感染细胞呈炎症表型[19-21];细胞周期抑制性调节物p21也能抑制巨噬细胞生成IL-1β[22]。有报道称NALP3的炎症复合体机制还参与了代谢综合症、II型糖尿病、器官重塑性疾病如动脉粥样硬化和慢性阻塞性肺疾病的发病过程,由此引起的细胞增殖过程异常理应有细胞周期蛋白的参与。既然人细胞周期蛋白H调节多种细胞周期蛋白的活性,其作为参与炎症反应和固有免疫调节的可能性也是存在的。值得注意的是,细胞周期蛋白H大多定位于细胞核[23],与本实验NALP3-LRR蛋白定位于胞浆及膜结构有区别。NALP3可能通过对细胞周期蛋白H的识别影响其入核发挥作用,进而影响细胞增殖进程,或者细胞周期蛋白H还具有与周期调节不同的功能也是值得深入研究的新课题。例如,高迁移率族蛋白B1(HMGB1)的定位和功能就主要在细胞核内,但某些组织细胞在特定情况下能主动分泌HMGB1到胞外诱发炎症反应并能被TLR识别。本实验室曾报道PYRIN蛋白家族成员存在较复杂的基因多态性变化[24],深入探讨NALP3-LRR与细胞周期蛋白H的相互作用将有助于阐明固有免疫和细胞增殖的关系和调节机制。
虽然我们的研究在细胞水平(包括酵母细胞和人肾上皮细胞)上证实NALP3-LRR结构域与人细胞周期蛋白H和AIBV-ORF1a蛋白存在相互作用,但实验条件是处于体外人工转染高表达状态下。进一步研究在生理及病理状态下NALP3分子与这些蛋白的相互作用将有助于阐明NALP3作为细胞内危险信号感受器的识别机制。
[1] Rock FL,Hardiman G,Timans JC,et,al.A family of human receptors structurally related to Drosophila Toll[J].Proc Natl Acad Sci U S A,1998,95(2):588-593.
[2] Akira S,Takeda K,Kaisho T.Toll-like receptors:critical proteins linking innate and acquired immunity[J].Nat Immunol,2001,2(8):675-680.
[3] Hoffman HM,Wright FA,Broide DH,et al.Identification of a locus on chromosome 1q44 for familial cold urticaria[J].Am J Hum Genet,2000,66(5):1693-1698.
[4] Hoffman HM,Mueller JL,Broide DH,et al.Mutation of a new gene encoding a putative pyrin-like protein causes familial cold autoinflammatory syndrome and Muckle-Wells syndrome[J].Nat Genet,2001,29(3):301-305.
[5] Neven B,Callebaut I,Prieur AM,et al.Molecular basis of the spectral expression of CIAS1 mutations associated with phagocytic cell-mediated autoinflammatory disorders CINCA/NOMID,MWS,and FCU [J].Blood,2004,103(7):2809-2815.
[6] Martinon F,Hofmann K,Tschopp J.The pyrin domain:a possible member of the death domain-fold family implicated in apoptosis and inflammation [J].Curr Biol,2001,11(4):R118-R120.
[7] Koonin EV,Aravind L.The NACHT family-a new group of predicted NTPases implicated in apoptosis and MHC transcription activation[J].Trends Biochem Sci,2000,25(5):223-224.
[8] Kajava AV.Structural diversity of leucine-rich repeat proteins[J].J Mol Biol,1998,277(3):519-527.
[9] Dowds TA,Masumoto J,Zhu L,et al.Cryopyrin-induced interleukin 1 beta secretion in monocytic cells:enhanced activity of disease-associated mutants and requirement for ASC[J].J Biol Chem,2004,279(21):21924-21928.
[10] Mariathasan S,Weiss DS,Newton K,et al.Cryopyrin activates the inflammasome in response to toxins and ATP[J].Nature,2006,440(7081):228-232.
[11] Martinon F,Petrilli V,Mayor A,et al.Gout-associated uric acid crystals activate the NALP3 inflammasome [J].Nature,2006,440(7081):237-241.
[12] Kanneganti TD,Ozoren N,Body-Malapel M,et al.BacterialRNA and smallantiviralcompounds activate caspase-1 through cryopyrin/Nalp3 [J].Nature,2006,440(7081):233-236.
[13] 蔡军伟,韩丽芳,颜 亮.LPS对人CIAS1基因表达的影响及NACHT区的序列分析[J].中国病理生理杂志,2006,22(6):1112-1118.
[14] Pan X,Yue J,Ding G,et al.Leucine-rich repeat 11 of Toll-like receptor 9 can tightly bind to CpG-containing oligodeoxynucleotides,and the positively charged residues are critical for the high affinity[J].J Biol Chem.2012,287(36):30596-30609.
[15] 金渭武,陈 晨,张 莹,等.鸡传染性支气管炎冠状病毒北京分离株全基因组序列的测定及其特征分析[J].科学通报,2004,49(4):352-357.
[16] Shi P,Yu L,Fu YX,et al.Evolutionary implications of avian infectious bronchitis virus(AIBV)analysis[J].Cell Res,2006,16(3):323-327.
[17] Cavanagh D.Severe acute respiratory syndrome vaccine development:experiences of vaccination against avian infectious bronchitis coronavirus[J].Avian Pathol,2003,32:567-582.
[18] 韩曙光,吕蓓丽,丁晓婧,等.H2型松弛素对慢性支气管哮喘小鼠气道重塑与肺组织细胞周期蛋白D1表达的影响[J].中华结核和呼吸杂志,2012,35(5):349-354.
[19] Tian DS,Xie MJ,Yu ZY,et al.Cell cycle inhibition attenuates microglia induced inflammatory response and alleviates neuronal cell death after spinal cord injury in rats[J].Brain Res,2007,1135(1):177-185.
[20] Hoogendijk AJ,Roelofs JJ,Duitman J,et al.R-roscovitine reduces lung inflammation induced by lipoteichoic acid and streptococcus pneumoniae[J].Mol Med,2012,18(1):1086-1095.
[21] Nagajyothi F,Desruisseaux MS,Thiruvur N,et al.Trypanosoma cruzi infection of cultured adipocytes results in an inflammatory phenotype[J].Obesity,2008,16(9):1992-1997.
[22] Scatizzi JC,Mavers M,Hutcheson J,et al.The CDK domain of p21 is a suppressor of IL-1β-mediated inflammation in activated macrophages[J].Eur J Immunol,2009,39(3):820-825.
[23] 马雅婷,赵 晶,杨 光,等.人 CtBP2与CCNH相互作用的初步研究[J].复旦学报,2007,46(3):395-400.
[24] 韩丽芳,蔡军伟,颜 亮,等.中国人群MEFV基因多态性研究[J].实用医学杂志,2006,22(11):1234-1235.

