丹参酮ⅡA磺酸钠对胰腺癌BX-PC-3细胞系增殖与细胞周期调控因子表达的影响*
陈 景, 黄曙方, 肖定璋, 麦丽萍, 彭 琪, 赖沛龙, 陈少贤, 余细勇
(广东省医学科学院,广东省人民医院医学研究中心,广东广州510080)
丹参酮ⅡA磺酸钠(tanshinoneⅡA,TSⅡA)是从唇形科植物丹参(Salvia miltiorrhiza)中分离二萜醌类化合物丹参酮ⅡA,经磺化而得到的水溶性物质,是中药丹参主要有效成分之一。近年研究发现,TSⅡA对肝癌、胃癌等多种肿瘤细胞具有显著的抑制生长增殖及杀伤作用[1-2]。目前研究显示细胞周期可影响细胞生长增殖,细胞周期调控因子将参与细胞生长增殖途径,其中cyclin A、cyclin D2等在促细胞生长增殖中扮演重要角色。我们既往的研究表明通过药物下调细胞周期蛋白cyclin D1可显著抑制细胞生长增殖[3],为进一步阐明TSⅡA抑制细胞生长增殖的机制,本研究以不同浓度的TSⅡA作用于胰腺癌BX-PC-3细胞系,观察TSⅡA抑制 BX-PC-3细胞生长增殖过程中cyclin A和cyclin D2的变化情况。
材料和方法
1 材料
人胰腺癌细胞株BX-PC-3购于中科院上海细胞研究所;TSⅡA购于中国药品生物制品检定所,纯度≥98%(批号:111605-200301);Gibco新生胎牛血清购于英韦创津公司;HyClone DMEM/F12培养基和0.25%胰蛋白酶溶液均购于莱德尔公司;MTT试剂为南京凯基生物公司产品;DAPI试剂盒(Nuclear I-solation and Staining Solution-10;NPE Systems Inc.),Cell Cycle Staining Solution[MultiSciences;主要成分:碘化丙啶(propidium iodide,PI)50 mmol/L,RNaseA 200 mg/L,四盐酸精胺1 g/L];兔多克隆cyclin A和cyclin D2抗体购于武汉博士德公司;GAPDH单克隆抗体购于上海康成公司,辣根过氧化物酶标记小鼠IgG及兔IgGⅡ抗购于Santa Cruz;Super ECL Plus购于北京普利莱公司;DMSO试剂购于Sigma,其它均为分析纯试剂。
2 方法
2.1 细胞培养 人胰腺癌细胞株BX-PC-3培养于含10%胎牛血清DMEM/F12培养基中,37℃、5%CO2、饱和湿度培养箱常规培养,每3 d换液传代培养,取对数生长期的细胞进行实验,实验细胞起始接种浓度为1×107/L。
2.2 药物处理及实验分组 称取2 mg TSⅡA溶解于1 mL 0.02%二甲基亚砜 (dimethyl sulfoxide,DMSO;一般认为DMSO<0.1%时,不引起细胞生物学性状的改变),使其浓度为2 g/L,过滤除菌保存,临用时以适量的培养液稀释到实验所需浓度。根据预实验结果及文献报道,设5个实验组,各组浓度分别为 0、10、20、30、40 和 50 mg/L,其中 0 mg/L 为空白对照组,其余为干预细胞实验组。
2.3 MTT法测定TSⅡA对人胰腺癌细胞的生长抑制作用 取对数生长期的人胰腺癌BX-PC-3细胞,制成1×108/L的单细胞悬液后以每孔100 μL接种于96孔板,在5%CO2、饱和湿度、37℃孵箱中预培养24 h后加入不同体积的TSⅡA,使最终每组含TSⅡA 浓度分别为10、20、30、40、50 mg/L,每个剂量分别设3个复孔,并设正常细胞作对照组,继续培养。于48 h进行MTT比色实验:每次于实验结束前每孔加入浓度为5 g/L MTT液50 μL,37℃避光培养继续培养4 h,使MTT还原为formazan。每孔加DMSO 100 μL,避光摇匀10 min,使formazan充分溶解,后置于酶标仪570 nm检测吸光度(absorbance,A)值,以空白组平均值调零,根据吸光度计算不同浓度的TSⅡA对胰腺癌细胞的增殖抑制率(inhibitory rate,IR)。IR(%)=(对照组A值-药物作用组A值)/(对照组A值-本底对照组A值)×100%。评价标准:IR>70%为高度敏感,IR在50% ~70%之间为中度敏感,IR在30% ~50%之间为低度敏感,IR<30%为不敏感。
2.4 流式细胞术检测细胞周期 生长状态良好的BX-PC-3细胞换无血清培养基培养12 h,设10、20、30、40、50 mg/L 5个给药浓度,分别加入不同体积的TSⅡA,另设空白血清对照组,培养 48 h后,经0.25%胰酶消化,分别收集细胞于15 mL离心管中,每份细胞密度约1×109/L,PBS洗2次,2 000 r/min离心5 min弃上清液。每份细胞加入1 mL DAPI染液,室温避光染色2 min以上,300目筛网过滤后上机进行检测。通过调节电压在EV直方图中显示BX-PC-3细胞的细胞主群,设门(EV)圈住主群细胞,在FL1直方图中显示EV门中细胞群,将二倍体荧光峰G0/G1峰调至荧光道数为200道处,获取10 000个细胞。将QuantaTMSC MPLCollection软件下获取的数据经QuantaTMSC MPLAnalysis软件以FSC的格式输出,打开细胞周期分析软件Muticycle,导入数据并拟合,进行分析比较。
2.5 Western blotting 将生长状态良好BX-PC-3细胞平均接种到6孔板中,经不同浓度TSⅡA刺激48 h后,将各组细胞用预冷的PBS液洗3次,吸弃PBS液,加入预冷的含抑制剂的细胞裂解液,轻轻摇动5 min后,用一预冷的细胞刮刮下培养瓶壁上细胞,转移细胞悬液到离心管中,冰浴15 min进行裂解.裂解液于4℃、12 000 r/min离心15 min,收集上清。12%SDS聚丙烯酰胺凝胶电泳,将蛋白质转移到PVDF膜,用含5%脱脂奶粉的TTBS(0.1 mol/L Tris-HCl,pH 7.5;0.2%NaCl;0.05%Tween-20)37 ℃封闭1~2 h,分别加入兔抗人cyclin A和cyclin D2多克隆抗体、GAPDH单克隆抗体,4℃孵育过夜。TTBS漂洗5 min×3次;鼠抗辣根过氧化物酶标记Ⅱ抗(1∶9 000稀释)或者兔抗辣根过氧化物酶标记Ⅱ抗(1∶9 000稀释)4℃孵育45 min;TTBS漂洗5 min×3次;Super ECL Plus敏感曝光试剂盒曝光底片显影。
3 统计学处理
计量资料以均数±标准差(mean±SD)表示,所有实验数据均采用SPSS 13.0统计软件进行处理。两样本均数间比较采用t检验,多样本均数间比较采用单因素方差分析(One-way ANOVA),组间比较采用Dunnett t检验,以P<0.05为差异有统计学意义。
结 果
1 TSⅡA抑制BX-PC-3细胞增殖
10、20、30、40、50 mg/L TSⅡA 作用48 h 对胰腺癌BX-PC-3细胞的增殖有明显的抑制作用,其A值明显低于空白组,见图1。TSⅡA对BX-PC-3细胞株的生长有抑制作用,细胞存活率随TSⅡA浓度升高而降低,抑制效果呈现浓度依赖性。
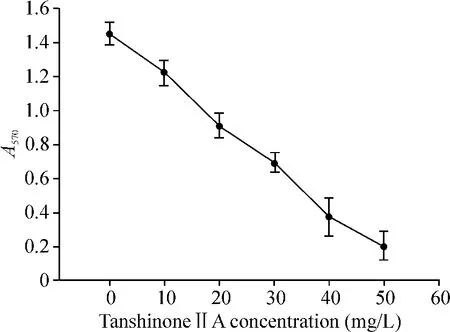
Figure 1.Effect of tanshinoneⅡA on BX-PC-3 cell proliferation detected by MTT assay.Mean ± SD.n=3.图1 不同浓度TSⅡA对胰腺癌细胞增殖的抑制
2 TSⅡA对胰腺癌细胞BX-PC-3周期的影响
流式细胞术检测显示,随着药物浓度的增加,G0/G1期细胞逐渐增加,G2/M期细胞明显下降,各浓度用药组与空白对照相比差异均有统计学意义,见图2。
3 Western blotting结果
如图3所示,随着TSⅡA浓度的增加,cyclin A与cyclin D2的表达量呈明显下调趋势。
讨 论
胰腺癌是一种恶性程度极高的致死性疾病,具有难发现、易转移、治疗效果极差的特点且目前治疗手段有限。近年来,已经证实中医药治疗胰腺癌不仅可以减轻症状,还能控制胰腺肿瘤细胞发展。其中TSⅡA抗癌作用可能是通过诱导细胞凋亡途径[4]和介导细胞周期调控因子抑制肿瘤细胞增殖途径[5]来实现,但TSⅡA对胰腺癌的作用效果如何仍不明确。我们前期研究表明通过药物下调细胞周期调控因子cyclin D1可显著抑制细胞生长增殖,本研究表明具有抗肿瘤作用的中药TSⅡA能够有效抑制胰腺癌BX-PC-3细胞增殖,具体机制可能通过细胞周期调控因子cyclin A和cyclin D2介导。
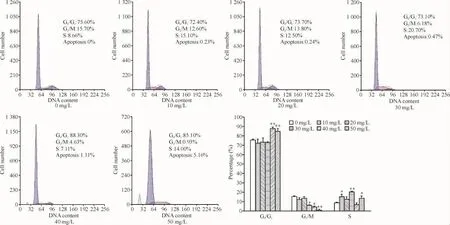
Figure 2.The effects of tanshinoneⅡA at different concentrations for 48 h on cell cycle of BX-PC-3 cells detected by FCM.Mean ±SD.n=3.*P <0.05,**P <0.01 vs control group(0 mg/L).图2 不同浓度的TSⅡA作用于BX-PC-3细胞48 h后细胞周期分布的变化
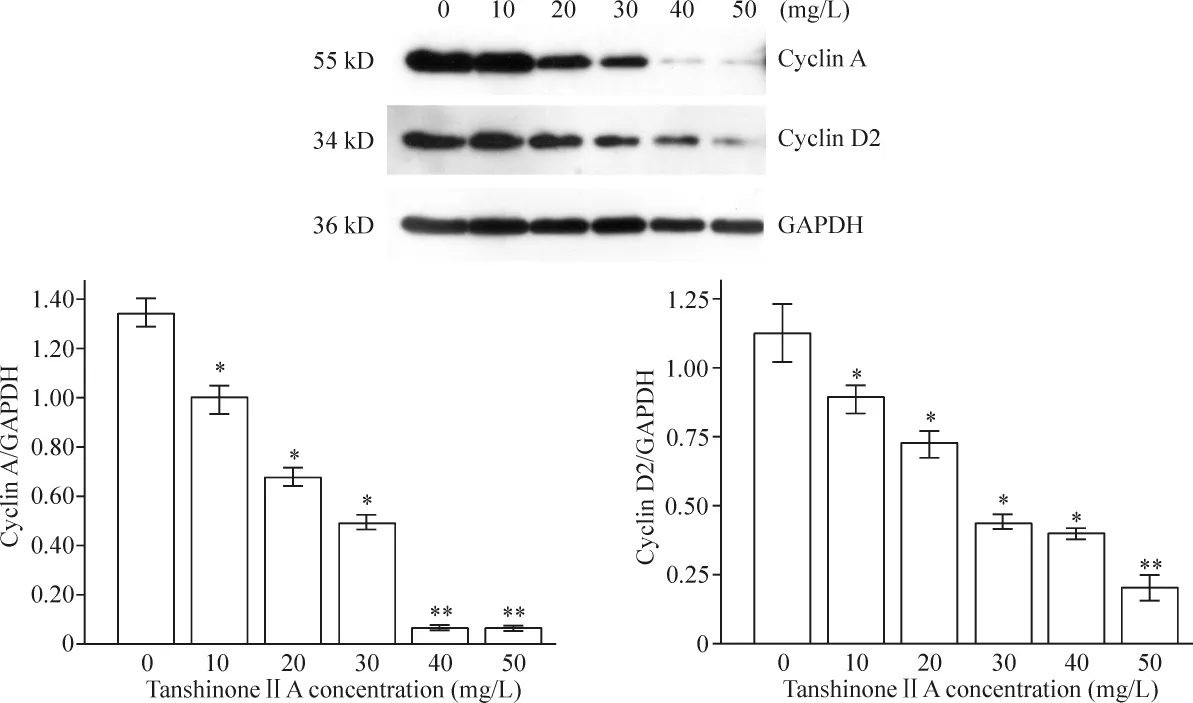
Figure 3.Cyclin A and cyclin D2 protein expression in BX-PC-3 cells 48 h after treatment with tanshinoneⅡA at different concentrations determined by Western blotting.Mean ± SD.n=3.*P <0.05,**P <0.01 vs control group(0 mg/L).图3 不同浓度的TSⅡA处理48 h后BX-PC-3细胞cyclin A与cyclin D2的表达
我们采用流式细胞术检测不同浓度的TSⅡA对BX-PC-3生长周期的影响,发现处于低药物浓度时,细胞停留在G0/G1期的比例与对照组相比变化不大,但当药物浓度达到40 mg/L甚至以上时,细胞停留在G0/G1期的比例较对照组明显升高。而TSⅡA应用后,G2/M期比例呈现明显下降,并且随着浓度增加,细胞停留在G2/M期的比例呈现明显剂量依赖的下降关系。正常组织细胞的周期存在G0/G1期和G2/M期转换2个限制点,这2个点使细胞的增殖与凋亡处于一种微妙的平衡状态。而在肿瘤细胞中,这种平衡状态被打破,肿瘤细胞无限制地增殖。所以,干扰肿瘤细胞的周期,使肿瘤细胞生长速率减慢,这将从本质上达到抑制肿瘤的效果。本研究结果提示TSⅡA能阻滞胰腺癌细胞于G0/G1期,从而达到抑制细胞增殖的效果。
Cyclin A是细胞周期的正性调控因子,属于M期周期蛋白,具有调节DNA合成和促进细胞有丝分裂的双重作用[6]。Cyclin A的异常表达,可直接或间接地促进G1/S期转换,启动DNA合成,而引起细胞异常增殖[7]。Cyclin D2是调节G1期的细胞周期蛋白cyclin D家族的成员之一,与细胞周期G1/S期转换有关,主要是启动S期,其异常或不恰当的表达可破坏细胞周期。我们采用Western blotting进行检测,发现随着药物浓度的增加,细胞周期调控因子cyclin A和cyclin D2蛋白合成下降,使细胞周期阻滞于G0/G1期,从而抑制细胞增殖。这一结果与BXPC-3细胞生长阻滞在G0/G1期是一致的。
我们通过研究发现,TSⅡA对胰腺癌细胞BXPC-3细胞的生长具有明显抑制作用,而且随着药物浓度的增加,G0/G1期细胞逐渐增加,G2/M期细胞明显下降,并且cyclin A和cyclin D2的蛋白表达也随之明显下调,说明TSⅡA对胰腺癌细胞BX-PC-3细胞的G2/M期检查点功能可能是通过调控cyclin A和cyclin D2来完成的。本实验证明,TSⅡA抑制胰腺癌细胞增殖的根本机制可能在于使胰腺癌细胞阻滞于G0/G1期,抑制细胞分裂增殖,具有良好的抑制胰腺癌细胞增殖作用,在治疗胰腺癌方面具有较好的应用前景。
[1] 钟志宏,陈文贵,柳永和,等.丹参酮ⅡA抑制HepG2细胞生长及诱导其凋亡的实验研究[J].中南大学学报:医学版,2007,32(1):99-103.
[2] Zhou L,Chan WK,Xu N,et al.Tanshinone IIA,an isolated compound from Salvia miltiorrhiza Bunge,induces apoptosis in HeLa cells through mitotic arrest[J].Life Sci,2008,83(11-12):394-403.
[3] 罗 琼,姜 傥,陈 景,等.丙型肝炎病毒核心蛋白对HepG2细胞生长周期的影响[J].中国病理生理杂志,2012,28(4):631-637.
[4] 王 炎,李 琦,范忠泽,等.丹参酮ⅡA对人胰腺癌细胞凋亡的诱导作用及其对SAPK/JNK信号转导通路的影响[J].世界华人消化杂志,2011,19(10):1028-1033.
[5] 肖建勇,谭宇蕙,张广献.丹参酮IIA对肾癌786-O细胞生长抑制作用及其分子机制[J].中药新药与临床药理,2012,23(2):136-139.
[6] Jarnagin WR,Klim stra DS,Hezel M,et al.Differential cell cycle regulatory protein expression in biliary tract adenocarcinoma:correlation with anatomic site,pathologic variables,and clinical outcome[J].J Clin Oncol,2006,24(7):1152-1160.
[7] 黄宇旸.p27在恶性肿瘤中的表达[J].外科理论与实践,2007,12(6):604-606.

