P162对食管癌细胞株Eca109的放射增敏作用及其对p75NTR表达的影响*
郑娇娇, 吴清明, 陈建华, 陈彩虹, 龙 辉
(1武汉科技大学,2武汉科技大学附属天佑医院,3武汉凯泰新生物技术有限公司,湖北武汉430064)
放射治疗是目前食管癌的主要治疗手段,但疗效欠佳,有研究发现放射治疗的效果不佳与食管癌干细胞的放射抗拒有关[1],近来同时有研究认为p75神经营养因子受体(p75 neurotrophin receptor,p75NTR)有可能成为食管癌干细胞特异性标志[2]。P162(安疴利肽)是基于Ras-GTP酶激活蛋白SH3功能区结合蛋白(Ras-GTPase-activating protein SH3 domain-binding protein,G3BP)靶标、利用计算机辅助药物设计方法筛选获得的全新抗癌多肽(中国专利201010140032.3,PCTWO2011/124063 A1),前期已证实该药对G3BP高表达的结肠癌细胞株HCT116有明显抑制作用及化疗增敏作用[3]。本实验以食管癌细胞株Eca109为对象,观察P162是否对Eca109细胞具有放射增敏作用及P162是否抑制食管癌干细胞。此项研究在国内外尚属首次。
材料和方法
1 细胞株、主要试剂及仪器
人食管癌细胞株Eca109(由太和医院馈赠);G3BP抗体(Bioss);P162(武汉凯泰新生物技术有限公司)溶解于无菌水中,-20℃冰箱保存;RPMI-1640培养粉(Gibco),新生胎牛血清(杭州四季青有限公司),胰蛋白酶粉(Amresco),CCK-8(cell counting kit-8)试剂(Sigma),PE标记的鼠抗人 p75NTR(CD271)抗体(BD),吉姆萨染液(Amresco)。CO2恒温细胞培养箱(Heal Force),倒置显微镜(Olympus),超净工作台(苏州净化),ELx800酶联免疫检测仪(BioTek),超速低温离心机(Sigma),流式细胞仪和FC 500 cytometers CXP分析软件(Beckman Coulter),37℃恒温水浴箱(华普达公司)。
2 方法
2.1 细胞培养 Eca-109细胞用含有10%胎牛血清、青霉素1×105U/L和链霉素100 mg/L的RPMI-1640培养基,置于37℃、5%CO2、饱和湿度的恒温培养箱中培养,根据细胞生长的速度及培养基的颜色更换培养基,一般为1~2 d换1次,用0.25%胰蛋白酶消化传代继续培养,选对数生长期细胞进行实验。
2.2 细胞免疫化学 取对数生长期的细胞,按5×107/L的细胞密度接种于6孔板中已灭菌处理的盖玻片上,每孔2 mL,孵育24 h后取出盖玻片,4%多聚甲醛固定,3%H2O2甲醇去除内源性过氧化酶活性,10%正常山羊血清封闭15 min,加入鼠抗人G3BPⅠ抗,4℃湿盒过夜,加入相应的Ⅱ抗,DAB显色,置于显微镜下观察,待显色充分后,流水冲洗终止反应。苏木素复染,盐酸乙醇分化,二甲苯透明,树胶封片,镜下观察,照相。G3BP蛋白阳性产物主要位于细胞浆,在×100倍视野下随机选取计数10个视野,×200镜头下在每个视野中连续计数100个癌细胞,进行免疫细胞化学显色计分,A:细胞浆无显色(0分);B:胞浆呈淡黄色云雾状(1分);C:胞浆呈黄色颗粒状(2分);D:胞浆呈均匀深褐色(3分),计数每个×400高倍视野下肿瘤细胞显色深浅(A、B、C和D)各占的百分数a、b、c和d,然后计算 A×a+B×b+C×c+D×d,取10个视野下的得分平均值,0~1.0 分者为弱阳性(+),1.0 ~1.5 分者为中等阳性(++),>1.5分者为强阳性 (+++)。
2.3 CCK-8法检测P162对Eca109细胞增殖抑制取对数生长期Eca109细胞以5×107/L密度接种于96孔培养板中,每孔100 μL,重复6孔,实验重复3次。置37℃、5%CO2培养箱中培养,次日加入不同浓度的 P162(2.5、5、10、20、40 μmol/L),同时设空白调零组及对照组,继续培养24、48、72 h后,每孔加入10 μL的CCK-8试剂,然后将培养板置于CO2培养箱中继续培养1 h,用酶标仪以450 nm处测定各孔吸光度(A)值,计算增殖抑制率(inhibitory rate,IR)。IR(%)=(1-实验组平均A值/对照组平均A值)×100%。
2.4 倒置显微镜观察P162对Eca109细胞形态学影响 取对数期贴壁生长状态良好的细胞,实验组细胞加入P162,使其终浓度为15 μmol/L,对照组细胞加入等量RPMI-1640培养液。于37℃培养箱中培养24、48、72 h后,显微镜下观察细胞形态学变化。
2.5 照射方法 将处于对数生长期的细胞给予0、2.5、5、10 μmol/L 四个浓度的 P162 培养48 h。在室温下采用Varian 2300直线加速器6MV-X线照射,吸收剂量率为1.5 Gy/min,表面加1.5 cm标准等效填充物,源至标本距离100 cm,照射野10 cm×10 cm,分别以0、2、4、6、8 Gy的剂量照射,每个剂量点下都有不同浓度处理的细胞受到照射。
2.6 集落形成实验 将按上述照射方法照射后的细胞在培养箱中放置4 h,使亚致死损伤得以修复,以0.25%胰酶消化,制成单细胞悬液,常规接种6孔板(2 mL/well),1 000 cells/well,每个用药浓度重复3孔,实验重复3次,置于37℃、5%CO2、饱和湿度的恒温培养箱中培养8~10 d,甲醇固定后吉姆萨染色,计数各组细胞数≥50个细胞的集落数。计算集落形成率(plating efficiency,PE)和细胞存活分数(surrival fraction,SF)。PE(%)= 集落数/接种细胞数×100%;SF(%)=各照射剂量PE/未照射PE×100%。采用SPSS统计软件的多靶单击模型SF=1 -(1 -e-D/D0)N拟合细胞剂量存活曲线[4],得出各组放射敏感性参数(N、D0、Dq、SF2和 SERDq):放射增敏比(SERDq)=单纯照射的Dq值/对照加药的Dq值。
2.7 流式细胞术检测食管癌干细胞标记物p75NTR的表达 以0.25%胰蛋白酶消化处于对数期生长的细胞,制成单细胞悬液,离心(1 000 r/min,5 min),细胞计数,用含2%胎牛血清的RPMI-1640培养液重悬为5×109/L的单细胞悬液。用PBS洗涤2次,离心(1 000 r/min,5 min),悬浮于100 μL 的 PBS 中,混匀后加入20 μL PE-CD271进行染色,避光孵育 25 min,加入500 μL鞘液过滤后上流式细胞仪检测,设PE同型对照,分析表达p75NTR细胞的比例。
3 统计学处理
采用SPSS 17.0统计软件分析,计量资料用均数±标准差(mean±SD)表示,多样本均数间比较采用单因素方差分析,两两比较采用LSD-t检验,以P<0.05为差异有统计学意义。集落形成实验采用多靶单击模型曲线拟合。
结 果
1 免疫细胞化学检测食管癌细胞Eca109中G3BP的表达
G3BP表达主要位于细胞浆,阳性表达情况见图1,根据上述免疫细胞化学染色评定办法,最终得到分值为1.920±0.346,可以认为食管癌细胞Eca-109中G3BP表达较高。
2 P162对食管癌细胞Eca109增殖的影响
P162对食管癌细胞Eca109增殖有明显抑制作用,随着 P162浓度的增大和处理时间的延长,Eca109细胞增殖抑制率增大(P<0.05),不同浓度及作用时间下的增殖抑制率情况见图2。
3 P162对Eca109细胞形态学的影响
未经处理的细胞贴壁,生长良好,圆形或不规则多边形,细胞透亮,如铺路石排列,见图 3A。15 μmol/L P162处理24 h后(图3B),单位面积细胞数量减少,细胞形态逐渐改变,由贴壁逐渐脱落,胞体回缩变圆,体积缩小,形态不规则或呈圆形,随时间延长此类细胞增多。处理48 h后(图3C)细胞较多漂浮,无光泽,内部结构不清楚,胞质内较多颗粒样及空泡状结构。72 h后(图3D)细胞变圆呈球形,体积明显增大,内部结构消失。
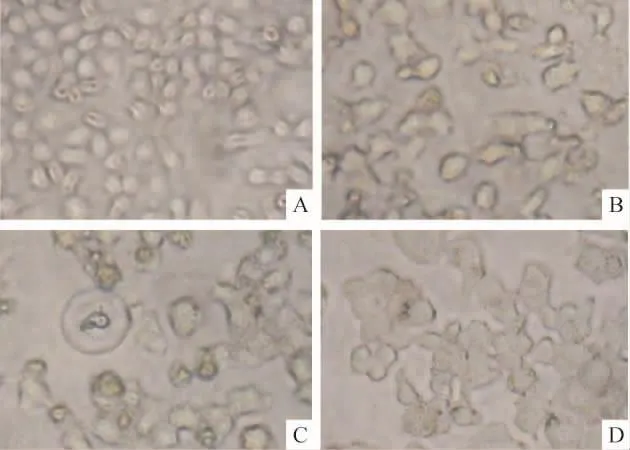
Figure 3.The cell morphology.A:untreated Eca109 cells;B:treated with 15 μmol/L P162 for 24 h;C:treated with 15 μmol/L P162 for 48 h;D:treated with 15 μmol/L P162 for 72 h.图3 细胞形态学观察
4 P162对Eca109细胞的放射增敏作用
在CCK-8实验中,P162对Eca109细胞的增殖抑制作用呈剂量依赖性,为了避免P162本身对Eca-109 细胞的抑制,采用 2.5、5、10 μmol/L P162 作为增敏剂量。单靶多击模型拟合细胞存活曲线见图4。根据克隆形成实验所得平均存活分数(SF),不同浓度的 P162处理后 D0、Dq 、N、SF2和 SERDq见表 1。不同浓度P162作用48 h后 D0、Dq、N、SF2和SERDq均低于对照组。

Figure 4.Survival curves of Eca109 cells treated with different concentrations of P162.图4 不同浓度P162作用Eca-109细胞的存活曲线

表1 各组放射生物学参数Table 1.Radiobiology parameters
5 食管癌干细胞p75NTR细胞的比例分析
根据克隆形成实验结果,经5 μmol/L P162作用48 h后的Eca109细胞对射线更为敏感,故本实验中采用5 μmol/L P162作用48 h后的Eca109细胞作为实验组,对照组为未经P162处理的细胞。当给予0、2、4、6、8 Gy的X线照射后,实验组和对照组中表达p75NTR细胞的比例见图5、表2。对照组中照射剂量与表达p75NTR细胞比例的相关系数r=0.992(P<0.01);实验组中照射剂量与表达p75NTR细胞比例的相关系数r=0.988(P<0.01),提示随着照射剂量的增加,两组p75NTR的百分率逐渐增加。各照射剂量下的实验组与对照组相比,表达p75NTR细胞的比例均有不同程度的减少(P<0.01)。
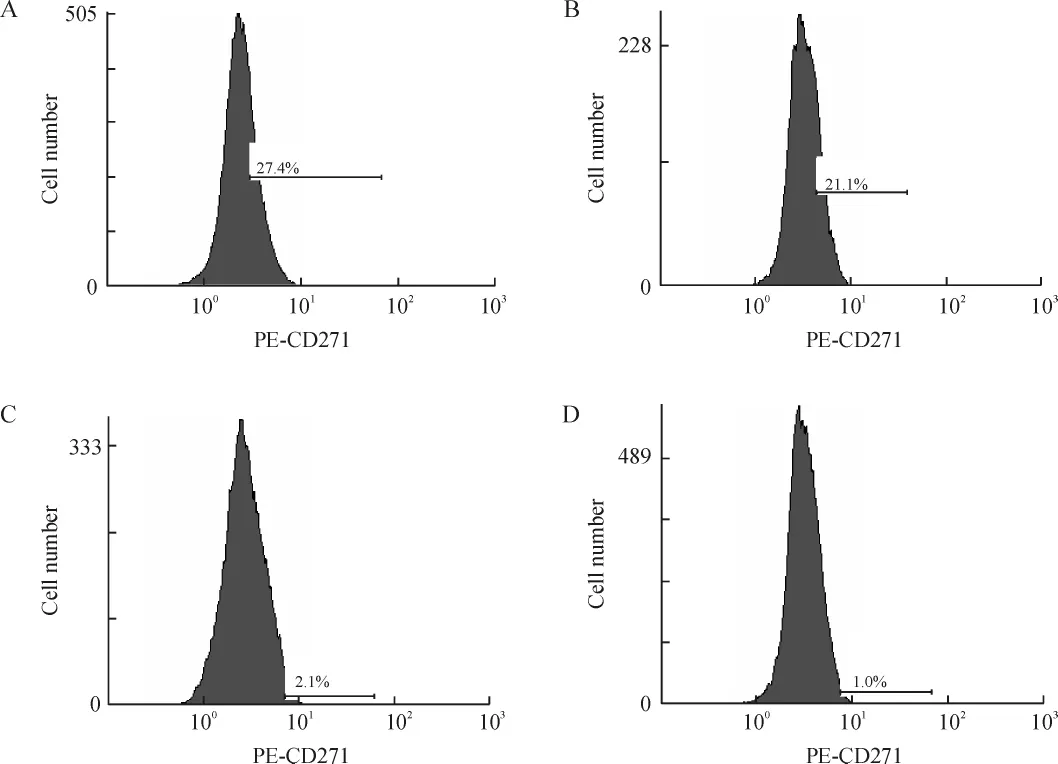
Figure 5.The proportion of the Eca109 cells expressing p75NTRdetected by flow cytometry.A:control group irradiated with 8 Gy;B:drug treatment group irradiated with 8 Gy;C:control group without irradiation;D:drug treatment group without irradiation.图5 FCM检测表达p75NTREca109细胞的比例
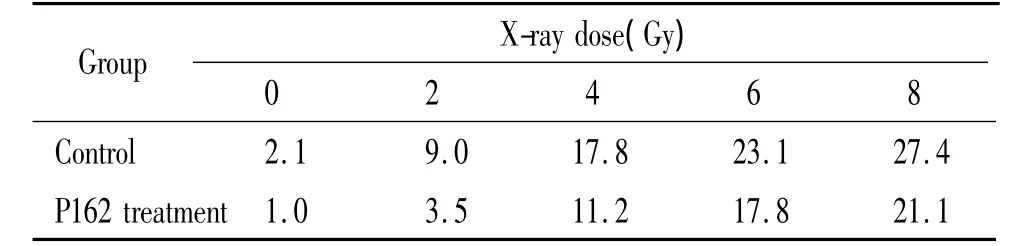
表2 5 μmol/L P162联合不同剂量X线后各组表达p75NTR Eca109细胞的比例Table 2.Effects of 5 μmol/L P162 with X-ray on proportion of the Eca109 cells expressing p75NTR(%)
讨 论
食管癌是消化道常见恶性肿瘤之一,发展迅速且预后较差。全世界每年约有48万新发病例,其发病率占全部恶性肿瘤的第8位[5]。食管癌确诊时往往已到晚期,已发生转移,且波及范围过大,无法进行手术切除,放疗则成为晚期治疗最重要的手段,然而大量临床数据表明放疗后大约有68%的食管癌会复发[6]。放射抗拒被认为是放疗失败及肿瘤局部复发的重要原因。增加肿瘤细胞的放射敏感性成了近些年研究的热点[7]。
目前针对肿瘤的放射增敏剂主要包括乏氧细胞放射修饰剂、非乏氧细胞增敏剂、细胞毒性药物、生物治疗剂、基因治疗、中药等。但是针对G3BP蛋白靶向治疗的增敏剂尚未见报道。P162是基于全新药物靶标G3BP蛋白、利用计算机辅助药物设计方法筛选到的一条全新肽序列,其结构能与G3BP蛋白的NTF2蛋白域发生特异性结合,并能干预G3BP蛋白的功能磷酸化。实验证实,P162对G3BP高表达的结肠癌HCT116具有选择性杀死作用,并能够增强顺铂等多种细胞毒素的抗癌效应、促进肿瘤细胞凋亡,而对正常细胞无影响[3]。
本次实验以高表达G3BP的食管癌细胞Eca-109为研究对象,先用CCK-8法检测不同浓度P162对食管癌细胞Eca109增殖抑制率影响,结果显示P162能抑制食管癌Eca109细胞的增殖,并且在一定的浓度范围内呈时间和剂量依赖性。集落形成实验中,N值(外推值)是曲线的指数部分外延到Y轴的截距,代表所需击中靶的次数和(或)细胞内靶的个数,可以用来反映细胞对放射损伤的修复能力,如果N增大则表示细胞的修复能力增强,那么杀死细胞的放射剂量需要增大,放射抗拒性就增强;D0值,又称为细胞的平均致死剂量,是存活曲线直线部分斜率的倒数,表示能使曲线指数区下降63%所需的放射剂量,如果D0值越大,则放射抗拒性就越强;Dq值,又称准域剂量,是由纵坐标1.0处作一条与横坐标相平行的平行线,与外推线相交后的在横坐标上交点的投影点的数值,代表了细胞受损所需的准阈剂量,如果Dq值增大,则细胞存活曲线的肩区增宽,放射抗拒性就增强;SF代表受到剂量照射的存活分数,2 Gy时的存活分数SF2是代表细胞放射敏感性的重要指标,如果SF2值越大,那么放射抗拒性就越强[8]。不同浓度P162作用48 h后 D0、Dq、SF2和 SERDq均低于对照组,证实P162可增加Eca109细胞对放射的敏感性,即对食管癌细胞有放射增敏作用。为初步探讨其放疗增敏机制,以食管癌干细胞为研究切入点。
肿瘤干细胞(cancer stem cells)是肿瘤中具有自我更新并能产生异质性肿瘤细胞的细胞,与肿瘤的化疗耐药和放射抗拒[1]有关。Zhang等[9]通过对食管癌抗拒细胞株Seg-1R及TE-2R干细胞的研究,发现抗拒细胞株中干细胞表达增加。目前国内外先后均有学者通过对p75NTR阳性细胞生物学特性及其成瘤性进行研究,发现p75NTR阳性细胞具有无限增殖、自我更新和多向分化能力等肿瘤干细胞特性,认为其可能为食管癌干细胞的表面标记[10-12],所以本实验选用食管癌干细胞p75NTR流式分选法分离出食管癌干细胞,在前期也运用此方法做过类似研究[13]。流式细胞术检测发现随着照射剂量的增加,表达p75NTR细胞的比例呈增加趋势,证实食管癌干细胞与食管癌放射抗拒有关。在各照射剂量下,P162联合照射组与单纯照射组相比,表达p75NTR阳性细胞的比例明显低于对照组,说明P162联合放疗对食管癌干细胞有抑制作用。本次实验初步证实P162对食管癌Eca109细胞有显著的放疗增敏效果,能抑制食管癌干细胞p75NTR表达。但其具体机制仍有待我们后续研究。
[1] Pajonk F,Vlashi E,McBride WH.Radiation resistance of cancer stem cells:the 4 R's of radiobiology revisited[J].Stem Cells,2010,28(4):639-648.
[2] Okumura T,Shimada Y,Imamura M,et al.Neurotrophin receptor p75NTRcharacterizes human esophageal keratinocyte stem cells in vitro[J].Oncogene,2003,22(26):4017-4026.
[3] Zhang H,Zhang S,He H,et al.RasGAP-derived peptide 38GAP potentiates the cytotoxicity of cisplatein through inhibitions of Akt,EPK and NF-κB in colon carcinoma HCT116 cells[J].Cancer Lett,2011,308(1):62-70.
[4] 李运明,封宗超,李小凯,等.应用SPSS实现辐射剂量存活曲线的拟合[J].数理医药学杂志,2009,22(3):260-262.
[5] Siersema PD,van Hillegersberg R.Treatment of locally advanced esophageal cancer with surgery and chemoradiation[J].Curr Opin Gastroenterol,2008,24(4):535-540.
[6] Wong R,Malthaner R.Combined chemotherapy and radiotherapy(without surgery)compared with radiotherapy alone in localized caicinoma of the esophagus[J].Cochrance Database Syst Rev,2010,(1):CD002092.
[7] 朱 睿,吴清明,龙 辉,等.食管癌放射抗拒与P-gp、HER-2及microRNA-296表达的相关性[J].中国病理生理杂志,2012,28(3):550-552,564.
[8] Harms-Ringdahl M,Nicotera P,Radford IR.Radiation induced apoptosis[J].Mutat Res,1996,366(2):171-179.
[9] Zhang X,Komaki R,Wang L,et al.Treatment of radioresistant stem-like esophageal cancer cells by an apoptotic gene-armed,telomerase-specific oncolytic adenovirus[J].Clin Cancer Res,2008,14(9):2813-2823.
[10] 孙志刚,黄盛冬,张宝仁,等.食管肿瘤干细胞的分选及鉴定的实验研究[J].中华医学杂志,2009,89(5):291-295.
[11] Reya T,Morrison SJ,Clarke MF,et al.Stem cells,cancer and cancer stem cells[J].Nature,2001,414(6859):105-111.
[12] Okumura T,Tsunoda S,Mori Y,et al.The biological role of the low-affinity p75 neurotrophin receptor in esophageal squamous cell carcinoma[J].Clin Cancer Res,2006,12(17):5096-5103.
[13] 李 珂,龙 辉,吴清明,等.钼对人食管癌细胞ECA-109的化疗增敏作用及对食管癌干细胞p75NTR的影响[J].世界华人消化杂志,2012,20(11):959-963.

