不同维生素免疫调节作用在鼠疟模型中的实验观察
杨志蕃,延 娟,刘 军,曹雅明,王庆辉*
(1.沈阳军区总医院肾内科,辽宁 沈阳 110016;2.中国医科大学基础医学院免疫学教研室,辽宁 沈阳 110001)
疟疾是疟原虫通过媒介昆虫蚊传播的人类最严重的寄生原虫感染性疾病。最新数据显示,目前全世界有109个国家发生疟疾流行,2.7亿人感染,导致近100万人死亡[1]。健全的免疫系统对抵御疟原虫感染至关重要。免疫系统的正常运行依赖于免疫细胞间信号的有效传递。在机体抵御外来感染时,免疫细胞产生大量氧自由基抵御感染。同时,大量的氧自由基也损伤了自身的免疫细胞。抗氧化剂则能去除自由基,终止连锁反应并且抑制其他氧化反应。补充抗氧化剂对于癌症、冠心病等疾病具有一定的预防作用。VA、VC和VE是饮食中的重要成分,同时也是重要的抗氧化剂。VA是最早被发现的维生素,作为复杂机体必需的一种营养素,几乎能以不同方式影响机体的一切组织细胞。VC是细胞内和细胞外的抗氧化剂,文献报道[2],给动物补饲高水平VC后,T淋巴细胞的增殖能力和吞噬细胞的吞噬作用加强,同时细胞因子的产生增加,体内抗体水平上升,从而有利于疾病的恢复。然而,多年来抗氧化剂在抗疟原虫感染过程中的作用一直存有争议。研究发现,补充具有抗氧化活性的维生素,可有效减轻疟疾的感染[3-4],但也有研究显示其不能有效阻止疟原虫的增殖[5-6]。目前,关于不同抗氧化剂和疟疾之间的相关免疫机制尚不清楚。为此,本研究利用已成功建立的 P.y17XL易感鼠疟模型,动态地观察了VA、VC和VE对P.y17XL易感小鼠免疫应答的影响,以期明确其在P.y17XL感染早期的免疫调节作用及其相关机制。
1 材料与方法
1.1 材料
1.1.1 实验动物及疟原虫 6~8周龄、雌性BALB/c小鼠由中国医学科学院实验动物研究所提供 (许可证编号:SCXK京 200420001);P.y17XL(日本爱媛大学分子寄生虫学教研室惠赠)。
1.1.2 主要试剂 FITC-anti-CD11c(clone HL3, BD Pharmigen)、 PE-anti-CD11b(clone M1/70,BD Pharmigen)、percp-anti-CD45R/B220(clone RA3-6B2,BD Pharmigen)、biotinylated anti-TLR9(clone 5G5,hycultbiotech)和PE-conjugated streptavidin(clone streptavidin,Biolegend)、PE-anti-MHCⅡ (M5/114.15.2,eBioscience)、FcⅢ/Ⅱ封闭抗体 (clone 2.4G2,BD Pharmigen)、VA、VC、VE(Sigma)。
1.2 方法
1.2.1 实验动物感染 BALB/c小鼠分别经腹腔感染 1×106P.y17XL寄生的红细胞(pRBC),感染不同时间小鼠经尾静脉采血,制备薄血膜,Giemsa染色,镜检计数红细胞感染率,并每日观察生存率。
1.2.2 动物分组与药物处理 BALB/小鼠随机分为5组:大豆油处理组 (NC1组)、生理盐水处理组 (NC2组)、50 mg/kg VA处理组 (VA组)、1 g/只VC处理组 (VC组)和600 mg/kg VE处理组 (VE组),VA、VE溶解于大豆油中,VC溶解于生理盐水中,分别于感染前10 d连续每天灌胃0.2 mL/只。
1.2.3 流式细胞仪检测 无菌取出感染前(0 d)和感染后第3、5天小鼠脾脏,常规方法制备脾细胞悬液,用0.17 mol/L NH4Cl裂解红细胞。以含10%胎牛血清(FCS)的RPMI 1640调整脾细胞终浓度为1×107/mL。为检测DCs亚群及MHCⅡ分子的表达,取0.1 mL细胞悬液经FcrⅢ/Ⅱ封闭抗体避光封闭30 min后,分别加入FITC-anti-CD11c、 PE-anti-CD11b、 Percp-anti-CD45R/B220或 者 FITC-anti-CD11c、PE-anti-MHCⅡ,4℃避光染色30 min,经流式细胞仪检测;为检测TLR9的表达,经FcrⅢ/Ⅱ抗体封闭的脾细胞悬液用FITC-anti-CD11c标记后,固定透膜,再用biotinylated anti-TLR9和 PE-conjugated streptavidin标记细胞,并进行流式细胞仪检测。
1.2.4 统计学分析 使用SPSS 17.0统计软件对数据进行处理,采用独立样本t检验对数据做统计分析,P<0.05具有统计学意义。
2 结果与分析
2.1 疟原虫感染后原虫血症水平和生存率
如图1A所示,感染后第3天,各组小鼠原虫血症水平均为2%~5%。随后,与对照组小鼠相比,VA和VE组小鼠原虫血症水平显著升高,感染后第6天高达70%左右;而VC组小鼠原虫血症水平显著低于对照组。同时,如图1B所示,NC1对照组小鼠在感染后第6天的生存率为70%,VE组生存率为30%,2组小鼠均于第7天全部死亡,VA组小鼠的生存率在感染后第5天只有30%,并于第6天全部死亡;NC2组小鼠在感染后第6天全部死亡,而VC组在感染后第6天生存率为100%,于第7天全部死亡。由此提示,VC可降低小鼠的原虫血症水平,延长生存率,而VA和VE则升高小鼠的原虫血症水平,降低生存率。

图1 P.y17XL感染后不同时间的感染率 (A)和生存期 (B)Fig.1 The parasitemia(A)and survival rate(B)at different time points after P.y17XL infection
2.2 疟原虫感染后不同时间小鼠脾脏DCs亚群的数量
如图2A所示,与感染前相比,各组小鼠pDCs的数量于感染后第3天开始升高,第5天达到峰值。与各自对照组相比,VA和VE组小鼠脾pDCs(CD11c+CD45R/B220+DCs)的数量显著降低,而VC组小鼠脾pDCs的数量在感染后第5天显著升高。如图2B所示,各组小鼠mDCs(CD11c+CD11b+DCs)的数量的变化与pDCs的变化相似,VA和VE组小鼠脾mDCs显著低于对照组,而VC组则高于对照组。
2.3 疟原虫感染后不同时间脾脏CD11c+DCs细胞TLR9的表达水平
如图3所示,与感染前相比,各组小鼠TLR9的表达水平于感染后第5天出现有意义的升高。与各自对照组相比,感染后第5天,VC组TLR9的表达显著升高,而VA和VE组则明显降低。
2.4 疟原虫感染后不同时间脾脏CD11c+DCs细胞MHCⅡ的表达水平
如图4所示,感染后第5天,VA和VE组小鼠DCs细胞的MHCⅡ分子的表达显著低于对照组,而VC组小鼠DCs细胞的MHCⅡ表达水 平显著高于对照组。
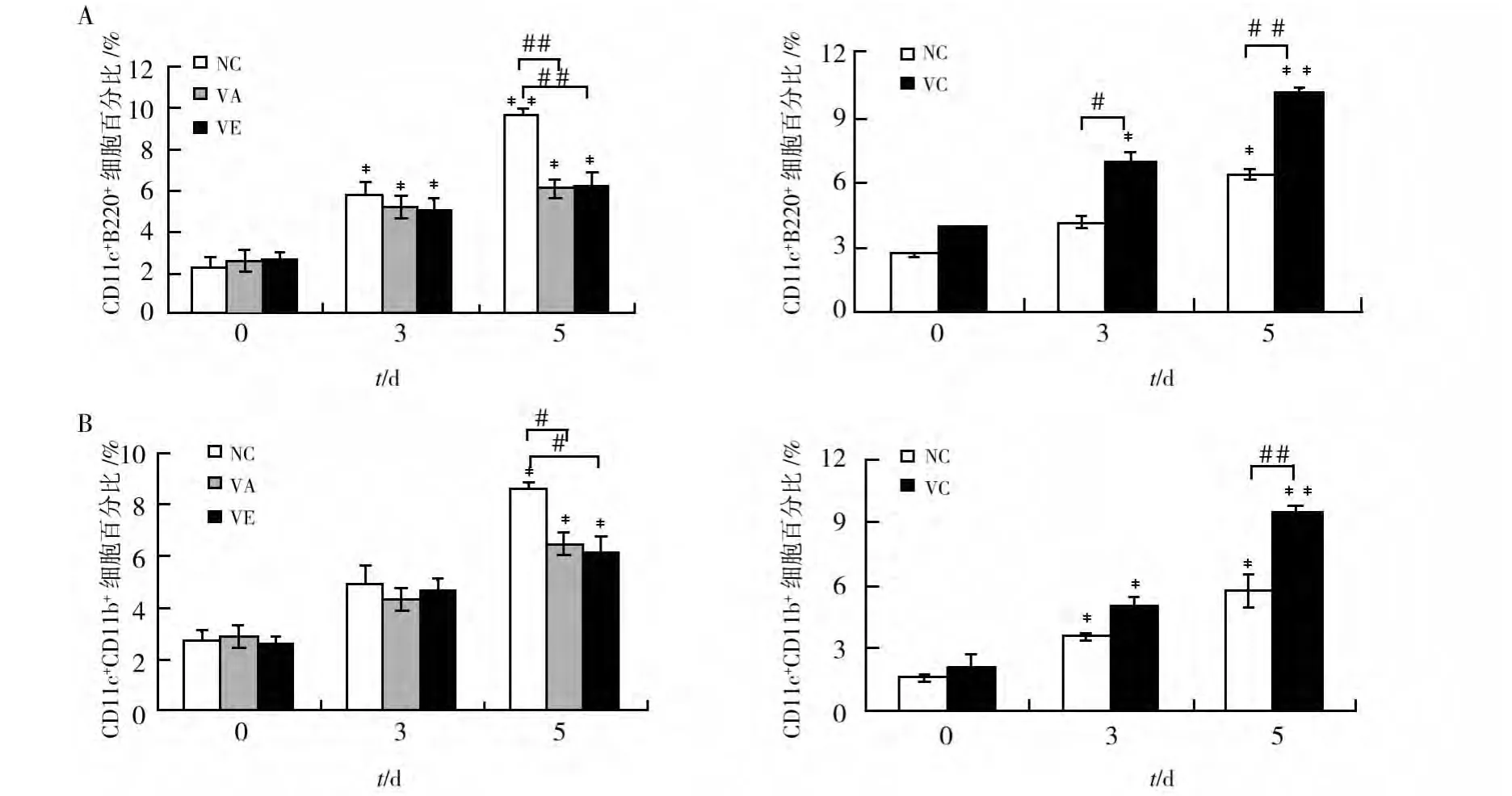
图2 P.y17XL感染后不同时间小鼠脾pDCs(CD11c+CD45R/B220+)和mDCs(CD11c+CD11b+)亚群的变化Fig.2 The percentage of spleen pDCs(CD11c+CD45R/B220+)(A)and mDCs(CD11c+CD11b+)(B)at different time points after P.y17XL infection
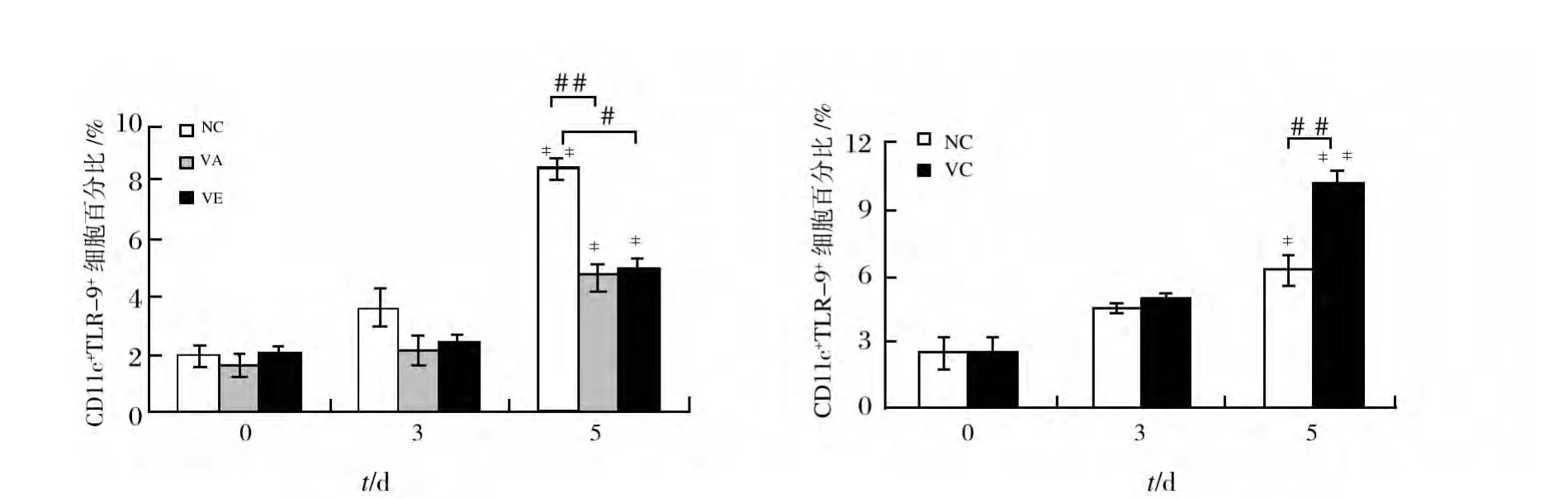
图3 P.y17XL感染后不同时间小鼠脾CD11c+TLR9+DCs的变化Fig.3 The percentage of spleen CD11c+TLR9+DCs at different time points after P.y17XL infection

图4 P.y1717XL感染后不同时间小鼠脾CD11c+MHCⅡ+DCs的变化Fig.4 The percentage of spleen CD11c+MHCⅡ+DCs at different time points after P.y17XL infection
3 讨 论
疟原虫感染后,宿主的免疫应答发生时相和强度明显影响着感染进程和最终结局。我们前期的研究结果表明,BALB/c感染P.y17XL后不能有效地建立Th1免疫应答控制红内期疟原虫的爆发性增殖,进而导致小鼠死亡[7]。因此,诱导有效的抗疟免疫十分重要。本研究通过对P.y17XL易感的BALB/c小鼠进行3种具有抗氧化活性的维生素预处理,结果发现,VC补充后,感染率和死亡率均降低;然而,补充VA、VE后,感染率和死亡率均升高,进一步加重疟疾感染。
作为活化初始T细胞的唯一抗原提呈细胞-DCs,在固有和适应性免疫应答协调建立过程中起到了关键的桥梁作用[8]。同时,TLR是固有免疫系统的重要组成成分,在许多感染性疾病中TLR是识别入侵病原微生物(包括原虫)、介导固有免疫细胞活化的重要模式识别受体[9]。DCs可通过TLR识别不同的病原微生物,进而诱导免疫应答的建立[10]。本研究结果显示,补充VC可增加DCs亚群的数量,并提高TLR-9及MHCⅡ的表达,进而促进DCs的活化,进一步强化Th1免疫应答,推迟感染进程。然而,补充VA、VE则抑制DCs的数量和功能,进一步加剧感染。
综上所述,在疟疾感染中,不是所有具有抗氧化活性的维生素均能够抑制疟疾的发生发展,有针对性地正确选择抗氧化剂,才能有效地调控疟原虫感染进程。
[1]World Health Organization.World malaria report:2010[J].Geneva:World Health Organization,2010:205.
[2]Shankar,A.H..Nutritional modulation of malaria morbidity and mortality[J].J Infect Dis,2000,182(Suppl 1):S37-53.
[3]Davis,T.M.,T.S.Skinner-Adams,J.Beilby.In vitro growth inhibition of Plasmodium falciparum by retinol at concentrations present in normal human serum[J].Acta Trop,1998,69(2):111-119.
[4]Aghedo,FI,Shehu RA,Jiya MN,et al.Antioxidant vitamin levels among preschool children with uncomplicated Plasmodium falciparum malaria in Sokoto,Nigeria[J].J Multidiscip Healthc,2013,6:259-263.
[5]Levander OA,Ager AL Jr.Malarial parasites and antioxidant nutrients[J].Parasitology,1993,107(Suppl):95-106.
[6]Samba D.C.,Basco L.K.,Bleiberg-Daniel F.,et al.Absence of effect of retinol on the in vitro development of Plasmodium falciparum[J].Int J Vitam Nutr Res,1992,62(1):99-100.
[7]Langhorne J,Albano FR,Hensmann M,et al.Dendritic cells,pro-inflammatory responses,and antigen presentation in a rodent malaria infection[J].Immunol Rev,2004,201:35-47.
[8]Banchereau J,Steinman RM.Dendritic cells and the control of immunity[J].Nature,1998,392(6673):245-252.
[9]Coban,C,Ishii KJ,Kawai T,et al.Toll-like receptor 9 mediates innate immune activation by the malaria pigment hemozoin[J].J Exp Med,2005,201(1):19-25.
[10]André Boonstra,Carine Asselin-Paturel,Michel Gilliet,et al.Flexibility of mouse classical and plasmacytoid-derived dendritic cells in directing T helper type 1 and 2 cell development:dependency on antigen dose and differential toll-like receptor ligation[J].J Exp Med,2003,197(1):101-109.

