穿膜素TAT介导的KDR-siRNA慢病毒载体的构建及其靶向肺癌A549细胞的抗肿瘤作用
郑 旭,张简丽,任 玥,王 杰*
(1.沈阳市和平区疾病预防控制中心,辽宁 沈阳 110034;2.沈阳医学院附属卫生学校,辽宁 沈阳 110034;3.沈阳医学院 继续教育学院,辽宁 沈阳 110034)
KDR(Kinase domain receptor,激酶功能区受体)作为血管内皮生长因子(human vascular endothelial growth factor,VEGF)最为重要的受体之一,在促进癌生长、发展、转移中起着重要作用[1]。前期研究中,本课题组利用质粒载体和三代慢病毒载体系统成功构建了靶向KDR的RNA干扰重组体,并有效抑制了肝癌细胞株HHCC、HepG2、Hep-6细胞株和小细胞型肺癌A549细胞株KDR基因的表达和遏制了肿瘤的生长和转移[2-3]。但是靶向KDR的RNA干扰重组体存在着在宿主细胞感染效率低,难以穿透肿瘤细胞生物屏障,毒性作用大且易造成细胞损伤甚至死亡等问题,限制了其在肿瘤治疗中的广泛应用。TAT(transcriptional activator of transcription)是一种新近发现的具有蛋白转导功能且能够高效穿膜的短肽,为人类免疫缺陷性病毒(HIV)的重要转录因子[4]。研究表明,TAT可将携带的siRNA、蛋白质DNA及治疗性药物高效、快速地进入体外培养的细胞和体内组织中,甚至可以透过血脑屏障,具有速度快,不依赖于温度、能量、细胞膜抗体,且对细胞无毒性损伤等特点[5]。此外,TAT的核心区域仅有10个氨基酸(YGRKKRRQRRR),分子量小,不会增加机体对转导蛋白质的免疫排斥反应[6]。因此,TAT是一种很有前途的生物活性分子转导细胞的运载工具。本研究构建了TAT与KDR靶向siRNA的融合基因慢病毒载体,将TAT的穿膜作用与KDR siRNA的抗肿瘤作用相结合,通过体外实验研究,观察其对肿瘤细胞的穿膜作用和抗肿瘤效果,为抗瘤药物KDR siRNA的研发和临床肿瘤治疗提供一个新思路。
1 材料与方法
1.1 材料
靶向KDR基因的siRNA质粒载体(KDR-siRNA)、DH5α菌种、肺癌细胞株A549为本室保存。各种限制性内切酶、T4 DNA连接酶、DNA电泳胶回收、质粒抽提试剂盒购自大连TaKaRa公司;SYBR Green Real-Time PCR试剂盒、PCR试剂盒和大量质粒 DNA抽提试剂盒购自Qiagen公司;KDR单克隆抗体和二抗 (羊抗鼠)购自 R&D公司;DNA序列测定和引物合成由大连TaKaRa公司完成;RPMI1640培养液和新生小牛血清购自Hyclone公司。
1.2 方法
1.2.1 TAT的合成 按照TAT蛋白转导区48~60位氨基酸(YGRKKRRQRRR)的序列,人工合成编码TAT-PTD的2条寡核苷酸链。正义链将2条寡核苷酸链等摩尔混合,在95℃变性10 min后,置于72℃水浴中缓慢退火过夜,得到编码TAT-PTD的双链DNA。

1.2.2 pGC/TAT-KDR siRNA载体的构建及鉴定提取 pGC/KDR siRNA质粒 DNA,用 NheⅠ和EcoRⅠ分别对质粒和编码TAT-PTD的双链DNA进行双酶切并回收酶切产物。用T4 DNA连接酶在16℃条件下连接过夜。连接产物转化感受态细胞DH5α,接种至含有100 μg/mL Amp的 LB平板上,37℃培养过夜。次日挑选单克隆菌落进行菌落PCR,阳性克隆提取质粒DNA送检测序。测序结果经Blast比对,与理想序列相同,证实pGC/TAT-KDR siRNA载体构建成功。菌落PCR primer:正义链 5'-GCCCCGGTT AATTTGCATAT-3';反 义 链 5'-GTA ATACGGTTATCCACGCG-3'。反应条件:95℃ 5min预变性,循环内95℃变性30 s,58℃退火30 s,72℃ 延伸30 s,PCR反应30个循环后72℃ 10 min,然后4℃保存。
1.2.3 慢病毒载体包装和病毒滴度测定 参照文献[2]方法,将pGC/TAT-KDR siRNA重组质粒和慢病毒包装质粒室温下温育5 min后共转染至293T细胞培养8 h。更换含10%小牛血清的完全培养液并继续培养48 h。离心后留取富含慢病毒颗粒细胞的上清液。病毒滴度用倍比稀释法检测。
1.2.4 细胞培养、转染 收集对数生长期A549细胞2×105/mL,以2×103个/孔接种至96孔板,每孔体积200 μL。培养24 h后更换无血清培养液,并分组:①pGC/TAT-KDR siRNA组;②pGC/KDR siRNA组;③未转染组(每组设3个复孔)。各组中分别加入10 MOI的pGC/TAT-KDR siRNA重组病毒、pGC/KDR siRNA重组病毒和等量PBS,感染2 h后更换含10%新鲜小牛血清的培养液,待用。
1.2.5 Western blotting检测KDR蛋白质表达水平 将转染的3组细胞去掉培养基,1 mL预冷PBS洗涤2次,加入全蛋白裂解液后冰上裂解10 min。用细胞刮刮下全蛋白裂解液,收集于离心管。总蛋白样品各50 μg和5×SDS上样缓冲液混匀后,100℃沸水煮5 min。常规进行Western blot分析。一抗稀释比例为1∶3000,二抗稀释比例为1∶6000。具体方法详见文献[2]。
1.2.6 实时荧光定量PCR检测KDR mRNA表达水平 Trizol抽提各组总 RNA,反转录为 cDNA。按照试剂说明书配好反应体系,上机进行Real Time PCR扩增和检测。反应总体系为20 μL:2×Mix SYBR Green I荧光反应液 10 μL、上下游引物(10 μmol/L)各 0.25 μL、样品模板 1 μL、灭菌水补足。反应条件:95℃预变性2 min,循环内95℃ 30 s变性,60℃退火35 s,PCR反应设置40个循环,并在每个循环延伸末端点收集荧光信号,绘制扩增曲线;40个循环后设置(95℃ 15 s,60℃30 s,95℃ 15 s)反应步骤,并且对60~95℃ 升温整个过程进行全程荧光信号收集,绘制融解曲线。根据标准定量曲线进行PCR产物的定量分析。以β-actin为内参照。引物情况见表1。

表1 PCR引物序列Table 1 The sequence of PCR primers
1.2.7 MTT比色法测定重组病毒对肿瘤细胞的杀伤作用 每间隔24 h向96孔板中加入5 mg/mL MTT溶液,每孔20 μL,将96孔板置37℃、5%CO2培养箱继续培养4 h;吸去上清,每孔加入150 μL DMSO置摇床上低速振荡10 min,使结晶物充分溶解。酶联免疫检测仪测量各孔的吸光值(波长492 nm)。
1.2.8 AnnexinV-FITC/PI双染法流式细胞仪检测转染细胞凋亡 用无EDTA的0.25%胰蛋白酶收集上述各组细胞,离心2000 r/min、5 min,沉淀以无菌PBS冲洗,离心2000 r/min、5 min,重复2次。沉淀以200 μL binding buffer重悬后加入2 μL AnnexinV-FITC和5 μL PI。流式细胞仪检测凋亡率(激发波长488 nm,AnnexinV标记细胞和PI标记细胞的发射波长分别为525 nm和620 nm)。结果判定:AnnexinV-FITC标记细胞计数凋亡的细胞,PI标记细胞计数坏死的细胞,AnnexinV和PI双标记的细胞计数晚期凋亡的细胞,AnnexinV和PI都无标记的细胞计数为活细胞。在双变量流式细胞仪的散点图上,左下象限显示活细胞,为(AnnexinV-FITC-/PI-);右上象限是非活细胞,即坏死细胞,为(AnnexinV-FITC+/PI+);右下象限为凋亡细胞,显现(AnnexinV-FITC+/PI-)。
1.2.9 Transwell侵袭实验 将4℃过夜溶解的Matrigel,用无血清Medium按1∶9比例稀释,每个Transwell小孔加入50 μL稀释后的 Matrigel,37℃培养3 h。消化收集对数生长期的各组细胞,以无血清Medium调整细胞浓度为1×105/mL,每个Transwell小室内加入细胞悬液200 μL,即每个小室含2×104个细胞。孔外加10%FBSMedium 500 μL,放入培养箱继续培养;24 h后,取出Transwell小室,吸出孔内的 Matrigel,PBS洗2次。用小棉签拭去Transwell孔内的cell和Matrigel。用甲醇∶冰乙酸=3∶1固定膜上的细胞。1×PBS洗1次,苏木素复染30 min,自来水漂洗。在镜下随机选取5个视野,对每个视野中的细胞数进行计数并计算平均值。
1.2.10 统计学方法 所有数据用χ±S表示,采用SPSS11.0统计学软件包进行处理,多组间比较采用均值方差分析,P<0.05为有统计学意义。
2 结果与分析
2.1 pGCTAT/KDR siRNA载体的构建及鉴定
对pGCTAT/KDR siRNA质粒载体和编码TAT-PTD的双链DNA分别用NheⅠ和EcoRⅠ进行双酶切,并纯化酶切产物。经T4 DNA连接酶连接后转化DH5α细胞,接种至含有新霉素的LB平板培养过夜。挑选单克隆菌落进行菌落PCR,1%琼脂糖凝胶电泳分析显示,各克隆菌落的PCR产物均可见目的基因条带(图1),初步筛选到具有插入片段的克隆。将菌落PCR初步鉴定的阳性克隆送检测序并进行Blast比对。测序结果显示pGCTAT/KDR siRNA载体的插入序列与设计序列一致,没有碱基缺失或替换等(结果未显示)。提示 pGCTAT/KDR siRNA载体构建成功。

图1 菌落PCR结果Fig.1 The results of cloning PCR
2.2 慢病毒载体的包装
将pGCTAT/KDR siRNA重组质粒和慢病毒包装质粒共转染293T细胞,培养后离心,留取富含慢病毒颗粒细胞的上清液。倍比稀释法测定病毒滴度为2.9×108Tu/mL,符合后续实验的要求。
2.3 Western blotting检测 KDR蛋白质表达水平
将收集对数生长期A549细胞以2×103个/孔接种至96孔板,并分组:①pGC/TAT-KDR siRNA组;②pGC/KDR siRNA组;③未转染组(每组设3个复孔)。各组中分别加入10 MOI的pGC/TAT-KDR siRNA重组病毒、pGC/KDR siRNA重组病毒和等量PBS进行感染并加入全蛋白裂解液后冰上裂解、回收,常规进行Western blot分析,结果见图2。对照组存在较高水平的KDR蛋白表达,而 pGC/TAT-KDR siRNA组和 pGC/KDR siRNA组KDR蛋白质表达水平均显示明显抑制,有显著性差异,其中pGC/TAT-KDR siRNA组细胞的抑制效果最强。
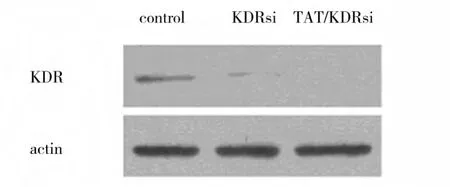
图2 KDR蛋白质表达水平Fig.2 The expression level of KDR protein by western blotting
2.4 实时荧光定量PCR检测KDR mRNA表达水平
实时荧光定量PCR检测各组细胞KDR mRNA表达水平。由图3可见,pGC/TAT-KDR siRNA组和pGC/KDR siRNA组与对照组相比,KDR mRNA表达水平均有显著下降,有统计学意义(P<0.01),且 pGC/TAT-KDR siRNA 组与 pGC/KDR siRNA组相比,KDR mRNA表达水平下降更显著,有统计学意义(P<0.01)。
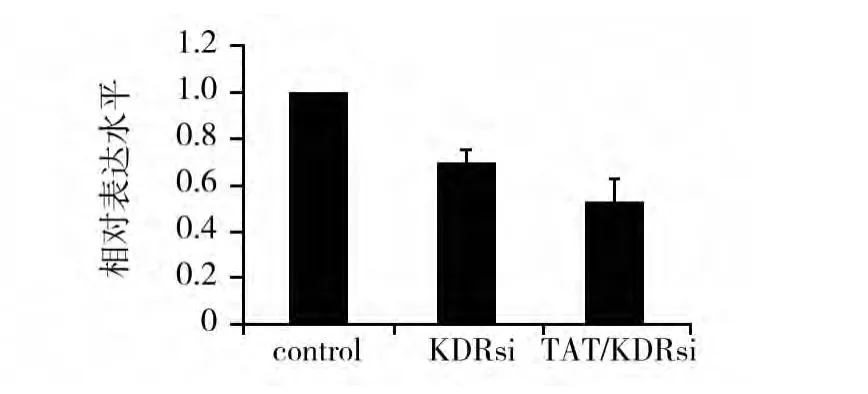
图3 KDR mRNA表达水平Fig.3 The expression level of KDR mRNA by Real-time quantitative PCR
2.5 流式细胞仪检测细胞凋亡

图4 AnnexinV-FITC/PI双染法流式细胞仪检测转染细胞凋亡Fig.4 The cellular apoptosis detection with Double staining by flow cytometry
将各实验组和对照组细胞用Annexin-V和PI染色双染色后,分析细胞凋亡。由图4可见,各组的细胞凋亡率分别为对照组(3.37±0.12)%、pGC TAT/KDR siRNA 组(49.43 ±1.87)%、pGC KDR siRNA 组(40.82 ±1.36)%。pGC TAT/KDR siRNA组和pGC KDR siRNA组与对照组相比,细胞凋亡有显著差异,P<0.01。pGC TAT/KDR siRNA组的细胞凋亡率明显高于pGC KDR siRNA组,P<0.05。说明 pGC TAT/KDR siRNA 组和pGC KDR siRNA组均有促进细胞凋亡的作用,其中pGC TAT/KDR siRNA组的作用更强。
2.6 Transwell侵袭实验
本研究采用Transwell实验观察了pGC TAT/KDR siRNA和pGC KDR siRNA慢病毒载体对A549细胞组侵袭、转移的影响。实验结果显示,对照组细胞数为(202.67±8.50)个,pGC KDR siRNA 组为(91.33 ±7.64)个,pGC TAT/KDR siRNA 组为(36.19±5.29)个。pGC KDR siRNA组和pGC TAT/KDR siRNA组均明显抑制了A549细胞的侵袭、转移(P<0.01),特别是 pGC KDR siRNA组抑制A549细胞侵袭、转移的作用远远高于pGC KDR siRNA(P<0.01)。说明 pGC TAT/KDR siRNA慢病毒载体具有更强的抑制细胞转移和侵袭的能力(图5)。

图5 pGC TAT/KDR siRNA慢病毒载体抑制细胞侵袭、转移的作用Fig.5 The inhibition of cell invasion and metastasis by PGC TAT/KDR siRNA lentiviral vector
2.7 MTT法检测pGC TAT/KDR siRNA慢病毒载体对细胞增殖的影响
结果显示,pGC TAT/KDR siRNA和 pGC KDR siRNA在转染 A549细胞72、96 h后,A549细胞的生长受到明显抑制,且pGC TAT/KDR siRNA抑制细胞增殖的作用更为明显。说明pGC TAT/KDR siRNA比pGC KDR siRNA有更强的细胞增殖抑制作用(图6)。

图6 pGC TAT/KDR siRNA抑制细胞增殖的作用Fig.6 The inhibition of cell proliferation by pGC TAT/KDR siRNA lentiviral vector
3 讨论
自1997年Vives等[7]首次发现TAT蛋白是一个与蛋白转导功能相关的多肽片段以来,TAT结构、功能的研究取得了突破性进展。目前研究表明,TAT蛋白由酸性N-末端区、半胱氨酸(Cys)富积区、核心区、基本区和C-末端区5个区构成。其中基本区中的47~57位氨基酸的多肽片段富含碱性氨基酸的(YGRKKRRQRRR)是蛋白转导功能的最小单位,称为蛋白转导域,与蛋白转导功能相关[8]。迄今为止,已发现了3个高效的蛋白转导域,分别来自HIV-1 Tat、果蝇同源异型转录因子ANTP和单纯疱疹病毒1型(HSV-1)VP22转录因子[9-11]。
TAT具有不依赖胞吞作用的穿膜效果,将多肽、蛋白质分子及DNA片段有效地导入多种肿瘤细胞和正常的哺乳类动物细胞,具有无受体介导、无耗能和细胞无损伤的特点[12],因此作为生物活性分子有效的细胞内转运工具,TAT已广泛应用于基因治疗、细胞生物学、临床药效评价、药物体内转运以及细胞免疫学等研究领域。
KDR是肿瘤生长、发展、转移中起着重要作用的VEGF受体,本课题组在前期研究中成功构建了靶向KDR的RNA干扰的质粒载体和慢病毒载体系统,有效地抑制了肝癌细胞和小细胞型肺癌细胞株KDR基因的表达,遏制了肿瘤的生长和转移。但由于质粒载体和慢病毒不同程度存在着宿主细胞感染效率低、难以穿透肿瘤细胞生物屏障和毒性作用大且易造成细胞损伤甚至死亡等问题,限制了其在肿瘤治疗中的广泛应用[12]。为此,本课题组构建了TAT介导的KDR靶向siRNA慢病毒载体,通过将TAT的穿膜作用与KDR siRNA的抗肿瘤作用相结合,观察其与无TAT介导的KDR RNAi慢病毒载体系统相比,是否在抑制KDR基因表达、促进细胞凋亡、抗肿瘤细胞侵袭和转移中的作用方面能发挥更大的生物学效应。
本研究按照TAT蛋白转导区48~60位氨基酸(YGRKKRRQRRR)的序列,人工合成编码TAT-PTD的2条寡核苷酸链,将其插入pGC KDR siRNA载体。经菌落PCR和测序证实pGCTAT/KDR siRNA载体构建成功并有效地进行慢病毒载体的包装。Western blotting和Real-Time PCR实验显示,该慢病毒载体与pGC KDR siRNA慢病毒载体相比,有更强的KDR基因表达抑制作用;双染色流式细胞仪分析显示,pGC TAT/KDR siRNA慢病毒载体与pGC KDR siRNA慢病毒相比具有更强的细胞凋亡促进作用;Transwell实验显示,pGC TAT/KDR siRNA慢病毒载体也具有比pGC KDR siRNA慢病毒更强的抑制细胞转移和侵袭的能力;MTT法也证实pGC TAT/KDR siRNA慢病毒载体比pGC KDR siRNA慢病毒载体具有更强的细胞增殖抑制作用。说明TAT介导的KDR-siRNA慢病毒载体具有高效、快速的抗肿瘤作用,为KDR-siRNA和TAT在肿瘤治疗临床应用中奠定了一定的实验和理论基础。
[1]Shibuya M.Vascular endothelial growth factor and its receptor system:physiological functions in angiogenesis and pathological roles in various diseases[J].J Biochem,2013,153(1):13-19.
[2]王彤,李丹妮,李咏,等.构建siRNA慢病毒载体抑制A549细胞株VEGF受体KDR基因的表达[J].临床医学工程,2012,19(10):1664-1666.
[3]刘颖,崔广凯,王晶岩,等.RNA干扰抑制肝癌细胞KDR基因表达的实验研究[J].中国厂矿医学,2009,(6):644-646.
[4]Bowman L,Palmer T,Sargent F.A regulatory domain controls the transport activity of a twin-arginine signal peptide[J].FEBS Lett,2013,587(20):3365-3367.
[5]Cardaci S,Soster M,Bussolino F,et al.The V1/V2 loop of HIV-1 gp120 is necessary for Tat binding and consequent modulation of virus entry[J].FEBS Lett,2013,587(18):2943-2951.
[6]Zhao X,Dong Y,Zhao Z,et al.Intracellular delivery of artificial transcription factors fused to the protein transduction domain of HIV-1 Tat[J].Protein Expr Purif,2013,90(1):27-33.
[7]Vivès E,Brodin P,Lebleu B.A truncated HIV-1 Tat protein basic domain rapidly translocates through the plasma membrane and accumulates in the cell nucleus[J].J Biol Chem,1997,272(25):16010-16017.
[8]Das AT,Klaver B,Harwig A,et al.Construction of a doxycycline-dependent simian immunodeficiency virus reveals a nontranscriptional function of tat in viral replication[J].J Virol,2007,81(20):11159-11169.
[9]Chang JR,Mukerjee R,Bagashev A,et al.HIV-1 Tat protein promotes neuronal dysfunction through disruption of microRNAs[J].J Biol Chem,2013,288(39):28303.
[10]Youn JI,Park SH,Jin HT,et al.Enhanced delivery efficiency of recombinant adenovirus into tumor and mesenchymal stem cells by a novel PTD[J].Cancer Gene Ther,2008,15(11):703-712.
[11]Schlegel EF,Blaho JA.A conserved carboxy-terminal domain in the major tegument structural protein VP22 facilitates virion packaging of a chimeric protein during productive herpes simplex virus 1 infection[J].Virology,2009,387(2):449-458.
[12]Liechtenstein T,Perez-Janices N,Bricogne C,et al.Immune modulation by genetic modification of dendritic cells with lentiviral vectors[J].Virus Res,2013,176(1-2):1-15.

