西洋参茎叶总皂苷通过抑制过度内质网应激减轻大鼠心肌缺血/再灌注损伤*
王 琛, 刘 蜜, 孙 胜, 宋丹丹, 刘秀华△, 史大卓△
(解放军总医院 1中医科, 3病理生理研究室, 北京 100853; 2中国中医科学院西苑医院, 北京100091)
西洋参茎叶总皂苷通过抑制过度内质网应激减轻大鼠心肌缺血/再灌注损伤*
王 琛1,2, 刘 蜜2, 孙 胜3, 宋丹丹3, 刘秀华3△, 史大卓2△
(解放军总医院1中医科,3病理生理研究室, 北京 100853;2中国中医科学院西苑医院, 北京100091)
目的观察西洋参茎叶总皂苷(PQS)对大鼠心肌缺血/再灌注(ischemia/reperfusion, I/R)损伤的保护作用,并从内质网应激(ERS)的角度探讨其可能的分子机制。方法采用SD大鼠心肌I/R模型,随机分为正常对照组、模型组与药物预处理组,检测血流动力学及血清心肌肌钙蛋白T(cTnT)含量,以氯化三苯基四氮唑(TTC)和伊文思蓝双染法检测心梗面积,采用HE染色和TUNEL法分别评估心肌病理损伤和心肌细胞凋亡程度,Western blotting法检测心肌组织凋亡调节因子以及内质网应激相关蛋白的表达。结果与I/R组相比,PQS+I/R组平均动脉压降低32.0%(P<0.05),左室±dp/dtmax分别升高64.0%和35.0%(P<0.05),血清cTnT含量降低53.3%(P<0.05),坏死面积/缺血面积(AN/AAR)百分比降低65.5%(P<0.05),心肌细胞凋亡率降低54.9%(P<0.05);心肌组织病理损伤程度减轻;抗凋亡蛋白Bcl-2表达升高110.0%(P<0.05),促凋亡蛋白Bax表达降低47.8%(P<0.05),钙网蛋白(CRT)表达降低43.4%(P<0.05),C/EBP同源蛋白(CHOP)和剪切后的caspase-12蛋白表达分别降低38.6%和23.7%(P<0.05)。结论PQS可显著减轻大鼠心肌I/R损伤,其机制与降低I/R诱导的CRT过表达,抑制CHOP、caspase-12等内质网凋亡通路激活,从而抑制过度ERS介导的细胞凋亡有关。
西洋参茎叶总皂苷; 缺血/再灌注; 内质网应激
西洋参茎叶总皂苷(Panaxquinquefoliumsaponins, PQS) 是西洋参茎叶中主要的活性成分。以往实验研究表明,PQS具有减轻缺血/再灌注(ischemia/reperfusion, I/R)诱导的心肌细胞凋亡和心律失常、改善梗死后心室重构等作用[1-3],其机制可能与增强抗氧化酶活性、维持细胞内Ca2+稳态等有关[4]。
内质网 (endoplasmic reticulum, ER) 是细胞加工蛋白质和贮存Ca2+的主要场所。缺血缺氧、葡萄糖/营养物质匮乏、ATP耗竭、大量自由基产生及Ca2+稳态破坏等均可引起ER功能障碍,触发内质网应激 (endoplasmic reticulum stress, ERS),表现为ERS标志分子葡萄糖调节蛋白78 (glucose-regulated protein 78, GRP78)和钙网蛋白 (calreticulin, CRT) 的表达。持续而严重的ERS可诱导ERS相关细胞凋亡途径如CCAAT/增强子结合蛋白同源蛋白 (CCAAT/enhancer-binding protein homologous protein, CHOP) 和caspase-12的激活,加重I/R损伤[5-6]。我们前期研究表明PQS可通过抑制ERS相关细胞凋亡而减轻离体培养乳鼠心肌细胞缺氧/复氧损伤[7]。PQS对大鼠心肌缺血/再灌注模型是否具有相同的作用,其机制是否与抑制过度ERS有关,尚缺少研究。因此本研究旨在证明PQS是否通过抑制过度ERS而减轻大鼠心肌I/R损伤。
材 料 和 方 法
1药品和试剂
PQS粉由吉林省集安益盛药业股份有限公司提供;TUNEL试剂盒购自Promaga;氯化三苯基四氮唑 (2,3,5-triphenyltetrazolium chloride,TTC)和伊文思蓝均购自Sigma;蛋白电泳分子量为7~175 kD,为Bio-Rad产品;兔抗人CRT、caspase-12和GRP78多克隆抗体均购自Stressgen;兔抗人GAPDH单克隆抗体、小鼠抗人CHOP单克隆抗体、兔抗人Bax和Bcl-2多克隆抗体均购自Cell Signal;增强化学发光 (ECL) 试剂盒购自Millipore;辣根过氧化酶标记山羊抗兔和山羊抗小鼠IgG均购自Santa Cruz。
2动物模型建立
清洁级健康SD大鼠,雌雄各半,体重(150±20)g,购自军事医学科学院实验动物中心[许可证号为SCXK-(军)2007-004],适应性喂养1周。术前禁食12 h,自由饮水,以2%戊巴比妥钠 (2.3 mL/kg) 腹腔注射麻醉后固定于鼠台,气管插管,采用微型动物呼吸机(浙江大学医疗器械厂生产) 支持呼吸,频率50~60 min-1,潮气量4~6 mL。连接SMUP-PC1型生物信号处理系统,以MFL Lab200心电软件(复旦大学医学院生理教研室研制)记录标准导联心电图。按照既往报道方法[8]复制心肌I/R模型:胸骨正中切口,钝性分离皮下组织及肌肉,在胸骨左缘3、4 肋间开胸暴露心脏。打开心包膜,揭开脂肪垫,暴露左心耳后,持7号针线,在肺动脉圆锥和左心耳之间冠状动脉左前降支(left anterior descending coronary, LAD) 处穿一缝合线,将充水(0.5 mL) 的球囊垫于血管与结扎线之间,结扎造成心肌缺血。心电图监测显示进行性心肌缺血变化后证明造模成功,45 min后,抽出球囊,关胸,再灌注24 h。结束实验时,动脉取血,用于血清肌钙蛋白(cardiac troponin,cTnT)测定,按照不同检测指标分别留取心肌组织标本迅速液氮冷冻后置于-80℃冰箱保存备用,用于制备组织切片或进行心肌梗死面积测定。
3实验分组
随机分为3组,每组15只。(1)假手术 (sham) 组:与药物组等量饮用水灌胃,每天1次,连续6周,开胸后穿线,但不结扎冠状动脉左前降支;(2)I/R组:与药物组等量饮用水灌胃,每天1次,连续6周,开胸后可逆性结扎冠状动脉左前降支致心肌缺血45 min,再灌注24 h;(3)药物预处理(PQS+I/R)组:(根据预实验结果)270 mg·kg-1·d-1PQS水溶液灌胃,每天1次,连续6周后进行与I/R组相同的干预。
4观察指标
4.1心率(heart rate,HR)、平均动脉压(mean arterial pressure,MAP)和左室压上升、下降最大速率(±dp/dtmax)测定 实验结束时,大鼠称重,2%戊巴比妥腹腔麻醉,固定后分离右侧颈总动脉,将PE-50 导管插入颈总动脉经压力传感器与SMUP-PC1型生物信号处理系统相连。稳定10 min后,描计颈动脉波形,再将导管送入左室,描计左心室压力曲线。以MFL Lab200心功能软件记录HR、MAP和±dp/dtmax。
4.2血清cTnT含量测定 经动脉插管抽取血液约5 mL,肝素抗凝,1 000 r/min离心10 min,收集血清,液氮速冻,-80 ℃保存。以全自动生化分析仪(日立公司)测定血清心肌损伤标志物cTnT的含量。
4.3心梗面积测定 按照文献[9]报道方法,实验结束后原位结扎左冠状动脉前降支,经主动脉逆行灌注1%伊文思蓝2 mL,将非缺血区蓝染,显示出缺血区心肌。取出心脏,去除左右心房,置于-20 ℃冷冻20 min,垂直其长轴横切为5片厚约2 mm的心肌片,按顺序置人2% TTC磷酸缓冲液中,避光37 ℃孵育10 min,此时梗死区为灰白色,即坏死面积(area of necrosis,AN);缺血非梗死区呈砖红色,缺血区面积(area at risk,AAR)为灰白区与砖红色区之和,正常区为蓝色。扫描仪扫描成像,以Image-Pro Plus图像分析软件(Version 4.1) 分别计算各部分面积,缺血心肌用AAR与左心室(left ventricle,LV)面积之比表示,梗死范围以AN与AAR之比表示。
4.4心肌细胞凋亡测定 经颈动脉取血后,取出心脏,将缺血区心肌组织(左心室前壁中间段)剪下,4%甲醛固定1周,常规石蜡包埋,制备3 μm切片。采用TUNEL法,按照试剂盒说明进行心肌组织切片细胞凋亡的原位检测。共聚焦显微镜观察,正常心肌细胞核呈蓝色,凋亡细胞核呈深浅不一的绿色。每张切片于凋亡细胞分布区域随机取5个高倍视野,计算平均每个视野中的凋亡细胞数占总细胞数的百分比(%),以凋亡指数(apoptotic index,AI)表示。
4.5心肌病理学观察 采用HE染色,将心肌组织样本固定于4% 甲醛1周后,梯度乙醇脱水,二甲苯透明,石蜡包埋,切片厚度3 μm,脱蜡至水,Harris苏木素染核,70%盐酸乙醇分化,1%乙醇伊红染色,梯度乙醇脱水,二甲苯透明,中性树胶封固,光镜观察并摄像。
4.6Western blotting分析 按文献报道方法[10],提取心肌组织总蛋白,Bradford法蛋白定量后,-80 ℃保存。取上述蛋白提取液上清 (含蛋白150 μg) 进行聚丙烯酰胺凝胶电泳 (SDS-PAGE,12%分离胶)。将电泳分离后的蛋白质电转移至硝酸纤维素 (nitrocellulose, NC)膜。5% BSA封闭40 min后分别加入Bcl-2、Bax、CRT、GRP78和caspase-12多克隆抗体(均为1∶500)和CHOP单克隆抗体 (1∶500) 4 ℃过夜孵育,1× TBS-T洗膜后,以相应的II抗孵育1.5 h,并以GAPDH (1∶500) 单克隆抗体重复上述实验过程,作为上样对照。化学发光ECL显示,采用Image-Pro Plus (Version 4.1) 软件分析蛋白条带的积分吸光度值 (integrated absorbance,IA=A×面积),以靶蛋白IA值/GAPDHIA值的比值反映靶蛋白水平。
5统计学处理
采用SAS 8.2统计软件对实验数据进行分析,数据均用均数±标准差(mean±SD) 表示,采用单因素方差分析 (One-way ANOVA) 进行多组间比较,采用q检验进行多组间两两比较,以P<0.05为差异有统计学意义。
结 果
1PQS对大鼠心肌I/R损伤的影响
1.1平均动脉压和左室压上升、下降最大速率 术中假手术组大鼠状态良好,I/R组和PQS+I/R组分别死亡大鼠3只和4只,死亡原因包括感染、严重心律失常或麻醉致死。各组大鼠心率无显著差异 (P>0.05);与sham组比较,I/R组MAP 高55% (P<0.05),左室(±dp/dtmax)分别低42%和43% (P<0.05)。PQS干预后可明显改善I/R大鼠心功能,表现为PQS+I/R组MAP较I/R组低32% (P<0.05),±dp/dtmax分别较I/R组高64%和35% (P<0.05),见表1。
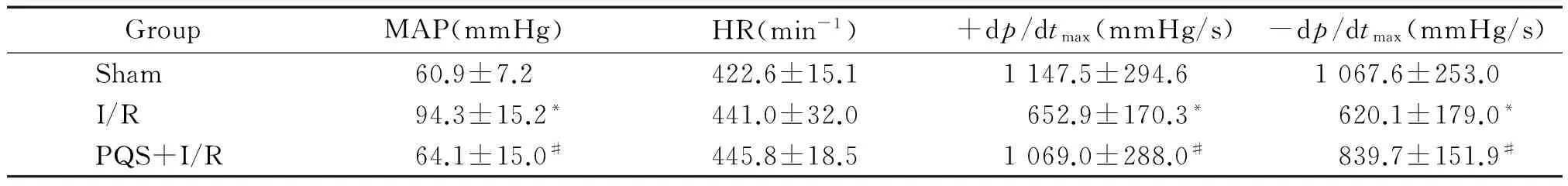
表1 PQS对大鼠血流动力学的影响
I/R: ischemia/reperfusion; PQS:Panaxquinquefoliumsaponins.*P<0.05vssham;#P<0.05vsI/R.
1.2PQS对血清cTnT含量的影响 I/R组血清cTnT含量较sham组显著升高,为sham组的3.9倍(P<0.05),PQS干预可明显减少I/R大鼠血清cTnT的含量,PQS+I/R组血清cTnT含量较I/R组低53.3% (P<0.05),见图1。
1.3PQS对大鼠心肌梗死面积的影响 伊文思蓝和TTC双染评价心梗面积,结果显示,sham组大鼠无心肌梗死,sham组、I/R组和PQS+I/R组的缺血区面积分别为(49.8 ±3.4)%、(50.2±2.2)% 和(50.1±1.3)%,各组间无显著差异(P>0.05);I/R组AN/AAR百分比为(44.2±1.4)%,PQS明显缩小心梗面积,PQS+I/R组AN/AAR百分比为(15.3±4.2)%,较I/R组降低65.5%(P<0.05),见图2。

Figure 1. Effect of PQS on content of cTnT in serum.Mean±SD.n=8.*P<0.05vssham;#P<0.05vsI/R.
图1PQS对血清cTnT含量的影响
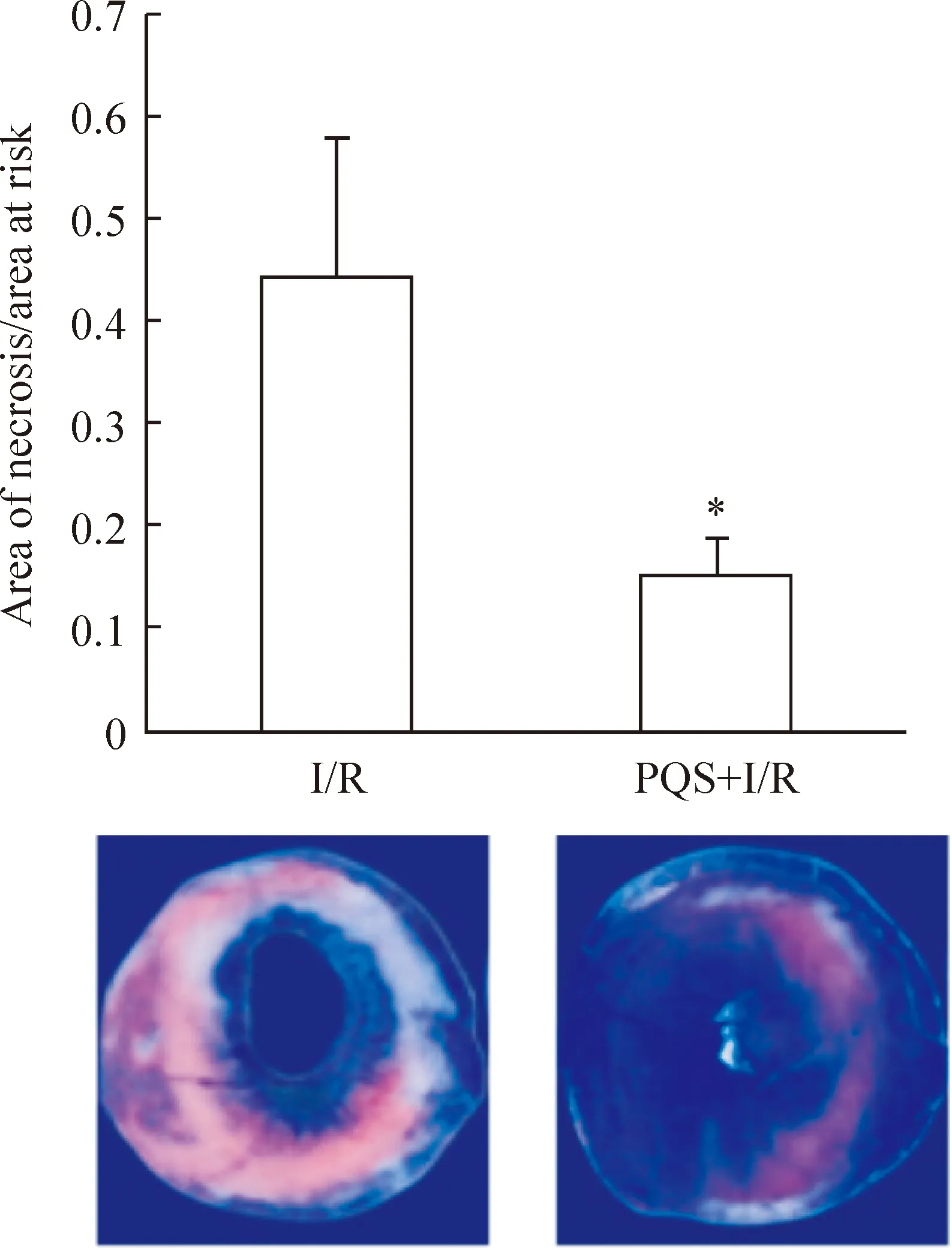
Figure 2. Effect of PQS on myocardial infarct size in rats.I/R: ischemia/reperfusion; PQS:Panaxquinqueliumsaponins.Mean±SD.n=3.*P<0.05vsI/R.
图2PQS对心肌梗死面积的影响
1.4PQS对心肌细胞凋亡的影响 Sham组心肌细胞凋亡指数为(8.2±0.6)%,I/R可致心肌细胞凋亡显著增加,I/R组心肌细胞凋亡指数为(56.9±6.0)%,是sham组的7.0倍(P<0.05),PQS可显著减轻I/R所致的心肌细胞凋亡,PQS+I/R组心肌细胞凋亡指数为(25.7±5.1)%,较I/R组低54.9% (P<0.05),见图3。
1.5心肌组织病理形态学改变 光镜检查结果显示,sham组心肌组织形态学无明显改变,肌纤维完整,排列规则;I/R组心肌纤维排列不规则,结构紊乱,局部横纹消失,呈断裂、坏死融合;PQS+I/R组病理变化程度较I/R组减轻,未见明显的心肌纤维断裂、溶解、坏死,见图4。
1.6凋亡相关因子Bcl-2、Bax蛋白的表达 结果显示,与sham组比较,I/R组Bcl-2蛋白表达低54.9%(P<0.05),Bax蛋白表达是sham组的3.9倍(P<0.05)。PQS可显著诱导抗凋亡蛋白Bcl-2的表达,PQS+I/R组Bcl-2蛋白表达是I/R组的2.1倍 (P<0.05);抑制促凋亡蛋白Bax的表达,Bax蛋白表达较I/R组低47.8% (P<0.05),见图5。
2PQS对I/R心肌组织内质网应激相关分子蛋白表达的影响
2.1GRP78和CRT蛋白的表达 结果显示,I/R可明显诱导GRP78和CRT蛋白的表达,与sham组比较,I/R组GRP78、CRT蛋白表达水平显著增加,分别为sham组的3.1倍和3.0倍(P<0.05);PQS可抑制I/R诱导的CRT过表达,较I/R组低43.4% (P<0.05),见图6。
2.2CHOP蛋白表达的变化和caspase-12的活化 I/R可明显诱导CHOP蛋白表达,为sham组的3.4倍(P<0.05)。PQS抑制I/R诱导的CHOP 蛋白表达,较I/R组降低38.6% (P<0.05),见图7。
采用可同时识别caspase-12酶原 (pro-caspase-12,分子量约48~50 kD) 和剪切后的caspase-12 (cleaved caspase-12,分子量为36 kD) 的特异性抗体,进行免疫印迹检测,结果显示,I/R可明显诱导caspase-12蛋白剪切活化,剪切后的caspase-12的蛋白表达是sham组的2.5倍(P<0.05);PQS抑制I/R后caspase-12 蛋白活化,PQS+I/R组剪切后caspase-12蛋白表达较I/R组降低23.7% (P<0.05),见图7。
讨 论
冠脉结扎法建立大鼠心肌I/R损伤模型,为目前评价药物心肌缺血保护最常用的模型之一。因实验大鼠品系纯正、组间差异小、冠脉侧枝循环少、易结扎、操作简单等特点,成为首选I/R动物模型。本研究采用SD大鼠, 建立I/R损伤模型,肉眼观察可见模型组左室前壁心肌颜色变淡甚至苍白,而假手术组无明显改变。心肌组织病理学染色与心梗面积测定既是反映组织损伤最直观的指标,亦是反映药物治疗缺血性损伤有效性的客观证据。本实验采用心肌组织病理HE染色观察心肌组织病理变化,结果显示模型组细胞核固缩,间质水肿,心肌纤维排列紊乱、断裂;假手术组未见明显改变; PQS组心肌组织病理变化程度较I/R组减轻。采用伊文思蓝、TTC双染评价心梗面积,结果显示各组缺血区无显著差异,说明各组结扎部位一致,不存在因结扎部位的不同而造成的人为误差;模型组心梗面积较假手术组明显增加,PQS可显著减少I/R导致的心梗面积;平均动脉压是一个心动周期中持续地推动血液向前流动的平均推动力,更精确地反映心脏和血管的机能状态,每一心动周期由于舒张期时程长于收缩期,故平均动脉压不是收缩压与舒张压的平均数,而是更靠近于舒张压,平均动脉压升高说明血管壁弹性减少,顺应性下降。本研究发现模型组平均动脉压较假手术组明显升高,反映左室舒张及收缩功能的±dp/dtmax显著降低, PQS能显著降低I/R引起的平均动脉压升高,增加左室±dp/dtmax;心肌损伤标志物cTnT是目前诊断心肌损伤的特异性标志物,心肌急性缺血(氧)时,细胞膜损伤,通透性增加,cTnT大量漏出。本研究发现缺血45 min、再灌注24 h后,血清cTnT含量明显增加。与模型组相比,PQS组血清nTnT显著减少。以上均提示PQS可保护I/R心肌损伤,表现为减轻心肌坏死、改善心功能、减轻心肌细胞膜损伤等。
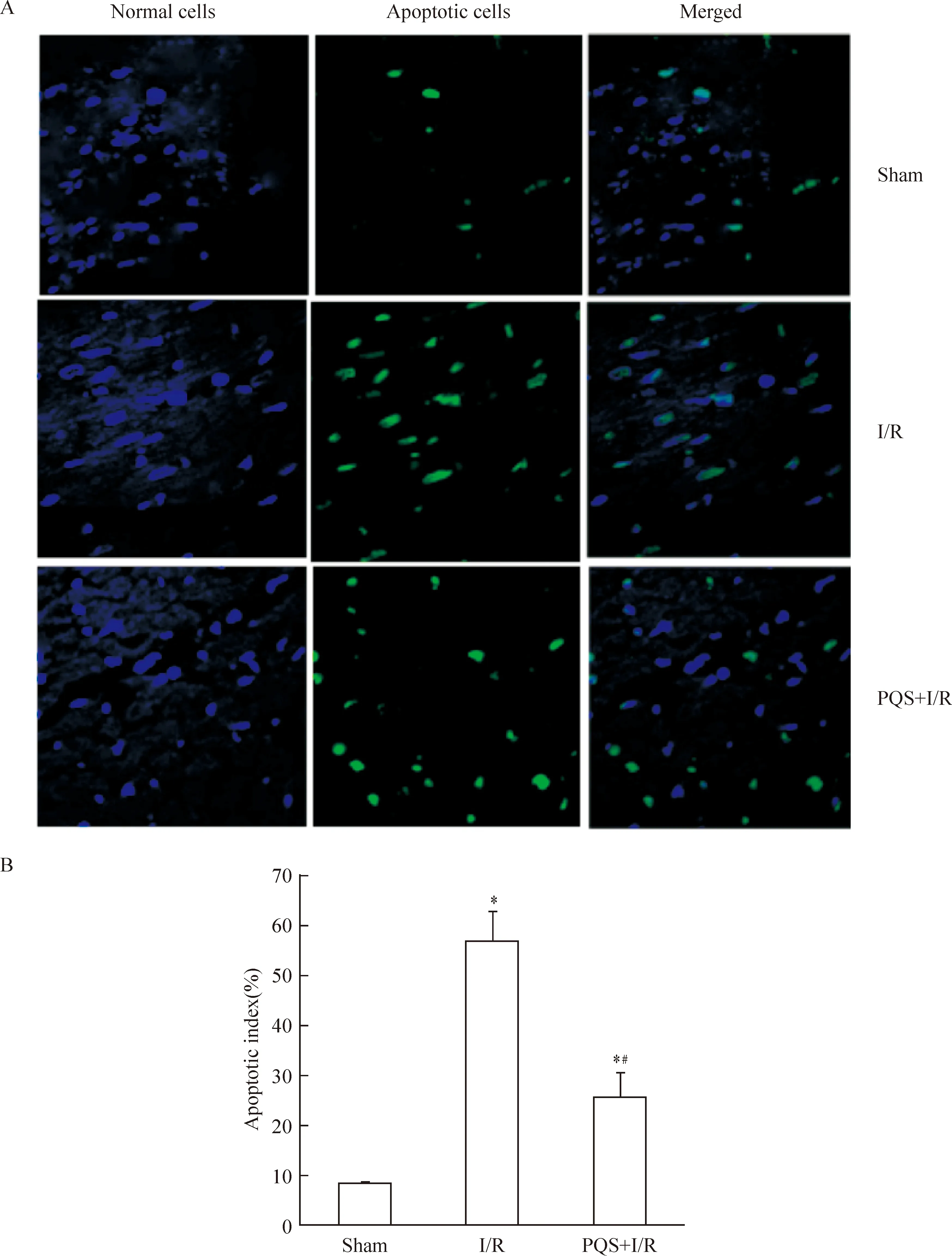
Figure 3. Effect of PQS on cardiomyocyte apoptotic index.Mean±SD.n=3.*P<0.05vssham;#P<0.05vsI/R.
图3PQS对大鼠心肌细胞凋亡指数的影响
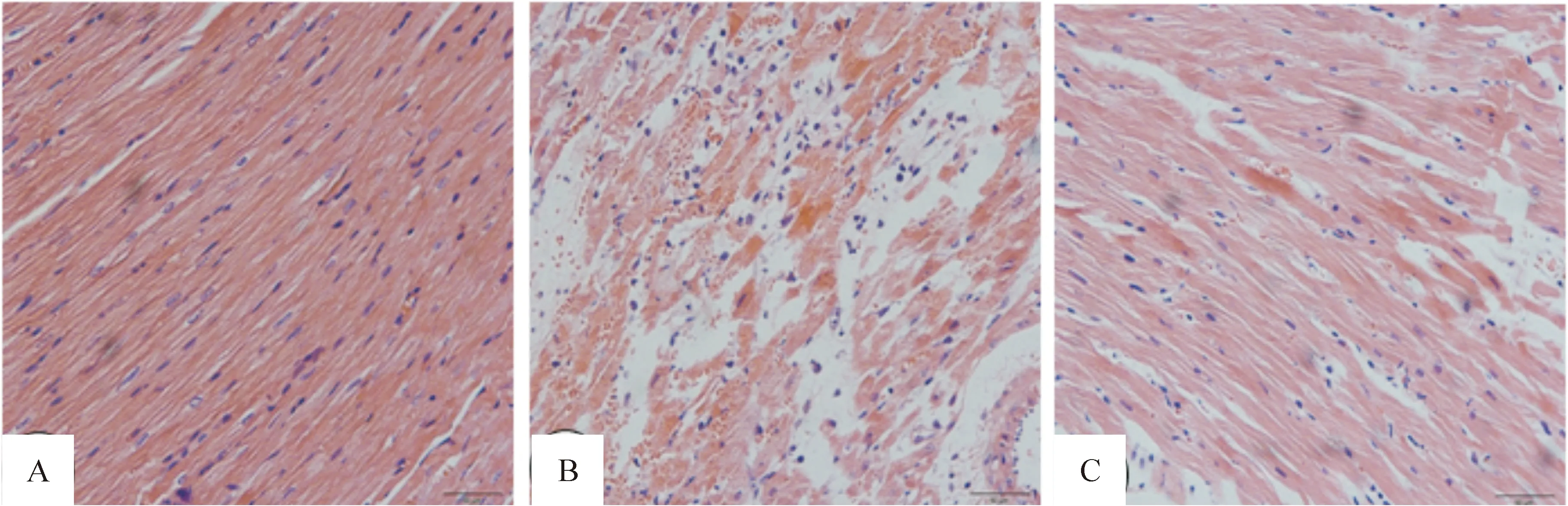
Figure 4. Morphological changes of rat myocardial tissues (×200). A:sham group; B:ischemia/reperfusion group; C: pretreatment withPanaxquinqueliumsaponins group.
图4大鼠心肌组织病理形态学改变

Figure 5.Panaxquinquefoliumsaponins (PQS) reduced the expression of pro-apoptotic protein Bax and increased expression of anti-apoptotic protein Bcl-2 in I/R myocardium.Mean±SD.n=6.*P<0.05vscontrol;#P<0.05vsI/R.
图5PQS对I/R心肌Bcl-2和Bax蛋白表达的影响
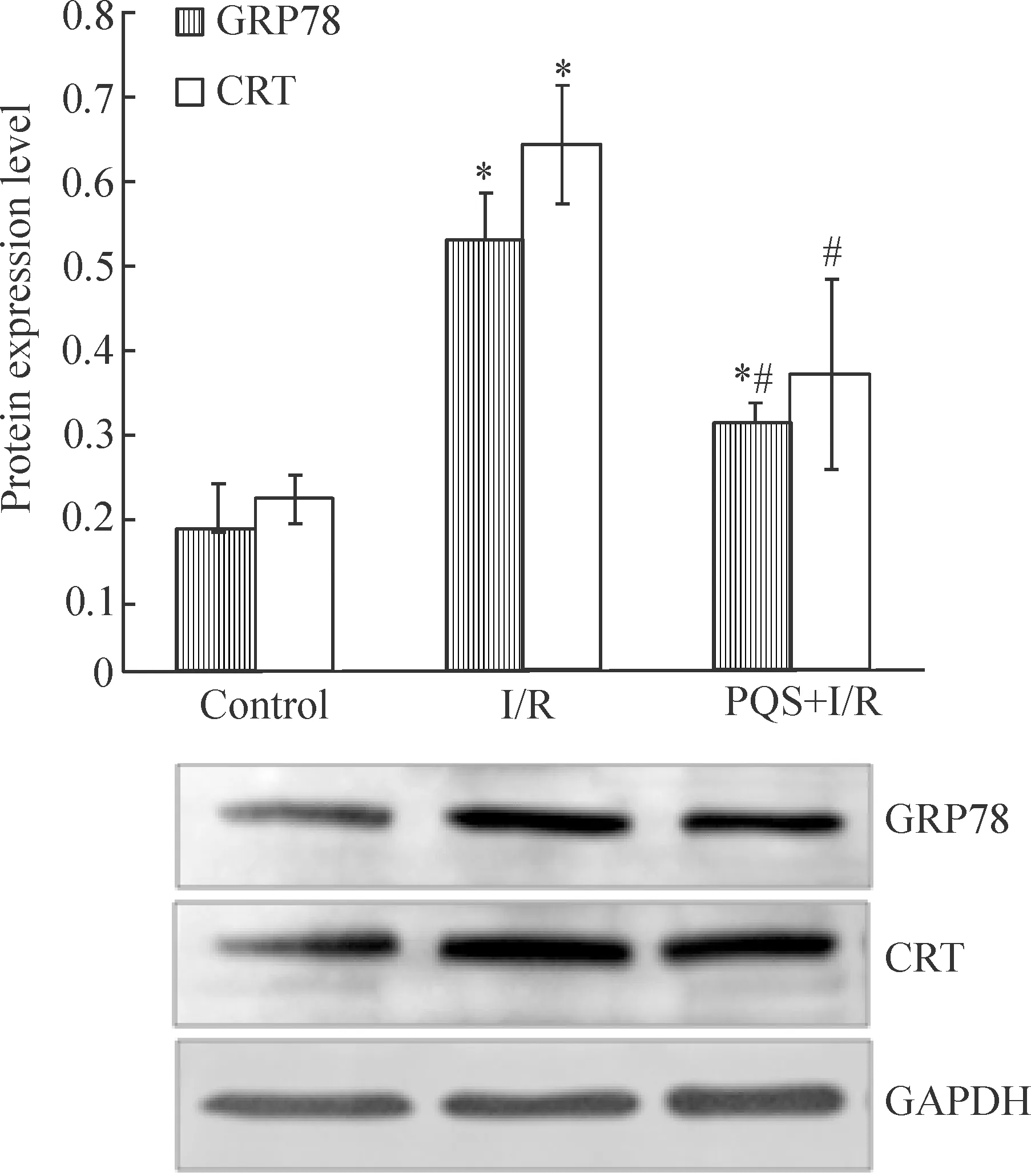
Figure 6. Effect ofPanaxquinquefoliumsaponins (PQS) on the expression of GRP78 and CRT in I/R myocardium.Mean±SD.n=6.*P<0.05vscontrol;#P<0.05vsI/R.
图6PQS对I/R心肌GRP78和CRT蛋白表达的影响
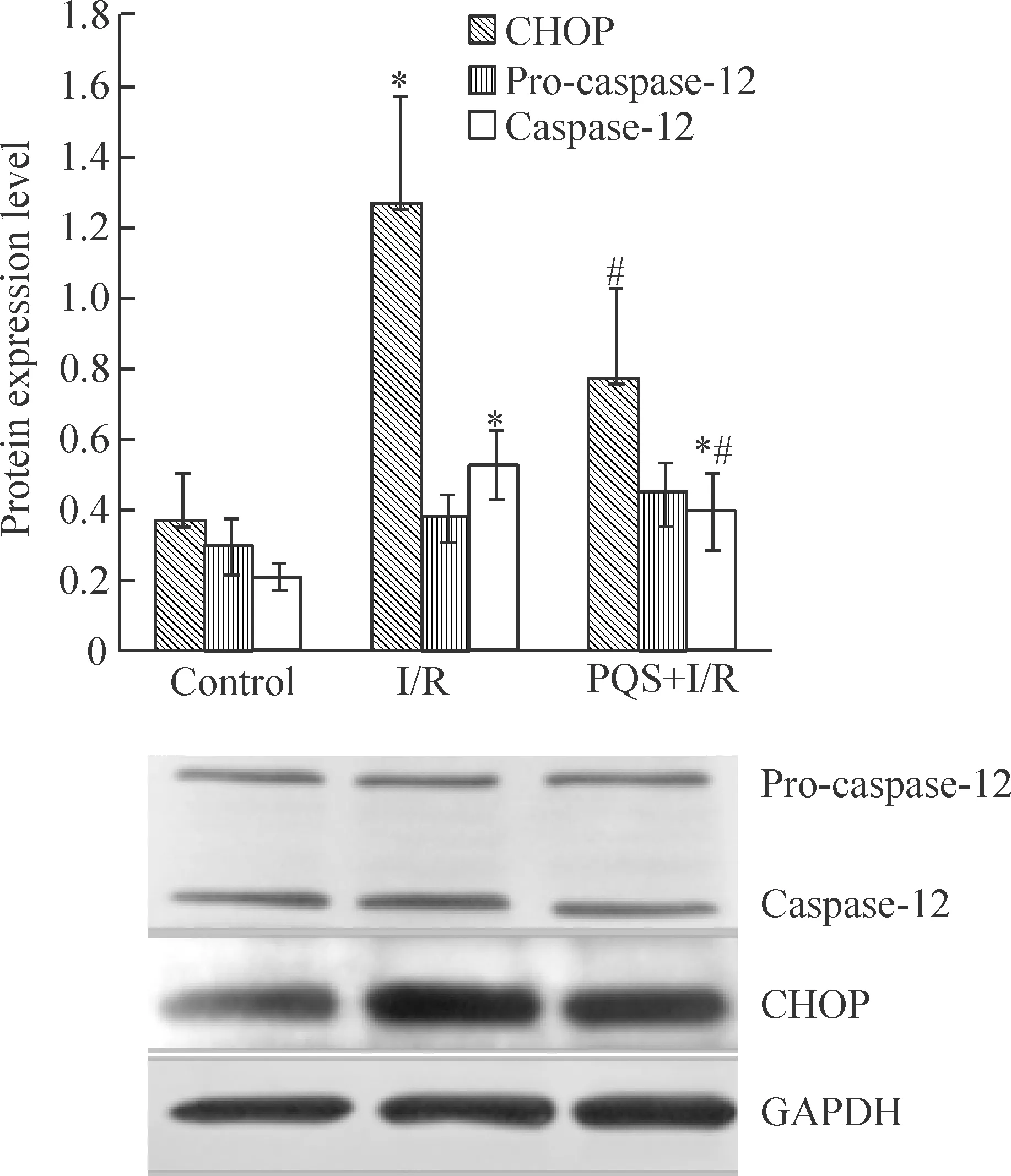
Figure 7. Effect ofPanaxquinquefoliumsaponins (PQS) on the expression of the ERS-associated apoptotic protein CHOP and activation of the apoptotic effector enzyme caspase-12 in I/R myocardium.Mean±SD.n=6.*P<0.05vscontrol;#P<0.05vsI/R.
图7PQS对I/R心肌CHOP蛋白表达及caspase-12活化的影响
细胞凋亡是心肌I/R损伤的一个重要特征,在心肌I/R损伤过程中发挥重要作用[11]。Gottlieb等[12]利用家兔离体心脏灌流模型首次发现I/R中存在心肌细胞凋亡。Musat-Marcu等[13]研究发现离体灌流大鼠心脏再灌注早期即可发生心肌细胞凋亡。TUNEL法测心肌细胞凋亡,既可定性又可定量,可准确定位,且灵敏度高。本研究利用此方法发现,与假手术组比较,模型组心肌细胞凋亡指数显著增加,PQS可显著降低I/R引起的细胞凋亡,提示PQS可通过抑制I/R心肌细胞凋亡,减轻心肌I/R损伤。抗凋亡基因bcl-2与促凋亡基因bax参与心肌I/R损伤细胞凋亡的调控[14-16],抑制细胞凋亡的发生和发展,是促进心肌I/R损伤后心功能恢复和减轻心肌致死性损伤的一条重要途径。本研究采用Western blotting,检测凋亡相关因子Bcl-2和Bax的蛋白表达,发现模型组促凋亡因子Bax蛋白表达较假手术组显著升高,抗凋亡因子Bcl-2的表达明显降低,PQS可明显降低I/R诱导的Bax蛋白表达,升高Bcl-2蛋白表达。提示PQS可通过调节凋亡相关因子的表达,调控心肌细胞凋亡过程,减轻心肌损伤。
I/R发生的主要病理环节是氧自由基产生和钙超载。ER是调节Ca2+和蛋白质合成的重要场所,ER理化环境改变和ER过负荷等因素导致的ERS在I/R损伤的发生发展过程中具有重要意义[17]。GRP78为内质网标志分子,早期ERS时GRP78与ER内误折叠及未折叠蛋白结合,减轻ER负荷,恢复其稳态。因此,GRP78的表达标志ERS的发生。Shibata等[18]发现,小鼠大脑缺血1 h后GRP78表达升高;Flores-Diaz等[19]报道,心肌缺血/缺氧可诱导内质网分子伴侣GRP78、CRT表达上调。本研究采用Western blotting方法检测内质网分子伴侣GRP78的蛋白表达,发现各处理组GRP78的蛋白表达均明显高于假手术组,提示I/R诱发了ERS,与文献[20]报道一致。PQS通过调节ERS,维持细胞内环境稳态从而增加心肌抗I/R损伤的能力;CRT是ER中主要钙结合伴侣蛋白,在维持细胞Ca2+稳态,协助蛋白质正确折叠及调节细胞凋亡等方面发挥重要作用。Ihara等[21]利用H9c2成心肌细胞研究证实高表达的CRT可促进细胞凋亡。本研究亦发现I/R诱导CRT蛋白表达水平显著升高,与文献报道一致[22]。PQS可减轻I/R诱导的CRT过表达,表明PQS可通过调节CRT蛋白表达,减少I/R引起的细胞凋亡。
I/R诱导细胞凋亡,除经典的死亡受体途径和线粒体途径外,ERS相关凋亡途径引起广泛关注[23-26]。持续或严重的ERS通过激活凋亡信号分子 CHOP、caspase-12和JNK启动ERS相关凋亡途径,诱导细胞凋亡。CHOP又称生长停滞及DNA损伤诱导蛋白153(growth arrest and DNA damage-inducible protein 153, GADD153),是CCAAT/增强子结合蛋白(C/EBP)转录因子家族成员,为ERS相关凋亡途径的特异性标志物。严重ERS时,CHOP通过直接调节核内靶基因,增加细胞对ERS介导凋亡的敏感性[27]。研究表明,缺血/缺氧可诱导CHOP表达显著增加,破坏了Bcl-2家族促凋亡与抗凋亡基因之间的平衡,促进细胞凋亡[28]。本研究发现,与假手术组相比,I/R显著诱导了CHOP蛋白表达,PQS可显著抑制I/R诱导的CHOP蛋白表达,提示PQS可能通过抑制过度ERS介导的细胞凋亡起到心肌保护作用。Caspase-12定位于ER外膜,以无活性的酶原形式存在,是ERS相关凋亡途径的特异性分子,持续或严重的ERS引起caspase-12激活,活化的caspase-12进一步激活casepase-9,接着激活caspase-3,最终导致细胞凋亡[29-30]。本研究发现,I/R可明显诱导剪切后caspase-12的蛋白表达,提示ERS相关凋亡途径在I/R损伤中具有重要作用,与文献[22]报道一致。PQS可显著抑制I/R诱导的caspase-12活化, PQS抑制I/R引起的细胞凋亡也与其抑制caspase-12活化有关。
综上所述,PQS具有抗大鼠心肌I/R损伤的作用,其机制可能通过抑制过度ERS引起的细胞凋亡有关,表现为降低I/R诱导的CRT过表达,抑制CHOP、caspase-12等内质网应激凋亡通路激活,其下游信号通路有待进一步探索。
[1] 曹 霞,谷欣权,陈燕萍,等.西洋参茎叶三醇组皂甙对缺血再灌注损伤心肌的保护作用[J]. 中国老年学杂志,2004,7(24):654-655.
[2] 殷惠军,张 颖,蒋跃绒,等.西洋参叶总皂甙对急性心肌梗死大鼠心肌细胞凋亡及凋亡相关基因表达的影响[J]. 中国中西医结合杂志,2005,25(3):232-235.
[3] 关利新,衣 欣,杨世杰,等.西洋参茎叶皂甙对大鼠心肌细胞Ca2+内流的影响[J].中国药理与临床,2004,20(6):8-9.
[4] 鞠传静,张志国,赵学忠,等.西洋参叶二醇组皂甙对大鼠实验性心室重构的保护作用[J].中国老年学杂志,2007,27(22):2173-2175.
[5] Boya P, Cohen I, Zamzami N, et al. Endoplasmic reticulum stress-induced cell death requires mitochondrial membrane permeabilization [J]. Cell Death Differ, 2002, 9(4):465-467.
[6] Breckenridge DG, Germain M, Mathai JP, et al. Regulation of apoptosis by endoplasmic reticulum pathways [J]. Oncogene, 2003, 22(53): 8608-8618.
[7] Wang C, Li YZ, Wang XR, et al.Panaxquinquefoliumsaponins reduce myocardial hypoxia/reoxygenation injury by inhibiting excessive endoplasmic reticulum stress [J]. Shock, 2012, 37(2): 228-233.
[8] 赵秀梅,孙 胜,刘秀华. 垫扎球囊法复制大鼠在体心肌缺血/再灌注模型[J].中国微循环, 2007, 11(3): 206-208.
[9] Liu XH,Grund F,Kanellopoulos GK,et al. Myocardial extracellular signal regulatory kinases are activated by laser treatment [J]. J Cardiovasc Surg (Torino), 2003, 44(1):1-7.
[10]Xu FF, Liu XH, Cai LR. Role of hypoxia-inducible factor-1α in the prevention of cardiomyocyte injury induced by hypoxic preconditioning[J]. Acta Physiol Sin, 2004, 56(5): 609-614.
[11]Zhao ZQ, Vinten-Johansen J. Myocardial apoptosis and ischemic preconditioning[J]. Cardiovasc Res, 2002, 55(3): 438-455.
[12]Gottlieb RA, Burleson KO, Kloner RA, et al. Reperfusion injury induces apoptosis in rabbit cardiomyocytes[J]. J Clin Invest, 1994, 94(10): 1621-1628.
[13]Musat-Marcu S, Gunter HE, Jugdutt BI, et al. Inhibition of apoptosis after ischemia-reperfusion in rat myocardium by cycloheximide [J]. J Mol Cell Cardiol, 1999, 31(5): 1073-1082.
[14]Fliss H, Gattiuger D. Apoptosis in ischemic and reperfused rat myocardium [J]. Circ Res, 1996, 79(5): 949-956.
[15]Borutaite V, Brown GC. Mitochondria in apoptosis of ischemic heart [J]. FEBS Lett, 2003, 541(1-3): 1-5.
[16]姚 震, 焦解歌, 冯建章. 心肌缺血再灌注损伤与细胞凋亡关系的实验研究[J]. 海南医学院学报, 2000, 6(3): 129-133.
[17]Vilatoba M, Eckstein C, Bilbao G, et al. Sodium 4-phenylbutyrate protects against liver ischemia reperfusion injury by inhibition of endoplasmic reticulum stress mediated apoptosis [J]. Surgery, 2005, 138(2):342-351.
[18]Shibata M,Hattori H, Sasaki T, et al. Activation of caspase-12 by endoplasmic reticulum stress induced by transient middle cerebral artery occlusion in mice [J]. Neuroscience, 2003, 118(2):491-499.
[19]Flores-Diaz M, Higuita JC, Florin I, et al. A cellular UDP-glucose deficiency causes overexpression of glucose oxygen-regulated proteins independent of endoplasmic reticulum stress elements [J]. J Biol Chem, 2004, 279(21): 21724-21731.
[20]Szegezdi E, Duffy A, O’Mahoney ME, et al. ER stress contributes to ischemia-induced cardiomyocyte apoptosis [J]. Biochem Biophys Res Commun, 2006, 349(4): 1406-1411.
[21]Ihara Y, Urata Y, Goto S, et al. Role of calreticulin in the sensitivity of myocardiac H9c2 cells to oxidative stress caused by hydrogen peroxide[J]. Am J Physiol Cell Physiol, 2006, 290(1): C208-C221.
[22]Liu XH, Zhang ZY, Sun S, et al. Ischemic postconditioning protects myocardium from ischemia/reperfusion injury through attenuation endoplasmic reticulum stress [J]. Shock, 2008, 30(4): 422-427.
[23]Hayashi T, Saito A, Okuno S, et al. Damage to the endoplasmic reticulum and activation of apoptotic machinery by oxidative stress in ischemic neurons[J]. J Cereb Blood Flow Metab, 2005, 25(1): 41-53.
[24]Matindale JJ, Fernandez R, Thuerauf D, et al. Endoplasmic reticulum stress gene induction and protection from ischemia/reperfusion injury in the hearts of transgenic mice with a tamoxifen-regulated from of ATF6 [J]. Circ Res, 2006, 98(9): 1186-1193.
[25]王 琛,李玉珍,王晓礽,等.西洋参茎叶总皂苷通过抑制过度内质网应激减轻大鼠心肌细胞缺氧/复氧损伤[J].中国病理生理杂志,2012,28(1):22-28.
[26]刘 颖,纪 超,吴伟康.附子多糖保护缺氧/复氧乳鼠心肌细胞及其抗内质网应激的机制研究[J].中国病理生理杂志,2012,28(3):459-463.
[27]Oyadomari S, Mori M. Roles of CHOP/GADD153 in endoplasmic reticulum stress[J]. Cell Death Differ,2004,11(4): 381-389.
[28]McCullough KD, Martindale JL, Klotz LO, et al. Gadd153 sensitizes cells to endoplasmic reticulum stress by down-regulating Bcl-2 and perturbing the cellular redox state[J]. Mol Cell Biol,2001, 21(4):1249-1259.
[29]Szegezdi E, Fitzgerald U, Samali A. Caspase-12 and ER-stress-mediated apoptosis: the story so far [J]. Ann N Y Acad Sci, 2003, 1010 : 186-194.
[30]Nakagawa T, Zhu H, Morishima N, et al. Caspase-12 mediates endoplasmic-reticulum-specific apoptosis and cytotoxicity by amyloid-β [J]. Nature, 2000, 403(6765):98-103.
Panaxquinquefoliumsaponinsprotectratmyocardiumfromischemia/reperfusioninjurythroughattenuatingexcessiveendoplasmicreticulumstress
WANG Chen1,2, LIU Mi2, SUN Sheng3, SONG Dan-dan3, LIU Xiu-hua3, SHI Da-zhuo2
(1DepartmentofTraditionalChineseMedicine,3DepartmentofPathophysiology,ChinesePLAGeneralHospital,Beijing100853,China;2XiyuanHospital,ChinaAcademyofChineseMedicalSciences,Beijing100091,China.E-mail:xiuhualiu98@yahoo.com.cn;shidz666@sohu.com)
AIM: To investigate whether excessive endoplasmic reticulum stress (ERS) is involved in the protective mechanism ofPanaxquinquefoliumsaponins (PQS) against ischemia/reperfusion (I/R) injury in rat myocardium.METHODSThe model of myocardial I/R injuryinvivowas made by ligating the left anterior descending artery for 45 min followed by 24 h of reperfusion in SD rats. The hemodynamics and serum content of cardiac troponin T (cTnT) were measured. The myocardial infarct size was measured by Evans blue and 2, 3, 5-triphenyltetrazolium chloride (TTC) staining. Cardiomyocyte apoptosis was detected usinginsituTDT-mediated dUTP nick end labeling (TUNEL). The protein levels of glucose-regulated protein 78 (GRP78), calreticulin (CRT), C/EBP homologous protein (CHOP), caspase-12, apoptosis-associated proteins Bax and Bcl-2 were determined by Western blotting.RESULTSCompared with I/R group, the mean arterial pressure in PQR+IR group was decreased by 32.0%, and left ventricular±dp/dtmaxwas increased by 64.0% and 35.0%, respectively.The serum content of cTnT was decreased by 53.3%, the percentage of area of necrosis (AN)/area at risk (AAR) was reduced by 65.5% and the apoptosis rate was decreased by 54.9%.The myocardial pathological changes were improved. Bcl-2 protein expression was increased by 110.0% and that of Bax was decreased by 47.8%. CRT protein expression was decreased by 43.4 %, CHOP protein expression and the protein level of cleaved caspase-12 were decreased by 38.6% and 23.7% in PQS+I/R group.CONCLUSIONPQS alleviates I/R injury in myocardium by inhibition of excessive ERS.
Panaxquinquefoliumsaponins; Ischemia/reperfusion; Endoplasmic reticulum stress
R363.1
A
10.3969/j.issn.1000- 4718.2013.01.004
1000- 4718(2013)01- 0020- 08
2012- 08- 20
2012- 11- 21
科学技术部国际科技合作项目资助课题(No.2010DFA31690)
△通讯作者 刘秀华 Tel:010-66939774; E-mail: xiuhualiu98@yahoo.com.cn; 史大卓 Tel: 010-62860499; E-mail: shidz666@sohu.com

