索拉非尼对敏感人肝癌细胞株MAPK信号通路基因表达的影响*
陈 东, 赵 鹏, 殷晓煜, 陈 伟, 肖伟锴, 梁力建△
索拉非尼(sorafenib;商品名:多吉美)是一个多靶点的分子靶向药物,对受体辅助因子1(receptor accessory factor,Raf-1)激酶、血管内皮生长因子受体(vascular endothelial growth factor,VEGFR)2、VEGFR3、Fms样酪氨酸激酶(Fms-like tyrosine kinase,FLT)3、Ret、C-kit、血小板源性生长因子受体(platelet-derived growth factor receptor,PDGFR)等靶点有抑制作用。目前已有多项国际多中心研究证明索拉非尼对晚期原发性肝癌(hepatocellular carcinoma,HCC)有明显、确切的疗效,能明显延长晚期肝癌的生存时间[1-4]。目前,索拉非尼已作为晚期、不可切除肝癌的标准治疗而广泛应用。Liu等[5]利用细胞实验发现索拉非尼可抑制Raf,下调丝裂原激活蛋白激酶激酶(mitogen-activated protein kinase kinase,MAPKK,又称MEK)和细胞外信号调节激酶(extracellular signal-regulated kinase,ERK)表达,即通过抑制Raf/MEK/ERK(MAPK)信号通路的表达来抑制HCC细胞的增殖。另外,丝裂原激活蛋白激酶(mitogen-activated protein kinase,MAPK)信号通路也是VEGFR2、VEGFR3、PDGFR等靶点的下游信号通路,但索拉非尼抑制MAPK信号通路的具体分子机制目前仍不明确。本研究进行完善的实验设计,利用流式细胞术检测细胞凋亡和CCK-8(cell counting kit-8)实验,筛选出对索拉非尼敏感的肝癌细胞株,利用MAPK信号通路PCR基因芯片,检测索拉非尼作用后MAPK信号通路中具体分子的基因表达变化,确定了索拉非尼作用HCC过程中MAPK信号通路中发生变化的具体作用分子。
材料和方法
1 材料
1.1 细胞株 Huh7、HepG2、SMCC7721和 PLC 细胞均购自中国科学院上海细胞库,HepG2.2.15细胞购自上海复祥生物科技有限公司,MHCC-97H细胞购自上海中山医院肝癌研究所。
1.2 基因芯片 人 MAPK PCR Array(PAHS-061,Qiangen)。
1.3 仪器与试剂 37℃、5%CO2培养箱(QUEUE),流式细胞仪(Becton-Dickinson),紫外吸收分光光度计(NanaDrop® ND-1000),DMEM培养基(Gibco),胎牛血清(Gibco),二甲基亚砜(DMSO,上海生物试剂厂),EDTA(华美生物工程公司);青/链霉素双抗(penicillin-streptomycin,P/S,上海新先锋药业有限公司),CCK-8试剂盒(Sigma),sorafenib(德国拜耳医药公司),Annexin-PE/7-AAD凋亡检测试剂盒(Becton&Dickinson),Trizol试剂(Invitrogen),RNeasy® MinEluteTM纯化试剂盒(Qiagen),2× SuperArray PCR master Mix(Cat.No.PA-112)。
2 方法
2.1 敏感肝癌细胞株的筛选
2.1.1 细胞培养 将各HCC细胞株接种在含10%小牛血清,1%青霉素、链霉素的DMEM培养基中,置于37℃、5%CO2培养箱中培养,细胞生长良好呈单层贴壁生长,48~72 h换液1次。传代时用0.1%胰蛋白酶消化。
2.1.2 索拉非尼药物配制 用手术刀片将索拉非尼药片糖衣轻轻刮去,刮净糖衣,在称量纸上将药片研成粉末状,称重后将粉末倒入试管中,加入适量DMSO液,配制成浓度为100 μmol/L的索拉非尼工作液,-20℃保存。
2.1.3 流式细胞术检测 每种细胞株设对照组、实验组;细胞株用不含EDTA的胰酶消化;将浓度为2×108/L呈指数生长的细胞悬液接种于6孔板,每孔2.5 mL(即 5 ×105cells/well),孵育 24 h;对照组每孔加入0.5 mL DMSO,实验组每孔加入索拉非尼0.5 mL 溶液(终浓度为 4 μmol/L),每组设 3 个复孔,孵育72 h;收集、离心,PBS液洗涤,重悬细胞,加入 5 μL Annexin V-FITC 和 5 μL propidium iodide(PI),混匀,室温避光反应10 min,在1 h内上流式细胞仪检测。
2.1.4 CCK-8法检测 每种细胞设空白组(培养液+CCK-8)、对照组(细胞+培养液+CCK-8)、实验组(细胞+培养液+索拉非尼+CCK-8);取对数生长期的Huh7、MHCC97、HepG2 、SMCC7721 和HepG2.2.15细胞,胰酶消化制成单细胞悬液,调整浓度为5×107/L,96孔板中每孔加入100 μL细胞悬液;各组设4个不同索拉非尼作用浓度,每个浓度设3个复孔;5%CO2、37℃孵育,吸净培养液,加入无血清的DMEM液“饥饿细胞”24 h;吸净培养液,对照组加入培养液200 μL,实验组内加入不同量的索拉非尼溶液,余量液体用培养液补足,每孔液体量200 μL,孵育24 h;加入10 μL CCK-8溶液,孵育2 h,酶标仪在450 nm波长比色测定每孔吸光度(A)值,记录结果;细胞存活率(%)=(Aa-Ab)/(Ac-Ab)×100%;a:实验孔;b:空白孔;c:对照孔。
2.2 索拉非尼对敏感肝癌细胞株MAPK信号通路基因表达谱的影响
2.2.1 选择上述实验所筛选的敏感肝癌细胞株PLC细胞。
2.2.2 细胞分组 在3.5 cm直径的培养盘中培养,分2组:PLC对照组(Pc组)和PLC+索拉非尼组(Pt组)。细胞贴壁后,Pc组加入DMSO液,Pt组加入索拉非尼,用药浓度为5.25 μmol/L,加药后继续培养48 h。在培养盘中直接中加入1 mL Trizol试剂裂解细胞,裂解时用枪吸打几次,然后分别放-80℃保存。置于干冰中运送至上海康成生物公司进行后续实验。
2.2.3 PCR array操作 (1)RNA抽提:剧烈振荡经Trizol裂解后样本15 s,15~30℃孵育2~3 min。4℃下12 000×g离心15 min,将水相转移到新离心管中。水相与异丙醇混合以沉淀其中的RNA,匀浆时加入1 mL Trizol试剂的同时加0.5 mL的异丙醇。混匀后15~30℃孵育10 min,4℃ 12 000×g离心10 min。移去上清液,加入75%乙醇,清洗RNA沉淀。振荡后,4℃ 7 500×g离心5 min。去除乙醇溶液,干燥RNA沉淀5~10 min,溶解RNA,55~60℃孵育10 min,保存于-70℃。(2)cDNA合成:按试剂盒操作说明,每个纯化柱的中心加入50 μL无RNA酶的H2O,放置2 min后8 000×g离心1 min,得到的溶液即纯化的cRNA,暂时保存于冰中。(3)实时定量PCR:小心打开PCR array上的膜,加10 μL混合液到PCR array对应的每个孔中,小心盖上盖子密封PCR array,置于PCR仪进行PCR反应。
2.2.4 数据分析 采用ΔΔCt方法:(1)计算每个处理组中的每个通路相关基因的ΔCt:ΔCt(group 1)=average Ct- average of HK genes’Ct for group array;(2)计算2个PCR array(或2组)中每个基因的ΔΔCt:ΔΔCt= ΔCt(实验组)-ΔCt(对照组);(3)通过2-ΔΔCt计算实验组与对照组对应基因的表达差异。
3 统计学处理
数据采用SPSS 13.0软件分析。数据以均数±标准差(mean±SD)表示,均数比较用t检验,以P<0.05为差异有统计学意义。
结 果
1 流式细胞仪检测肝癌细胞株凋亡
Huh7、MHCC97H、HepG2 、SMCC7721、HepG2.2.15和PLC肝癌细胞株经索拉非尼作用后,细胞凋亡均较对照组明显增加(P<0.05),见图1。从凋亡细胞百分比可以看出,对索拉非尼较敏感细胞株为PLC细胞和 HepG2.2.15细胞(P < 0.01),对其相对不敏感细胞株为SMCC7721细胞和MHCC97H细胞,见图2。
2 索拉非尼对各肝癌细胞株存活率的影响
由各细胞系的IC50值可看出,对索拉非尼相对敏感细胞株为PLC细胞,不敏感细胞株为SMCC7721细胞,见图3。
3 MAPK PCR array实验结果
与对照组比较,实验组MAPK信号通路中有8个差异表达基因,其中>2.0倍有2个,≤0.5倍有6个。其中,细胞周期蛋白E1(cyclin E1,CCNE1)、周期素依赖性激酶 6(cyclin-dependent kinase 6,CDK6)和周期素依赖性激酶抑制因子1C(cyclin-dependent kinase inhibitor 1C,CDKN1C)与细胞周期的调节相关;jun原癌基因(jun proto-oncogene)、CREB结合蛋白(CREB-binding protein,CREBBP)、MAP 激酶相互作用丝/苏氨酸激酶1(MAP kinase-interacting serine/threonine kinase-1,MKNK1)和MAP激酶激活的蛋白激酶3(MAP kinase-activated protein kinase 3,MAPKAPK3)与转录因子的活化有关,见表1。
讨 论
本研究以索拉非尼作用不同肝癌细胞株Huh7、MHCC97H、HepG2、SMCC7721、HepG2.2.15 和 PLC,然后通过流式细胞仪检测发现,索拉非尼实验组对上述各种肝癌细胞的促凋亡作用均明显强于对照组(P<0.05)。用不同浓度的索拉非尼作用于这些细胞,结果发现细胞不同其IC50值有差异,通过流式细胞术和CCK-8实验,筛选出对索拉非尼敏感细胞株和不敏感细胞株分别为PLC和SMCC7721。筛选索拉非尼敏感和不敏感肝癌细胞株对于后续索拉非尼相关基础研究有重要意义,可供同行参考。
研究表明,基因和蛋白质较少单独起作用,它们往往通过复杂的网络交互作用共同影响生物系统的功能。索拉非尼作用于肝癌涉及的信号通路尚包括STAT3[6]、PI3k/Akt/mTOR 信号通路等[7]。由于索拉非尼主要通过抑制Raf-1抑制MAPK信号通路,MAPK信号通路同时也是索拉非尼设计的其它作用靶点如VEGFR2、VEGFR3、PDGFR等分子下游的主要信号通路,因此,本研究重点深入研究MAPK信号通路具体分子基因的表达变化。

Figure 1.Cell apoptosis determined by flow cytometry.PLC,SMMC7221,HepG2.2.15,Huh7,HepG2 and MHCC97H cells were exposed to sorafenib for 72 h,then 5 μL Annexin V-FITC and 5 μL propidium iodide(PI)were added for 10 min of incubation.图1 流式细胞术检测细胞凋亡
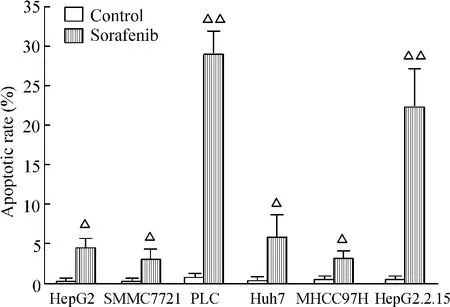
Figure 2.Apoptotic rates determined by flow cytometry.Mean ±SD.n=3.△P < 0.05,△△P < 0.01 vs control group.图2 流式细胞术检测凋亡细胞百分比
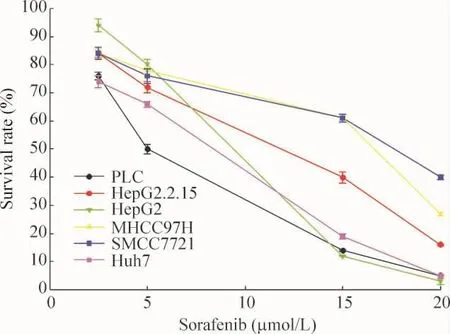
Figure 3.Survival rates of different hepatocarcinoma cell lines treated with sorafenib(2.5,5,15 and 20 μmol/L)for 24 h were determined by CCK-8 assay.Mean ±SD.n=3.The IC50 values of sorafenib were 5.25 μmol/L for PLC cells,5.30 μmol/L for HepG2.2.15 cells;6.80 μmol/L for Huh7 cells,7.01 μmol/L for HepG2 cells,11.7 μmol/L for MHCC97H cells and 15.0 μmol/L for SMCC7721 cells.图3 索拉非尼作用后各肝癌细胞株的存活率
MAPK信号通路PCR芯片包含了与MAPK信息转导通路有关的全部84种基因。实验组MAPK信号通路中有8个差异表达基因,其中>2.0倍的有2个,≤0.5倍的有6个。其中,CCNE1、CDK6和 CDKN1C与细胞周期的调节相关;jun、CREBBP、MKNK1和MAPKAPK3与转录因子的活化有关。CCNE1基因编码cyclin E1,CDKN1C编码p57Kip2。一般而言,cyclin E1和周期蛋白依赖性激酶(cyclin-dependent kinase,CDK)2结合,成为细胞从G1进入S期的关键激酶复合物,磷酸化相关底物蛋白而发挥作用;而p57Kip2作为抑制因子,可结合cyclin E1-CDK2使其失去活性[8]。已有报道,p57Kip2和HCC的发生发展有关系,p57Kip2失活与低分化的HCC密切相关,是HCC预后的一个独立预测因子[9]。本研究发现,索拉非尼作用PLC细胞株后,CDKN1C(p57)上调,CCNE1(cyclin E1)和CDK6下调,但索拉非尼影响p57-cyclin E1-CDK6细胞周期调控机制的具体过程,值得进一步研究。由于索拉非尼在应用过程中可发生耐药,部分患者在应用的后期对索拉非尼失去反应,肿瘤因此发生进展,导致治疗效果下降。因此,目前有提倡联合用药,提高索拉非尼治疗HCC的疗效的相关研究[10]。另有研究表明,miR-195在 85.7% 的HCC中显著下调,而CDK6则是miR-195的一个作用靶点[11]。索拉非尼有无可能通过miR-195-CDK6机制抑制HCC细胞,有待进一步研究。目前关于microRNA、索拉非尼和 HCC三者关系的研究较少[12-13],而microRNA是未来药物研究的一个方向。我们的实验结果为未来的索拉非尼研究提供了相关的线索。
本研究发现索拉非尼作用后MAPK信号通路中的jun上调,这与最近Cervello等[14]的研究一致。他们运用全基因组芯片,利用索拉非尼作用HepG2细胞株,同样发现jun基因上调;他们的研究还发现,索拉非尼作用后,HRK mRNA和c-Jun显著上调且HepG2细胞发生凋亡,而HRK正是c-Jun作用的的一个基因靶点,另外抑制c-Jun信号通路可与索拉非尼发挥协同效应。本研究所采用的细胞系和Cervello等[13]的不同,但有相似的结果,提示本研究的实验结果较为可靠,c-Jun上调可能是索拉非尼抑制HCC细胞时发生的共同现象;同时,也提示在索拉非尼抑制肝癌的研究领域中,有必要进一步对c-Jun信号通路在其中的具体机制进行研究。

表1 Sorafenib处理PLC细胞后MAPK信号通路的差异表达基因Table 1.Differential expression of MAPK signal genes in sorafenib-treated PLC cells
总之,本研究筛选出对索拉非尼敏感的HCC细胞系,并利用此敏感细胞系,通过MAPK信号通路基因芯片,鉴定出索拉非尼作用后MAPK信号通路中发生变化的具体分子,这些分子主要与细胞周期调控和转录因子活化相关,为进一步的研究提供了线索和方向。
[1] Abou-Alfa GK,Schwartz L,Ricci S,et al.Phase II study of sorafenib in patients with advanced hepatocellular carcinoma[J].J Clin Oncol,2006,24(26):4293-4300.
[2] Cheng AL,Kang YK,Chen Z,et al.Efficacy and safety of sorafenib in patients in the Asia-Pacific region with advanced hepatocellular carcinoma:a phase III randomised,double-blind,placebo-controlled trial[J].Lancet Oncol,2009,10(1):25-34.
[3] Llovet JM,Ricci S,Mazzaferro V,et al.Sorafenib in advanced hepatocellular carcinoma [J].N Engl J Med,2008,359(4):378-390.
[4] 阚和平,谭永法,周 杰.索拉非尼治疗肝移植术后肝癌复发的疗效与肿瘤组织Ki-67表达及微血管密度的关系[J].中国病理生理杂志,2011,27(8):1549-1551.
[5] Liu L,Cao Y,Chen C,et al.Sorafenib blocks the RAF/MEK/ERK pathway,inhibits tumor angiogenesis,and induces tumor cell apoptosis in hepatocellular carcinoma model PLC/PRF/5 [J].Cancer Res,2006,66(24):11851-11858.
[6] Tai WT,Cheng AL,Shiau CW,et al.Signal transducer and activator of transcription 3 is a major kinase-independent target of sorafenib in hepatocellular carcinoma[J].J Hepatol,2011,55(5):1041-1048.
[7] Chen KF,Chen HL,Tai WT,et al.Activation of phosphatidylinositol 3-kinase/Akt signaling pathway mediates acquired resistance to sorafenib in hepatocellular carcinoma cells[J].J Pharmacol Exp Ther,2011,337(1):155-161.
[8] Liang Y,Li WW,Yang BW,et al.Aryl hydrocarbon receptor nuclear translocator is associated with tumor growth and progression of hepatocellular carcinoma[J].Int J Cancer,2012,130(8):1745-1754.
[9] Nakai S,Masaki T,Shiratori Y,et al.Expression of p57KIP2in hepatocellular carcinoma:relationship between tumor differentiation and patient survival[J].Int J Oncol,2002,20(4):769-775.
[10] Huynh H,Ngo VC,Koong HN,et al.Sorafenib and rapamycin induce growth suppression in mouse models of hepatocellular carcinoma[J].J Cell Mol Med,2009,13(8B):2673-2683.
[11] Xu T,Zhu Y,Xiong Y,et al.MicroRNA-195 suppresses tumorigenicity and regulates G1/S transition of human hepatocellular carcinoma cells [J].Hepatology,2009,50(1):113-121.
[12] Bai S,Nasser MW,Hsu SH,et al.MicroRNA-122 inhibits tumorigenic properties of hepatocellular carcinoma cells and sensitizes these cells to sorafenib[J].J Biol Chem,2009,284(46):32015-32027.
[13] Shimizu S,Takehara T,Hikita H,et al.The let-7 family of microRNAs inhibits Bcl-xL expression and potentiates sorafenib-induced apoptosis in human hepatocellular carcinoma[J].J Hepatol,2010,52(5):698-704.
[14] Cervello M,Bachvarov D,Lampiasi N,et al.Molecular mechanisms of sorafenib actioin in liver cancer cells[J].Cell Cycle,2012,11(15):2843-2855.

