成年大鼠骨骼肌干细胞的制备与新型培养方法*
黄郁凯, 李晓红, 潘 宇, 林秋雄, 朱杰宁, 江雪燕, 叶力通, 余细勇
肌肉营养不良是一种X连锁隐性遗传病,其中Duchenne型肌营养不良是最常见与最重要的一种类型,主要发生在儿童身上,大多数患儿死于20岁前,目前没有比较好的治疗方法。干细胞移植呈现出比较好的前景,其中在骨骼肌里面存在的骨骼肌干细胞,为治疗Duchenne型肌营养不良提供了一种新的治疗策略[1-2]。骨骼肌干细胞也称骨骼肌卫星细胞,主要存在于肌纤维的肌膜层与基底膜之间,具有自我更新、多向分化的能力,在骨骼肌的损伤修复中起着重要的作用,并在心肌等疾病的自身修复中显示了良好的临床应用前景[3-4]。但肌肉来源的干细胞在成年大鼠骨骼肌中含量较低,目前的分离培养方法主要是差速贴壁法和组织块法[5-6],存在消化时间长、纯化效率低、培养过程中细胞易分化等问题,影响了种子细胞的批量获取,进而阻碍了自体细胞移植的研究。悬浮培养是指细胞在低速贴壁的培养条件下生长,它能模拟组织三维结构,最大限度维持细胞的分化潜能。另外,在悬浮的状态下,分化的成体细胞会停止生长而干细胞会继续快速生长、逐渐克隆成细胞团,因此对纯化干细胞有比较好的效果[7-8]。最近研究表明从小鼠和人的骨骼肌里能分离出骨骼肌干细胞并在悬浮培养的条件下长成细胞团[9],但相关分离培养方法尚未在成年大鼠中建立,所以本研究的目标是探索成年大鼠骨骼肌干细胞的分离和悬浮培养方法,为成年大鼠骨骼肌干细胞的相关转化医学研究打下基础。
材料和方法
1 动物
成年SD大鼠,雄性,约250 g,由中山大学实验动物中心提供。
2 主要试剂
胰蛋白酶购自广州威佳公司,中性蛋白酶购自Roche,Ⅰ、Ⅳ型胶原酶购自 Gibco,配对盒蛋白 7(paired box protein 7,Pax7)单克隆抗体购自博奥森公司,DMEM/F12培养基和胎牛血清(fetal bovine serum,FBS)购自Hyclone;表皮生长因子(epidermal growth factor,EGF)和碱性成纤维细胞生长因子(basic fibroblast growth factor,bFGF)购自 Peprotech,Ultra-Low Attachment 6孔板购自Corning,40 μm滤网购自BD。

表1 各基因实时荧光定量PCR引物Table 1.Quantitative real-time RT-PCR primers
3 主要方法
3.1 骨骼肌干细胞的分离 无菌条件下自约250 g的SD大鼠股四头肌取3~5 g肌肉,将其移入盛有双抗PBS的培养皿中,剔除筋膜后剪1 mm×1 mm×1 mm的组织块,再转移到盛有1 g/L中性蛋白酶、1 g/LⅣ型胶原酶、2 g/LⅠ型胶原酶和2 g/L胰蛋白酶混合消化液的50 mL离心管中,37℃水浴箱中消化40 min,每5 min摇1次,最后200目不锈钢网筛过滤到50 mL离心管中,加入5 mL FBS终止消化,1 200 r/min和离心10 min,弃上清。用含有20 μg/L EGF和20 μg/L bFGF的DMEM/F12重悬,种入Ultra-Low Attachment 6孔板中,并于37℃、5%CO2培养箱中培养。
传统差速贴壁法:获得的单细胞混悬液接种到培养瓶内2 h后将培养液及非贴壁的细胞转移到涂有多聚赖氨酸的培养皿中继续培养扩增以去除未消化纤维碎片和易贴壁的成纤维细胞。
3.2 骨骼肌干细胞团的形成 每隔1 d加入500 μL新鲜的培养基,3 d后,将悬浮培养液转移到50 mL离心管内,让小细胞团沉淀30 min后,半量换液。当观察到大细胞团的形成时,用40 μm的滤网过滤,然后接种到6孔板中培养,继续观察。
3.3 总RNA的提取和qRT-PCR 用TRIzol提取骨骼肌干细胞的总RNA,逆转录获得cDNA,荧光定量PCR过程使用SYBR® Premix Ex TaqTMII(Perfect Real Time)试剂盒。各引物序列见表1。
3.4 免疫细胞化学染色 将接种于载玻片上的骨骼肌干细胞用PBS洗3次,每次3 min;多聚甲醛固定20 min,PBS洗3次,每次3 min;加入抗 pax7抗体,常温孵育60 min,PBS洗3次,每次3min;加入带荧光标记的Ⅱ抗,常温孵育60 min后,PBS洗3次,每次3 min;加入DAPI染料,常温孵育5 min,PBS洗3次,每次3 min;水溶性明胶封片后在激光共聚焦显微镜下观察并拍照。
3.5 细胞的多能性特征鉴定
3.5.1 成脂分化诱导 成脂分化培养基成分为:DMEM/F12、1 mmol/L地塞米松、10 mmol/L异丁基甲基黄嘌呤、100 mmol/L吲哚美辛、10 mg/L胰岛素、10%FBS和1%双抗。将配置好的成脂分化培养基加入到贴壁的骨骼肌干细胞中,每3 d换1次液,2周后,oil red O染色观察。
3.5.2 成骨分化诱导 骨分化培养基成分为:DMEM/F12、10% FBS、50 mg/L L-抗坏 血 酸、10 mmol/L甘油磷酸、100 nmol/L地塞米松和1%双抗。将配置好的成骨分化培养基加入到贴壁的骨骼肌干细胞中,每3 d换1次液,2周后,Alizarin red S染色观察。
4 统计学处理
用SPSS 13.0统计软件进行分析。数据采用均数±标准差(mean±SD)表示,多组间比较采用单因素方差分析(ANOVA),组间两两比较采用最小显著性差异法(LSD法)。以P<0.05为差异有统计学意义。
结 果
1 骨骼肌干细胞的分离和细胞团的形成
经酶消化分离出的骨骼肌干细胞呈现圆形或长梭形亮点,悬浮于培养液中。在低吸附6孔板中能逐渐长成细胞团,2~3 d可观察到细胞团的形成,5~7 d有大细胞团的形成,呈球形、轮廓光滑透亮。把细胞团种入到6孔板中,1 d后大部分细胞团会贴壁,2 d后可见有细胞开始从细胞团中爬出来,犹如太阳状,当细胞全部爬出来后,太阳状慢慢消失,与传统差速贴壁培养方法相比,相同培养时间下的细胞轮廓更光滑透亮,见图1。
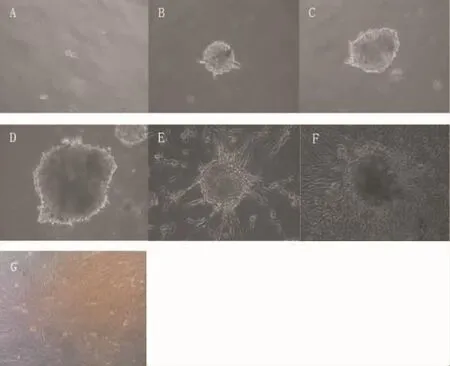
Figure 1.The growth process of skeletal muscle stem cells(×200).A ~D:suspension culture at 1,3,5 and 8 d;E~F:adherent culture at 2 and 5 d;G:the cell culture for 7 d with the traditional method.图1 骨骼肌干细胞生长过程
2 骨骼肌干细胞的鉴定
2.1 qRT-PCR检测干细胞标志物和骨骼肌干细胞标志物 和传统差速贴壁方法相比,新方法所获细胞的干细胞标志物Nanog、Oct4和骨骼肌干细胞标志物Myf5、Pax7有比较高的表达,这表明该方法得到的细胞纯度更高,干性更好,见图2。

Figure 2.The mRNA expression of Nanog,Oct4,Myf5 and Pax7 in skeletal muscle stem cells.Mean ± SD.n=3.*P <0.05 vs traditional method.图2 骨骼肌干细胞Nanog、Oct4、Myf5和 Pax7 mRNA的表达
2.2 骨骼肌干细胞免疫化学染色 和传统差速贴壁法相比,Pax7在悬浮培养法获得的骨骼肌干细胞中的表达更强,这也表明该方法得到的骨骼肌干细胞纯度更高,见图3。
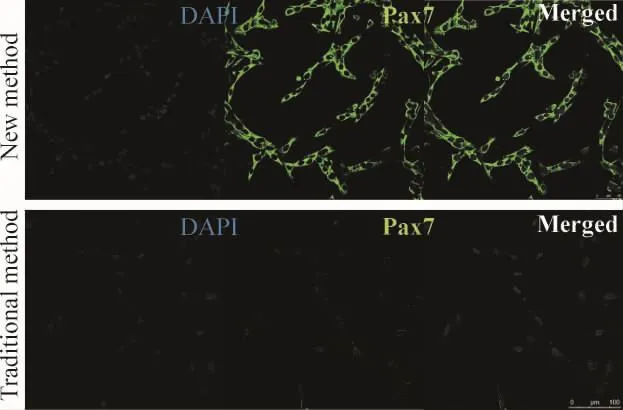
Figure 3.The expression of Pax7 in skeletal muscle stem cells obtained by the new method and the traditional method(immunocytochemical staining,×400).图3 骨骼肌干细胞的免疫化学染色
3 细胞的多能性特征鉴定
3.1 肌管的形成 骨骼肌干细胞贴壁培养7 d左右融合到60%~70%,开始有散在和方向不一致的骨骼肌卫星细胞相互融合,形成短小的肌管细胞,随着时间的延长,细胞密度增大,细胞之间的融合更为广泛,肌管细胞的形成明显增加。倒置相差显微镜下可见,见图4A。
3.2 成脂分化诱导 用成脂分化诱导培养基诱导10 d后,能看到小脂滴的形成,逐渐变大变多,用oil red O染色显示为红色,见图4B。
3.3 成骨细胞分化诱导 成骨诱导培养基诱导14 d后,细胞慢慢长满,能观察到一些晶体的形成,用Alizarin red S染色时,显示为橙红色,见图4C。
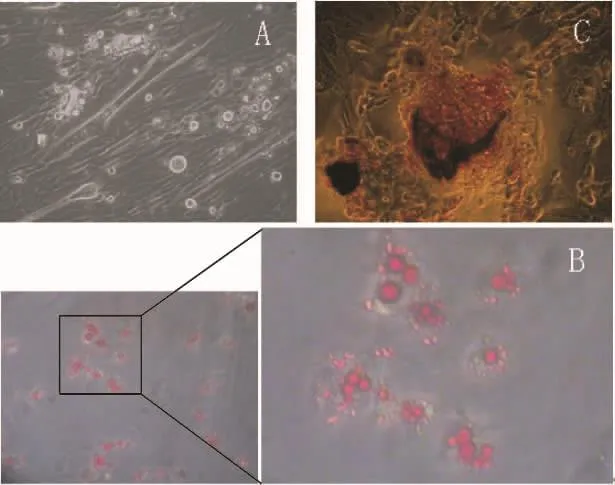
Figure 4.Multi-lineage differentiation capacity of skeletal muscle stem cells(×200).A:skeletal muscle stem cells differentiated into myotubes;B:verification of lipid accumulation by staining with oil red O;C:Alizarin red S staining of calcium phosphate.图4 骨骼肌干细胞的多能性鉴定
讨 论
骨骼肌干细胞存在于肌纤维的肌膜层与基底膜之间,当骨骼肌组织受到损伤时这些静息期的干细胞就会被激活并分裂增殖分化相互融合完成创面修复。目前骨骼肌干细胞因具有以下几个优点而被临床认为是一种理想细胞:(1)自体来源取材方便,易于在体外扩增;(2)骨骼肌是药物注射的常用组织,具有一定的耐受性;(3)能高水平表达有活性的重组蛋白并具有分泌性;(4)移植后可与宿主的肌肉细胞融合形成多核肌细胞,延长细胞存活期;(5)肌肉组织高度血管化,使分泌出的重组蛋白直接进入血液循环;(6)移植后不干扰邻近组织的正常生理功能,临床应用时更加简便安全。
考虑到成年骨骼肌干细胞的治疗潜能,探索其高效分离、纯化和扩增方法是非常必要的。传统的分离方法常用胶原酶、胰蛋白酶消化或者组织块法获得骨骼肌干细胞[11-13],但由于卫星细胞是一种位于肌纤维的肌膜与基底膜之间的组织干细胞,细胞连接紧密,能抵抗一般消化酶的作用。本研究采用混合酶可以发挥叠加作用,使肌肉组织充分分解、消化,有利于简便、快捷地分离出骨骼肌干细胞。在骨骼肌干细胞纯化方面,传统的纯化手段包括差速贴壁和Percoll液梯度离心法[10-12],但存在程序复杂、细胞损失大、纯度不够高等缺点。最近有报道从人骨骼肌里通过悬浮培养的方法分出了骨骼肌干细胞团,并发现通过悬浮培养能很好地维持骨骼肌干细胞的干性,并能达到批量扩增的目的[9]。目前能否用悬浮培养的方法从成年大鼠骨骼肌中培养出细胞团尚未有报道,所以本实验旨在建立悬浮培养法获得成年大鼠骨骼肌干细胞团的方法。越来越多的研究表明,细胞生长环境对细胞增殖、分化、干性维持有很大的影响[13]。在细胞成团培养中悬浮培养起到了非常大的作用,因为悬浮培养法还能模拟体内的三维环境,对维持干细胞的干性和分化潜能有很大的作用,它在脂肪干细胞的培养中也得到了证实[7]。
本研究观察到,很多单个细胞能慢慢扩增成一个细胞团,表现出较好的自我更新能力。从这些细胞团获得的细胞能高表达骨骼肌干细胞标志物Pax7和Myf5,其中Myf5在调节骨骼肌分化过程中最早出现,缺乏Myf5蛋白的骨骼肌细胞会丢失原有的肌肉形态[14]。另外,骨骼肌干细胞还表达了干性因子Nanog和Oct4,这些因子能维持胚胎干细胞的多功能性和自我更新能力,说明该方法获得的细胞是干性较好、还处于分化上游阶段的干细胞[15-17]。
[1] Ichim TE,Alexandrescu DT,Solano F,et al.Mesenchymal stem cells as anti-inflammatories:implications for treatment of Duchenne muscular dystrophy[J].Cell Immunol,2010,260(2):75-82.
[2] Meregalli M,Farini A,Colleoni F,et al.The role of stem cells in muscular dystrophies[J].Curr Gene Ther,2012,12(3):192-205.
[3] Tedesco FS,Dellavalle A,Diaz-Manera J,et al.Repairing skeletal muscle:regenerative potential of skeletal muscle stem cells[J].J Clin Invest,2010,120(1):11-19.
[4] Sambasivan R,Tajbakhsh S.Skeletal muscle stem cell birth and properties[J].Semin Cell Dev Biol,2007,18(6):870-882.
[5] 张 力,范 明,王 伟,等.改良法体外培养大鼠成肌细胞的实验研究[J].军事医学科学院院刊,2007,31(1):62-65.
[6] 刘淑红,吴海涛,陈晓萍,等.一种新的成年大鼠成肌细胞体外批量扩增培养方法[J].生物技术通讯,2009,20(1):75-77.
[7] Dromard C,Bourin P,Barros SD,et al.Human adipose derived stroma/stem cells grow in serum-free medium as floating spheres[J].Exp Cell Res,2011,317(6):770-780.
[8] Sarig R,Baruchi Z,Fuchs O,et al.Regeneration and transdifferentiation potential of muscle-derived stem cells propagated as myospheres[J].Stem Cells,2006,24(7):1769-1778.
[9] Wei Y,Li Y,Chen C,et al.Human skeletal muscle-derived stem cells retain stem cell properties after expansion in myosphere culture[J].Exp Cell Res,2011,317(7):1016-1027.
[10] 谢 艳,朱太咏,赵东亮.成肌细胞体外培养中两种纯化方法的比较[J].中医药导报,2008,14(12):69-70.
[11] 杨 奕.成年大鼠骨骼肌成肌细胞的培养和鉴定[J].哈尔滨医科大学学报,2009,43(2):137-139.
[12] 苏冠华,刘启云.犬骨骼肌成肌细胞体外分离、纯化及培养方法改良探索[J].细胞与分子免疫学杂志,2009,25(3):257-259.
[13] 吕 萍,马景涛.骨骼肌卫星细胞的分离及培养[J].河北医科大学学报,2006,27(4):305-307.
[14] Zammit PS,Carvajal JJ,Golding JP,et al.Myf5 expression in satellite cells and spindles in adult muscle is controlled by separate genetic elements[J].Dev Biol,2004,273(2):454-465.
[15] Ono M,Kajitani T,Uchida H,et al.OCT4 expression in human uterine myometrial stem/progenitor cells[J].Hum Reprod,2010,25(20):2059-2067.
[16] Loh YH,Wu Q,Chew JL,et al.The Oct4 and Nanog transcription network regulates pluripotency in mouse embryonic stem cells[J].Nat Genet,2006,38(5):431-440.
[17] 何志义,梁 毅,梁秋丽,等.香烟对小鼠C2C12成肌细胞分化的影响[J].中国病理生理杂志,2010,26(5):881-884.

