阻塞性黄疸术后胰岛素抵抗与肠黏膜屏障破坏间的相关性*
陈振勇, 代红梅, 涂志刚, 杨 鹏, 蒋春舫, 冯贤松
尽管随着术前评估和术后护理的进展,阻塞性黄疸(阻黄)(obstructive jaundice,OJ)仍保持较高的发病率和死亡率,其中关键性的病理生理因素是肠道屏障功能破坏[1],肠通透性增加[2]。其中尚有许多未解之处。术后胰岛素抵抗(insulin resistance,IR)是指继发于大手术后的机体对胰岛素敏感性下降,组织利用葡萄糖障碍的现象,主要表现在术后血糖升高,糖耐量异常。严重的术后IR会产生多种负面影响,影响机体代谢,破坏内环境稳定,加重组织蛋白分解。临床研究显示术后IR在择期腹部手术中普遍存在,发生的机制并未完全阐明[3]。而择期腹部大手术后均存在肠黏膜屏障的破坏[4],我们前期的实验研究亦发现阻黄能破坏肠紧密连接蛋白,损伤肠黏膜屏障,引起内毒素血症和肠细菌移位。既然这两者在术后均普遍存在,那么两者间是否具有某种联系?我们在前期实验的基础上,以阻黄大鼠为模型,研究两者间的相关性。
材料和方法
1 动物与分组
50只5周龄Wistar大鼠,雌雄不限,体重(300±20)g,购自华中科技大学同济医学院实验动物学部,单笼适应性喂养1周后按随机数字表法平均分为5组,每组10只。采用10%水合氯醛(0.3 g/kg)腹腔注射麻醉。手术过程中预防性给予0.1 mL/g体重的生理盐水皮下注射。对照组:即假手术组,麻醉后仅行开关腹手术;阻黄组(OJ组):取上腹正中切口,显露肝十二指肠韧带,于近肝门处游离并结扎胆总管;胰高血糖素样肽2(glucagon-like peptide 2,GLP-2)组:阻黄动物腹腔注射GLP-2(美国多肽公司)0.5 mL(250 mg·kg-1·d-1),连续 7 d;胰岛素组(insulin组):阻黄动物颈背部皮下注射胰岛素(安徽宏业药业有限公司)0.45 U/kg;连续7 d。
2 检测指标
2.1 术后IR的检测 手术前1 d(1 d before operation,1 d BO)、手术后 2、24、48 h 和 3、7 d 空腹大鼠尾静脉各采血300 μL。美国雅培公司血糖仪检测大鼠的空腹血糖(fasting blood glucose,FBG,mmol/L),放射免疫法(北方生物技术研究所)测定空腹血清胰岛素(fasting serum insulin,FINS,mU/L)。使用稳态模式评估法(homeostasis model assessment,HOMA)计算胰岛素抵抗指数(HOMA-IR)=FBG×FINS/22.5。各时点相隔5min采血3次取平均值。
2.2 乳果糖/甘露醇(lactulose/mannitol,L/M)比值检测 实验动物分别于各时点采血后自由饮水,经胃管每只喂服2 mL检测溶液(含10%乳果糖100 mg和5%甘露醇50 mg,Sigma)。随后连续收集6 h尿液,混匀后取5 mL,加入1 mg硫柳汞作防腐剂,置于-20℃冰箱保存。利用色谱仪分析尿中L/M比值。每只大鼠尿标本分3次各取5 mL,重复测量3次。
2.3 血清类抵抗素分子β(resistin-like molecule beta,RELMβ)浓度的测定 采用RELMβ ELISA试剂盒(上海天呈生物科技有限公司),100 μL血清标本加入96孔板,按说明书操作,通过多波段培养皿阅读器在420 nm处测量每孔吸光度。测量极限75 ng/L。
2.4 回肠组织内RELMβ mRNA的检测 采取半定量逆转录PCR(武汉博士德公司)检测组织细胞内RELMβ表达。各组动物分别于术后第8 d拉脱法处死。无菌取原手术切口,距回盲部10 cm处环形切取回肠,取1 mm×1 mm×1 mm大小的组织块,提取总RNA,逆转录合成cDNA,以此为模版进行PCR扩增。扩增片段及引物[5]:上游引物5’-CCC TTC TCC AGC TGA TCA AC-3’,下游引物 5’-CCA CGA ACC ACA GCC ATA G-3’;以β-actin作为内参照,上游引物5’-TTG CCT CTC AGA CAA TGC CTG-3’,下游引物5’-TCG CTC CTG GAA GAT GGT GAT-3’。循环条件:94℃预变性5 min;94℃ 30 s,58℃ 1 min;72℃ 1 min;共35个循环,最后72℃ 7 min。PCR产物通过12%琼脂糖凝胶电泳,并用密度扫描分析PCR产物带。
3 统计学处理
计量资料用均数±标准差(mean±SD)表示,采用SPSS 13.0分析,组间计量资料比较,方差齐时采用单因素方差分析及配对资料t检验,方差不齐时采用秩和检验。以P<0.05为差异有统计学意义。
结 果
1 阻黄术后IR指数的变化
阻黄和对照组动物术后IR指数均明显升高,与术前相比,对照组术后48 h IR指数达到最高(8.8±1.9),阻黄组术后 3 d 为最高(10.1 ±1.8),均明显高于其它时点(均P<0.05),见图1。
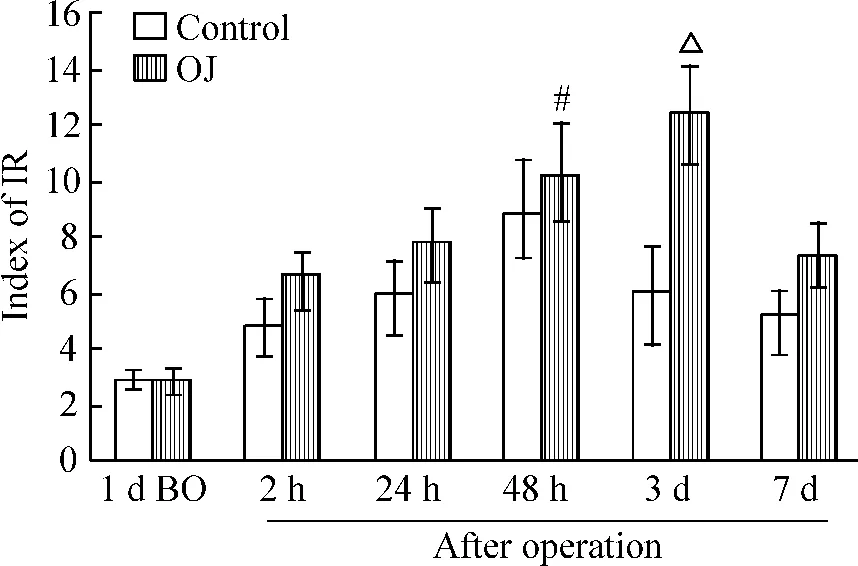
Figure 1.The changes of index of IR after operation.BO:before operation.Mean ±SD.n=10.#P <0.05 vs other time points in control group;△P <0.05 vs other time points in OJ group.图1 阻黄术后IR指数的变化
2 阻黄术后L/M的变化
L/M比值是反映肠黏膜通透性的指标。对照组术后有所上升,但各时点的上升幅度没有统计学意义(均P>0.05),阻黄组术后明显上升,其中3 d组达到最高值 0.66 ±0.08(P <0.05),7 d 组开始下降,但仍高于其它时点,见图2。
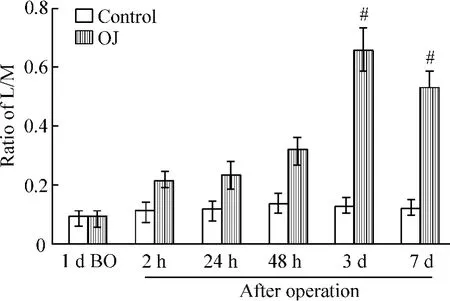
Figure 2.The changes of ratio of L/M after operation.Mean ±SD.n=10.#P < 0.05 vs other time points in OJ group.图2 阻黄术后L/M的变化
3 IR与L/M比值变化间的相关性
将术后IR与L/M比值的变化进行相关性分析,结果两者的相关系数r=0.86(P<0.05),呈明显正相关。
4 GLP-2组术后IR的变化
GLP-2是一种肠黏膜保护剂[6],能恢复受损的肠黏膜。腹腔注射GLP-2后术后IR指数较阻黄组下降,其中7 d组从7.33 ±1.07 降至4.62 ±0.53,降幅达37.0%,为各时点最大降幅(P <0.05),见图3。
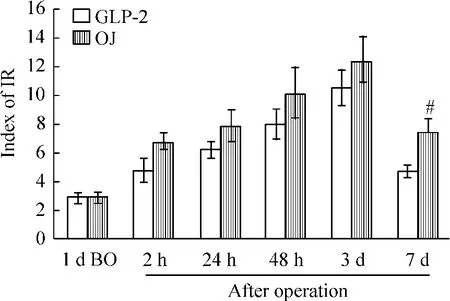
Figure 3.The changes of index of IR after operation in GLP-2 group.Mean ±SD.n=10.#P <0.05 vs OJ group.图3 GLP-2组术后IR的变化
5 胰岛素组术后L/M的变化
研究显示围手术期强化胰岛素治疗可以降低术后IR[7]。使用胰岛素后L/M在3 d和7 d较阻黄组明显降低,其中3 d组从0.66±0.08降至阻黄组的0.35 ±0.04,降幅最大达46.7%(P <0.05),见图4。
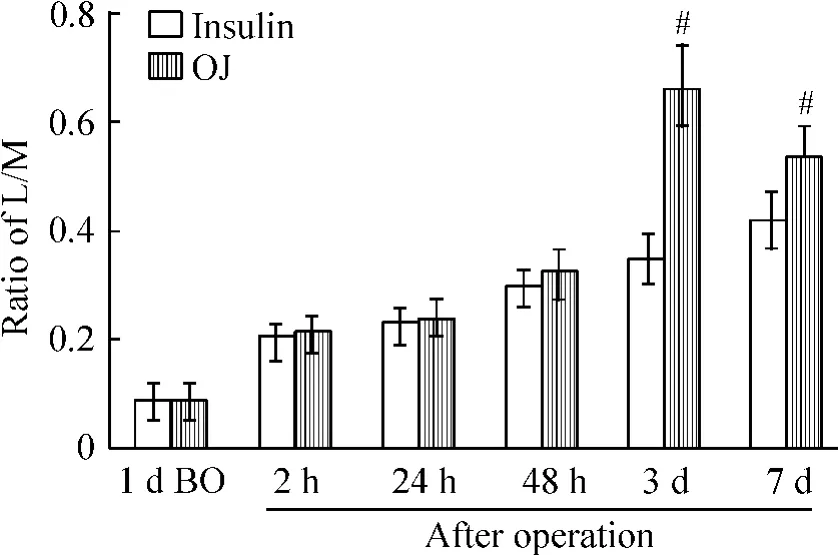
Figure 4.The changes of ratio of L/M in insulin and OJ groups.Mean±SD.n=10.#P <0.05 vs other time points in OJ group.图4 胰岛素组和阻黄组术后L/M的变化
6 术后IR与肠黏膜屏障间的联系
用ELISA检测阻黄组不同时点血清RELMβ的含量,结果阻黄动物术后3 d RELMβ血清含量达到最高[(0.69 ±0.05)μg/L],见图 5A,分别与术后IR指数变化的相关度r=0.955(P<0.05),与L/M变化的相关系数r=0.736(P<0.05)。由于RELMβ在肠道组织内特异性表达,我们进一步研究末端回肠上皮细胞内RELMβ mRNA的表达。半定量PCR显示各组相对RELMβ mRNA水平均高于对照组,与血清浓度不同的是 GLP-2组上皮组织内 RELMβ mRNA相对含量高于胰岛素组,见图5B。
7 各组血清RELMβ含量
由于GLP-2和胰岛素可以分别影响肠黏膜屏障和IR,我们研究两者对血清RELMβ含量的影响,结果各组均高于对照组(P<0.01),其中阻黄组最高达(0.41 ±0.04)μg/L,GLP-2 组与胰岛素组相比差异无统计学意义,见图6。
讨 论
术后IR在腹部手术后普遍存在[2],发生机制十分复杂,一般认为与抗调节激素(如生长激素、促肾上腺皮质激素、抗利尿激素、胰高血糖素、糖皮质激素和儿茶酚胺)、细胞因子(IL-1、IL-6和 TNF-α)的大量释放及外周组织胰岛素抵抗密切相关。而外周组织胰岛素抵抗又与胰岛素受体有关,并可初步区分为受体前、受体和受体后机制[8]。
临床和实验均观察到腹部大手术后存在肠黏膜屏障的破坏[4],我们前期以阻黄动物模型为实验对象,研究发现阻黄手术后肠紧密连接蛋白数量和分布受损,紧密连接通道开放,肠黏膜屏障通透性增加,出现肠细菌移位和内毒素血症。既然这两者在术后均普遍存在,那么两者间是否具有某种联系?
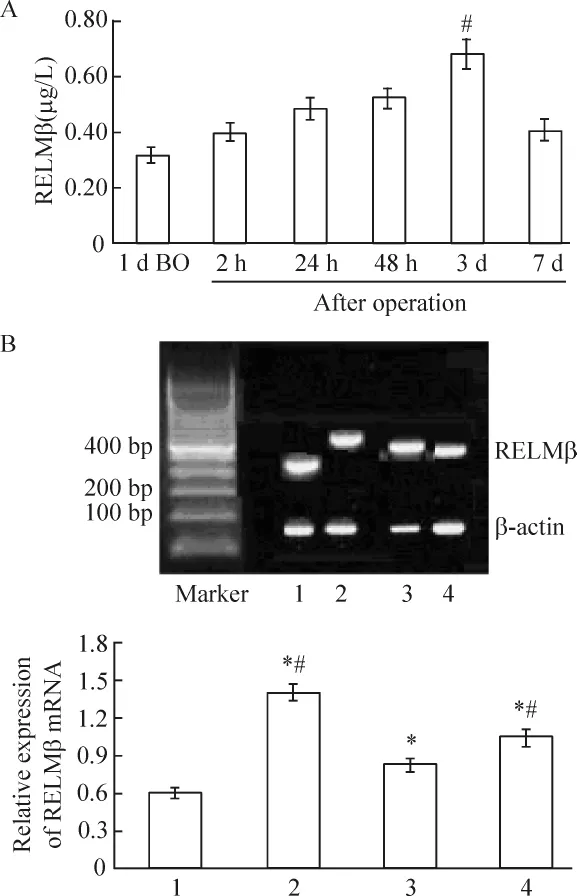
Figure 5.The changes of serum RELMβ concentration detected by ELISA(A)and the expression of RELMβ mRNA detected by RT-PCR(B).1:control;2:OJ;3:insulin;4:GLP -2.Mean ±SD.n=10.#P <0.05 vs insulin group;*P <0.05 vs control group.图5 血清RELM β的含量和组织内RELMβ mRNA表达
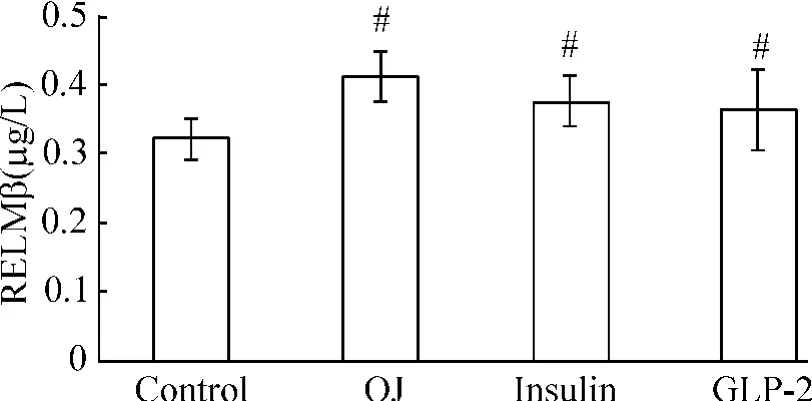
Figure 6.Serum RELMβ concentration.Mean±SD.n=10.#P <0.05 vs control group.图6 各组血清RELMβ含量
我们的研究发现阻黄术后IR和肠黏膜屏障的破坏间具有明显相关。阻黄术后IR指数增加,阻黄组和假手术组术后IR指数均远高于术前,说明手术后均存在IR。阻黄组术后3 d IR指数达到最高(10.1±1.8),且反映肠黏膜通透性的指标L/M比值也在术后3 d达到最高(0.66±0.08),两者的相关系数r=0.86,说明两者间的变化具有同步性。
既然两者有相关性,那么改变其中一个因素是否也能影响另外一个因素?GLP-2能保护并恢复受损的肠黏膜屏障。结果阻黄动物使用GLP-2后术后IR指数较未用者下降。同样,注射胰岛素后,阻黄动物3 d组的L/M降幅最大46.7%。说明两者间可以互相影响。
由于肠黏膜屏障的产生基础是肠黏膜上皮细胞及其相互间的紧密连接,因此我们的研究显示肠道上皮细胞既是术后IR产生的来源,也是IR作用的靶器官。在应激状态下,肠上皮细胞分泌抗调节激素,参与术后IR形成,同时增高的激素水平反过来也损伤肠上皮细胞,破坏肠黏膜屏障。因此使用肠黏膜屏障保护剂GLP-2,减少了肠上皮分泌抗调节激素和细胞因子,达到降低IR的作用。而术后强化胰岛素治疗,可以降低术后IR,也间接保护了肠黏膜屏障。
那两者间有什么内在联系?或者说其交汇点是什么?Steppan等[9]于2001年首次提出抵抗素(resistin)为肥胖与糖尿病的联系所在,出现IR的小鼠抵抗素显著增高。抵抗素参与2型糖尿病的发病机制,并且2型糖尿病患者中,IR组的抵抗素水平要明显高于胰岛素敏感组[10]。随后一系列的研究发现该家族的其它成员,包括类抵抗素分子RELMα、β、γ和resistin[11]。这些家族成员由105~114个氨基酸组成,有3个结构区域:N端信号肽、中间可变区和相对保守的富含11个半胱氨酸的C端序列[12]。其中RELMβ也称作肠道特异性抵抗素,高度局限于肠杯状细胞[13],参与维持胃肠道屏障功能[14],与肠道上皮细胞分化、细胞增殖、免疫反应和炎症反应密切相关[15]。
用ELISA检测阻黄组不同时段血清RELMβ的含量,结果阻黄动物术后3 d组RELMβ血清含量达到最高(0.69±0.05)μg/L,分别与术后 IR 指数变化呈正相关,说明血清RELMβ含量与术后IR的变化有关。通过RT-PCR研究末端回肠上皮细胞内RELMβ的表达,显示各时点组织细胞内相对RELMβ mRNA水平均高于对照组,说明阻黄术后短期内血液和组织细胞内RELMβ水平上升,与术后IR有一致性。同时阻黄术后使用GLP-2和强化胰岛素治疗,RELMβ相对含量均上升较多,从另一个角度更加反映RELMβ与术后肠黏膜屏障和IR有关。说明改善肠黏膜屏障和术后强化胰岛素治疗可以提升血清和组织内RELMβ含量,其变化与术后肠黏膜屏障和IR具有一致性。
[1] Wang N,Yu H,Ma J,et al.Evidence for tight junction protein disruption in intestinal mucosa of malignant obstructive jaundice patients[J].Scand J Gastroenterol,2010,45(2):191-199.
[2] 陈振勇,代红梅,杨 鹏,等.阻塞性黄疸对肠上皮细胞氯离子分泌影响的实验研究[J].中国病理生理杂志,2011,27(11):2194-2198.
[3] 陈 宏,李 非,贾建国,等.择期腹部手术后胰岛素抵抗相关因素研究[J].中国实用外科杂志,2009,29(5):428-430.
[4] 陈振勇,冯贤松,杨 鹏,等.梗阻性黄疸时脾切除对肠黏膜屏障影响的实验研究[J].中华肝胆外科杂志,2011,17(4):309-312.
[5] Fang C,Meng Q,Wu H,et al.Resistin-like molecule-β is a human airway remodelling mediator[J].Eur Respir J,2012,39(2):458-466.
[6] Giovanni M,Roberto G,Maurizio C.Obesity,diabetes,and gut microbiota:the hygiene hypothesis expanded?[J].Diabetes Care,2010,33(10):2277-2284.
[7] Awad S,Lobo DN.Metabolic conditioning to attenuate the adverse effects of perioperative fasting and improve patient outcomes[J].Curr Opin Clin Nutr Metab Care,2012,15(2):194-200.
[8] 秦环龙,杨 俊.胰岛素抵抗与创伤性高血糖[J].中国实用外科杂志,2006,26(2):96-97.
[9] Steppan C,Yamazawa T,Brown EJ,et al.Antagonism of insulin action by resistin[J].Diabetes,2001,50(Suppl 2):A70.
[10] Tokuyama Y,Osawa H,Ishizuka T,et al.Serum resistin level is associated with insulin sensitivity in Japanese patients with type 2 diabetes mellitus[J].Metabolism,2007,56(5):693-698.
[11] Nair MG,Guild KJ,Du Y,et al.Goblet cell-derived resistin-like molecule β augments CD4+T cell production of IFN-γ and infection-induced intestinal inflammation[J].J Immunol,2008,181(7):4709-4715.
[12] 叶 红,马万里,张少华,等.慢性吸烟大鼠肺组织FIZZ1/RELMα表达的变化[J].中国病理生理杂志,2006,22(5):938-942.
[13] He W,Wang ML,Jiang HQ,et al.Bacterial colonization leads to the colonic secretion of RELMβ/FIZZ2,a novel goblet cell-specific protein[J].Gastroenterology,2003,125(5):1388-1397.
[14] Herbert DR,Yang JQ,Hogan SP,et al.Intestinal epithelial cell secretion of RELM-β protects against gastrointestinal worm infection[J].J Exp Med,2009,206(13):2947-2957.
[15] Rim BK,Larissa K,Laurent D,et al.Resistin-like molecule β regulates intestinal mucous secretion and curtails TNBS-induced colitis in mice[J].Inflamm Bowel Dis,2008,14(7):931-941.

