嗅觉脑功能MRI对阿尔茨海默病的早期诊断
赵健仪
尹建忠 YIN Jianzhong
纪东旭 JI Dongxu
赵博峰 ZHAO Bofeng
天津医科大学一中心临床学院,天津市第一中心医院放射科 天津 300192
阿尔茨海默病(AD)是一种常见的老年病,预后较差,病情不可逆转,早期诊断与早期治疗尤为重要。2011年4月11日颁布的由美国国家衰老研究所(National Institute of Aging, NIA)和阿尔茨海默病学会(Alzheimer's Association, AA)修订的 NIA-AA 诊断标准将无症状的亚临床期及AD所致轻度认知障碍(mild cognitive impairment, MCI)期划入AD病程,将AD的概念从痴呆的临床综合征扩展到整个AD相关的病理进展过程,并将反映AD相关病理改变的生物标志纳入诊断框架内[1]。AD的病理改变最早发生于内嗅皮层和海马及其周围区域[2]。嗅觉MRI可以根据血氧浓度水平原理(blood oxygen level dependent, BOLD)检测嗅觉相关脑区的神经细胞活动水平,可能反映AD相关病理改变,为AD诊断提供重要信息。
本研究对正常老年人、MCI患者及AD患者进行嗅觉功能MRI(fMRI)扫描,并统计嗅觉相关脑区的激活信息,研究受检者嗅觉fMRI激活水平与病情程度的相关性,为早期诊断AD提供新方法。
1 资料与方法
1.1 研究对象 选择2011-08~2012-08于天津市第一中心医院就诊的11例MCI患者(MCI组)和12例AD患者(AD组),同期招募14例健康同龄正常老年人(NC组)。所有受试者均接受MMSE (Mini-Mental Status Examination)[3]、MOCA (Montreal Cognitive Assessment)[4]和 CDR (Clinical Dementia Rating Scale)[5]量表的标准化神经心理学测试和相关病史采集。AD患者均符合NIA-AA核心临床诊断标准[1],并排除其他原因所致痴呆。MCI纳入标准:①主诉记忆力下降(非必要条件);②MOCA量表评分<26分,MMSE量表评分>24分;③未达到痴呆(CDR评分为0.5分,保留独立工作及生活能力、处理复杂任务能力,仅有轻度损害、无明显异常行为或人格改变)。所有受试者均排除脑外伤、脑卒中、鼻窦炎活动期与呼吸道阻塞及精神分裂、抑郁症等影响神经心理和嗅觉的疾病,以及吸烟者、有精神药物服用史者。本研究经医院伦理委员会批准,所有受试者均知情同意。
1.2 检查前准备 采集所有受试者的基本信息和病史,并进行刺激气味的预先测试,将0.10%、0.33%、1.00%薰衣草溶液的气味按浓度从低到高的顺序进行呈递,并请受试者对所感受的气味浓度进行评分(主观感受由未感受到气味到气味浓度最高依次评为0~10分),以评估嗅觉功能。行MR扫描前,向受试者讲解实验过程,并嘱其注意在扫描时保持头部及身体静止和对刺激气味的接收。扫描时向头线圈内放置海绵垫安装固定夹固定受试者的额部。
1.3 仪器与方法
1.3.1 MRI检查 采用 Siemens 3.0T MRI仪,32 通道头部线圈。分别采集常规横断面T2WI像,TR 6000 ms,TE 93 ms,视野(FOV)230 mm×230 mm,矩阵 256×256,层厚 5.0 mm,层距 0.75 mm,层数 20;薄层矢状位T1WI结构像,TR 1900 ms,TE 2.5 ms,FOV 250 mm×250 mm,翻转角30°,矩阵256×256,层厚1.0 mm,无间距,层数176层;嗅觉BOLD像,TR 3000 ms,TE 30 ms,FOV 230 mm×230 mm,翻转角 90°,层厚5.0 mm,层距 0.75 mm,矩阵 80×80,层数 20,共采集250帧图像。
1.3.2 嗅觉fMRI相关事件设计 采用自制的嗅觉刺激器,可以提供不同的气味源并进行精确的控制转换,以事件相关设计的刺激方式减轻嗅觉适应效应。嗅觉刺激剂采用薰衣草溶液的挥发气体,3组刺激浓度分别为0.10%、0.33%、1.00%,按由低到高的顺序依次进行刺激,每种浓度连续刺激5次,刺激时间为6 s,刺激间隔时间为42 s。
1.4 图像分析 采用64位Matlab 7.11.0版本及SPM8软件进行图像分析,去除前10帧图像后先后进行BOLD图像的头动校正、图像对齐、空间标准化和高斯平滑的预处理;对预处理后的BOLD图像按照事件相关设计的参数建立激活模型,评估脑内各区各像素的激活情况,生成SPM.BAT数据集文件;以双侧初级嗅觉皮层(primary olfactory codex, POC)为感兴趣区(ROI),由解剖学和放射学专家共同制订划分范围[6,7](图1),计算ROI内激活体素的数量。

图1 初级嗅觉皮层作为ROI的划定范围,MNI坐标:左侧(24±17)mm、(0±11)mm、(-17±10)mm;右侧(-24±17)mm、(0±11)mm、(-17±10)mm。A、B分别为冠状位和轴位图像
1.5 统计学方法 采用SPSS 19.0软件,3组受试者的基础资料、神经心理学评分和POC激活体素比较行独立样本Kruskal-Wallis秩和检验,对POC激活体素数量与MMSE和MOCA评分进行控制年龄因素的偏相关性分析,P<0.05表示差异有统计学意义。
2 结果
2.1 3组基础资料情况 2例正常受试者与1例AD患者由于无法完成实验或头动较大(头动排除标准为2 mm,1°)被排除本研究。3组受试者性别、年龄及受教育年限比较,差异无统计学意义(H=0.000、2.367、0.174,P>0.05);3 组 MMSE、MOCA 评分比较,差异有统计学意义(H=26.330、26.096,P<0.01),见表1。
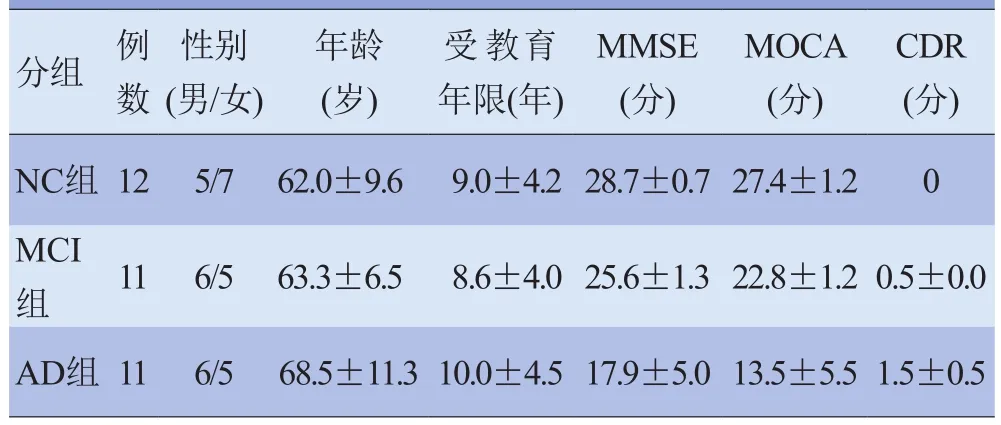
表1 3组受试者基本信息和认知能力评分情况
2.2 3组POC激活情况比较 NC组显示较明显的激活,AD组激活体素数量显著少于MCI组和NC组,MCI组较NC组明显减少,差异有统计学意义(H=13.272,P<0.01),各组数据的标准差均较大,见图2。单个独立样本分析结果显示,NC组双侧POC、双侧海马、双侧岛叶的激活体素数量均高于MCI组和AD组,MCI组除右侧海马以外,5个ROI内激活体素数量均高于AD组。NC组右侧脑区的激活水平高于左侧,MCI组较NC组的激活减低,显示右侧较左侧更为显著,提示AD的病理进展可能存在右侧优势,见表2及图3。
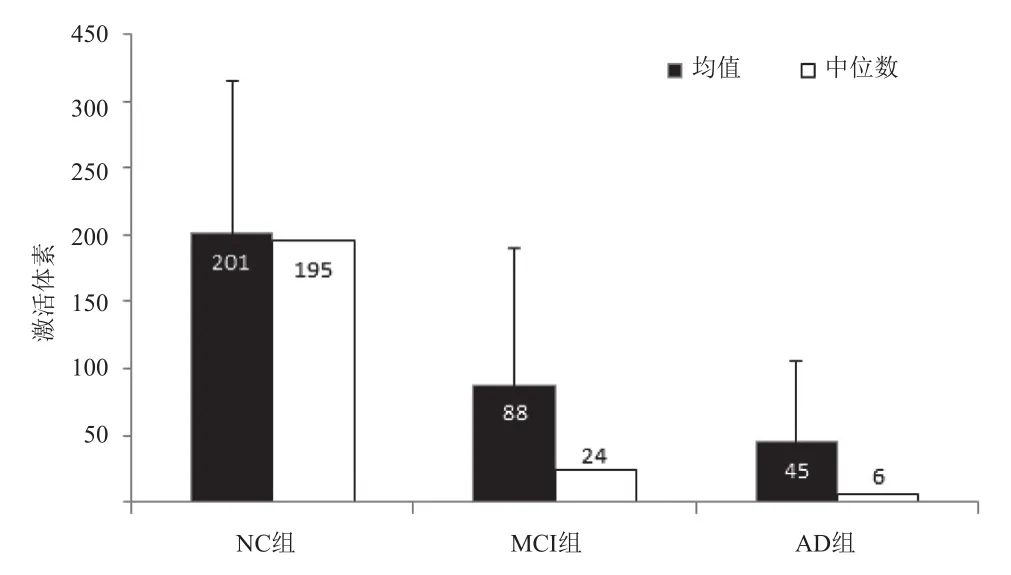
图2 3组POC激活体素数量比较

表2 3组受试者个体水平POC激活情况及单个独立样本组分析

图3 A~C分别为NC组、MCI组、AD组POC区激活情况,NC组激活范围明显大于MCI组和AD组,MCI组POC区激活减低以右侧为著,AD组双侧均显示激活明显减低。上图冠状位图像,下图为轴位图像
2.3 POC激活数与MMSE及MOCA评分的相关性3组POC激活体素数量与MMSE评分(r=0.447,P<0.05)及 MOCA 评分(r=0.421,P<0.05)在控制年龄因素条件下呈正相关。
3 讨论
AD最早期的病理改变开始于内嗅皮层周围区域,逐渐向内嗅皮层和海马发展,最终扩散至新皮质区[2]。AD患者因病理改变累及POC区造成POC区的神经元退行性变及数量减少,导致相应区域的神经元活动水平降低,在嗅觉fMRI中可能显示激活体素数量减少。本研究中3组受试者个体水平POC区激活体素的组间比较与独立样本组分析结果均显示,AD组较NC组和MCI组POC区激活水平显著减低,MCI组的激活水平亦低于NC组,受试者的嗅觉fMRI结果与病情具有相关性。
本研究以POC区作为主要观察ROI。嗅觉刺激所致脑内激活较为复杂,不同个体对于相同气味产生不同的联想,高级嗅觉中枢的激活情况个体差异较大,与嗅觉感受能力的相关性也不显著。Wang等[7]研究显示,双侧海马、POC及岛叶较适合作为嗅觉fMRI研究的兴趣区,这些脑区的激活水平与嗅觉感受能力及受试者病情体质显著相关,而POC区是不经过丘脑直接接受来自嗅球所传导的嗅觉刺激的皮层结构,包括嗅核、梨状皮层、嗅结节、杏仁核、杏仁核周围皮层和内嗅皮层[8],是AD早期病理改变累及的脑区。
由于正常老年人存在脑神经组织退变所致嗅觉功能减退[9],故进行控制年龄因素的激活水平与神经心理学评分的相关性分析,结果显示3组受试者的POC激活体素数量与MMSE评分及MOCA评分在控制年龄因素条件下呈正相关性。Royall等[10]对200个社区老年居民进行宾夕法尼亚大学气味识别能力测试(university of Pennsylvania smell identification test,UPSIT)与MMSE评分,发现嗅觉能力与认知能力有相关性。本研究结果也显示嗅觉fMRI的激活水平与认知能力具有相关性。Kareken等[11]对AD患者和正常老年人进行PET研究,结果提示嗅觉识别能力与右侧梨状皮层的功能活动程度具有相关性。与UPSIT等主观检查相比,嗅觉fMRI可以直接检测嗅觉相关脑区的细胞活动水平,无需受检者的主观反馈,干扰因素更少[12];相对于PET,嗅觉fMRI具有更好的时间分辨力,更加适合需要精确控制的事件相关设计的研究方法。
本研究中MCI组与NC组、AD组间激活水平具有显著差异。MCI最终转归AD的概率为55%左右[13],AD所致MCI占全部MCI患者的比例应相似或更高。AD所致MCI患者可能会因为嗅觉脑区病理改变导致嗅觉fMRI激活减低,因此可以对MCI患者进一步随访,研究其嗅觉fMRI的激活水平与AD转归的相关性,评估嗅觉fMRI鉴别AD所致MCI的能力。本研究中3组单个独立样本组分析结果显示,NC组3个右侧脑区的激活水平均高于左侧,且MCI组较NC组右侧脑区激活减低较左侧显著。对于嗅觉半球优势的观点较多,伍建林等[14]的研究显示右侧大脑半球为嗅觉的优势半球;Pantel等[15]的研究提示早期AD病理改变存在右侧大脑半球优势分布,本研究结果均与以上结论相似;但Bottino等[16]提出左侧优势的观点。
3组受试者组内变异均较大,会影响嗅觉fMRI判断AD病理改变的准确度和敏感度。嗅觉fMRI较视觉、听觉的功能成像更为复杂,主要受到颅底部磁敏感伪影、嗅觉适应效应及受试者个体差异的影响,本研究通过较为特殊的设计尽量减少这些因素的干扰。由于本研究主要观察的ROI靠近颅底的脑实质-脑脊液-颅骨分界,会受到磁敏感伪影的影响,通过缩短TE时间[17]、提高空间分辨率[18]、调整层面与相位编码方向[19]等方法可以提高图像的信噪比,而Wang等[7]在研究中采用较大的采集带宽、较强的层面梯度磁场和常规匀场来解决这个问题。
本研究所使用的设备是3.0T MRI仪和32通道线圈,在成像参数中采用较短的TE时间及较薄的扫描层厚,扫描过程中预先进行常规匀场,并将相位编码方向从默认的左右方向改为前后方向,显著提高了颅底部脑实质的信噪比,可以进行成像研究。目前尚难以完全避免或准确评估磁敏感伪影对研究结果的影响,这是本研究的主要局限性,也是下一步研究需要解决的主要问题。
为了避免嗅觉适应,本研究所采用的事件相关设计与传统的组块设计不同。本研究在预实验中对不同的刺激时间和间隔时间与刺激浓度进行测试,与Levy等[20]的研究结论相似,较短的刺激时间与较长的刺激间隔和不同的刺激气味可以减轻嗅觉适应效应,因此,较长的刺激时间、重复给予刺激任务的组块设计是不适宜的,本研究采用6 s为单次刺激时间,6 s是人类单次呼吸周期,可以视为单次刺激,数据处理亦是提取这些刺激的激活信息。薰衣草是一种有效的嗅觉刺激物,且几乎无对三叉神经的多余刺激[21]。对于个体差异的问题,本研究采用SPM软件进行数据处理,将所有受试者的结构像、激活像与统一的模板进行空间标准化,以减小不同受试者脑结构的个体差异,选取POC做ROI所示激活与嗅觉功能的相关性较高,但仍存在不同受试者脑神经活动方面的个体差异。由于以上干扰因素的影响,目前尚不足以将嗅觉fMRI作为临床诊断AD的工具,需要进一步研究。
总之,嗅觉fMRI可以通过反映AD病理改变为AD早期诊断提供有价值的信息,控制主要干扰因素后,嗅觉fMRI可能提供较为准确的量化及可视化信息,有望成为诊断AD敏感性较高的新方法,值得进一步研究。本课题组将继续扩大样本量并进行随访,进一步研究和改进实验方法,以减少干扰因素的影响。
[1] Jack CR Jr, Albert MS, Knopman DS, et al.Introduction to the recommendations from the National Institute on Aging-Alzheimer's Association workgroups on diagnostic guidelines for Alzheimer's disease.Alzheimers Dement, 2011, 7(3): 257-262.
[2] Braak H, Braak E.Neuropathological staging of Alzheimerrelated changes.Acta Neuropathol (Berl), 1991, 82(6): 239-259.
[3] Folstein MF, Folstein SE, Mchugh PR."Mini-mental state".A practical method for grading the cognitive state of patients for the clinician.J Psychiatr Res, 1975, 12(3): 189-198.
[4] Nasreddine ZS, Phillips NA, Bédirian V, et al.The Montreal Cognitive Assessment.MoCA: a brief screening tool for mild cognitive impairment.J Am Geriatr Soc, 2005, 53(4): 695-699.
[5] Morris JC.The clinical dementia rating (CDR): current version and scoring rules.Neurology, 1993, 43(11): 2412-2414.
[6] 尹建忠 , 王建利 , 杨庆宪 , 等.阿尔茨海默病与轻度认知障碍患者初级嗅觉皮层的形态与功能改变.中华放射学杂志,2010, 44(1): 57-60.
[7] Wang J, Eslinger PJ, Doty RL, et al.Olfactory deficit detected by fMRI in early Alzheimer's disease.Brain Res, 2010,1357(10): 184-194.
[8] Zelano C, Bensafi M, Porter J, et al.Attentional modulation in human primary olfactory cortex.Nat Neurosci, 2005, 8(1):114-120.
[9] Doty RL.Odor perception in neurodegenerative diseases//Doty RL.Handbook of olfaction and gestation.2nd ed.New York:Marcel Dekker, 2003.
[10] Royall DR, Chiodo LK, Polk MS, et al.Severe dysosmia is specifically associated with Alzheimer-like memory deficits in nondemented elderly retirees.Neuroepidemiology, 2002,21(2): 68-73.
[11] Kareken DA, Doty RL, Moberg PJ, et al.Olfactoryevoked regional cerebral blood flow in Alzheimer's disease.Neuropsychology, 2001, 15(1): 18-29.
[12] 刘剑锋 , 有慧 , 倪道凤 , 等.嗅觉正常与失嗅者嗅觉事件相关功能磁共振成像的观察.中华医学杂志 , 2008, 88(22):1543-1546.
[13] Petersen RC, Smith GE, Waring SC, et al.Mild cognitive impairment: clinical characterization and outcome.Arch Neurol, 1999, 56(3): 303-308.
[14] 伍建林 , 张清 , 张竞文 , 等.愉快及非愉快气体激活相应脑区的功能磁共振成像实验研究.中国医学影像技术, 2006,22(1): 2-6.
[15] Pantel J, Kratz B, Essig M, et al.Parahippocampal volume deficits in subjects with aging-associated cognitive decline.Am J Psychiatry, 2003, 160(2): 379-382.
[16] Bottino CM, Castro CC, Gomes RL, et al.Volumetric MRI measurements can differentiate Alzheimer's disease, mild cognitive impairment, and normal aging.Int Psychogeriatr,2002, 14(1): 59-72.
[17] Small DM, Gerber JC, Mak YE, et al.Differential neural responses evoked by orthonasal versus retronasal odorant perception in humans.Neuron, 2005, 47(4): 593-605.
[18] Bellgowan PS, Bandettini PA, van Gelderen P, et al.Improved BOLD detection in the medial temporal region using parallel imaging and voxel volume reduction.Neuroimage, 2006,29(4): 1244-1251.
[19] Weiskopf N, Hutton C, Josephs O, et al.Optimized EPI for fMRI studies of the orbitofrontal cortex: compensation of susceptibility-induced gradients in the readout direction.MAGMA, 2007, 20(1): 39-49.
[20] Levy LM, Henkin RI, Lin CS, et al.Rapid imaging of olfaction by functional MRI (fMRI): identification of presence and type of hyposmia.J Comput Assist Tomogr, 1999, 23(5): 767-775.
[21] Patton HD.Taste, olfaction and visceral sensation//Ruth TC,Fulton JF.Medical physiology and biophysics.Philadelphia:Saunders, 1960.

