非小细胞肺癌脑转移患者两种放疗分割模式及疗效评估
许 光
杨 旭2 YANG Xu
宋丽萍3 SONG Liping
刘锦东1 LIU Jindong
张奎权1 ZHANG Kuiquan
1.辽宁医学院附属第三医院肿瘤放射治疗科辽宁锦州 121001
2.辽宁医学院附属第一医院放射科 辽宁锦州 121000
3.辽宁医学院附属第一医院核医学科 辽宁锦州 121000
肺癌是全世界癌症死亡的首要原因,非小细胞肺癌(NSCLC)占肺癌的80%以上[1],其预后不良,主要原因是脑转移,发生脑转移的NSCLC患者死亡率明显高于无转移患者[2]。放疗技术的出现延长了肺癌脑转移患者的生存期,改善了生活质量[3]。然而,几乎所有的放疗患者都有不同程度的放射性脑损伤,使放疗不能正常进行,患者因不能耐受而被迫终止放疗,从而降低了放疗对肿瘤病灶的治疗效果,影响了患者的生活质量和生存率[4]。近年来,越来越多的临床医师应用不同放疗剂量,在减少放射性脑损伤的同时控制病情的发展[5]。实体瘤的疗效评估标准越来越多地应用于临床[6],而2009年修订的实体瘤疗效评估标准RECIST 1.1用于评估脑转移瘤及与WHO标准、RECIST 1.0标准在评价NSCLC脑转移方面的一致性研究较少。因此,本研究拟比较两种放疗分割模式,以寻找较理想的治疗方案,并探讨3种实体瘤评价标准的一致性。
1 资料与方法
1.1 研究对象 选取2009-06~2012-03辽宁医学院附属第三医院肿瘤放射治疗科经病理或细胞学检查确诊的83例NSCLC患者,纳入标准:①Kanofsky评分>60分;②根据临床症状、体征和CT、MRI等影像学表现确诊为脑转移;③根据RECIST,至少有1个可以测量的肿瘤客观病灶(指肿瘤病灶最长径及其最大垂直径均可测量,头部螺旋CT显示最长直径≥1 cm)。其中男50例,女33例;年龄44~74岁,中位年龄59岁。83例患者按照不同放疗分割模式分为A组(39例)和B组(44例)。本研究经辽宁医学院附属第三医院医学伦理委员会审核同意,所有患者均签署知情同意书。
1.2 仪器与方法
1.2.1 仪器 X线模拟定位机(山东新华医疗器械股份有限公司SL-IE);CT模拟定位机(Toshiba Aquilion 64);治疗计划系统(Topslane Venus TPS);医用电子直线加速器(Siemens Primus M)。
1.2.2 治疗方案 患者治疗开始前1周内行头部螺旋CT扫描,层厚6 mm,扫描范围自颅顶至颅后窝底,测量肿瘤最长径和最大垂直径,记录不可测量的病灶。所有患者均行全脑放疗(WBRT)加局部推量。放疗采用常规分割,每周照射5次。A组患者WBRT单次处方剂量(DT)为 3 Gy,DT 30 Gy/10 次 /2 周后局部推量 DT 30 Gy/15 次 /3 周,总治疗剂量达 DT 60 Gy ;B 组患者 WBRT 单次处方剂量为 2 Gy,DT 40 Gy/20 次 /4 周后局部推量DT 20 Gy/10次/2周,总治疗剂量达DT 60 Gy。患者仰卧于X线模拟机下,选择合适的头枕,摆正体中线,调整双侧外耳孔体位,使面部平行于床面,颅底线垂直于床面后热塑面罩固定。全脑照射采用头颅两侧对穿野,野下界沿眉弓上缘至外耳孔水平连线包括颅前窝、颅中窝、颅后窝。全脑照射选用6 MV X线。局部推量采用三维适形放疗技术,以热塑面罩固定患者头颅后,行颅脑螺旋CT扫描,图像传输至Venus治疗计划系统,勾画靶区,肿瘤靶区(gross tumor volume, GTV)外放 6 mm 为临床靶区(clinical target volume, CTV),CTV 外放 3 mm 为计划靶区(planning target volume, PTV),95% 等剂量曲线覆盖 PTV。采用医用电子直线加速器,选择6 MV X线,2 Gy/F,局部推量后总治疗剂量达DT 60 Gy。同时给予地塞米松、甘露醇脱水、降颅压治疗。放疗后6周复查头部CT,测量肿瘤的最长径和最大垂直径,并记录不可测量病灶,进行放疗疗效评价(图1~3)。
1.3 疗效评价[7,8]治疗后疗效分为完全缓解(CR):所有已知病灶消失;部分缓解(PR):WHO标准定义为肿瘤双径乘积之和减少50%,RECIST 1.0与RECIST 1.1标准定义为肿瘤最大单径之和减少30%;疾病进展(PD):WHO标准定义为双径乘积之和增加25%或出现新病灶,RECIST 1.0与RECIST 1.1标准定义为最大单径之和增加20%或出现新病灶;病灶稳定(SD):除CR、PR、PD之外的其他病灶。以CR+PR计算反应率(RR%),以PD计算进展率(PD%)。

图1 患者女,48岁,肺鳞癌。A.放疗前1周内头部CT测量目标病灶(箭)大小;B.行WBRT DT 40 Gy/20次/4周后局部推量DT 20 Gy/10次/2周后头部CT示目标病灶缩小(箭),WHO标准评定为PR,RECIST 1.0/1.1标准评定为SD

图2 患者男,58岁,肺腺癌。A.放疗前1周内头部CT测量目标病灶(箭)大小,并记录1个直径<1 cm病灶(箭头);B.行WBRT DT 40 Gy/20次/4周后局部推量DT 20 Gy/10次/2周后头部CT示目标病灶(箭)稳定,WHO、RECIST 1.0/1.1标准评定为SD

图3 患者男,71岁,肺鳞癌。A.放疗前1周内头部CT测量目标病灶(箭)大小;B.行WBRT DT 30 Gy/10次/2周后局部推量DT 30 Gy/15次/3周后头部CT示目标病灶(箭)大小,WHO标准评定为PD,RECIST 1.0/1.1标准评定为SD
1.4 随访 所有患者放疗后6个月左右进行随访,通过临床症状、体征及头部影像检查的改变,观察患者放疗后的急性毒性反应。
1.5 统计学方法 采用SPSS 17.0软件,以Wilcoxon秩和检验评估放疗疗效,采用Kappa检验比较3种标准评价放疗疗效的一致性,P<0.05表示差异有统计学意义。
2 结果
2.1 两种放疗分割模式疗效比较 根据RECIST 1.1标准,B组疗效优于A组,两组比较,差异有统计学意义(Z=-3.597,P<0.01),见表1。放疗后,A 组5例发生急性放射性脑水肿,其中脑白质水肿较灰质更为明显;3例神经症状;20例出现头部一般症状,以头晕、头痛、乏力为主要表现;B组18例出现头部一般症状,包括嗜睡、厌食、情绪淡漠、头痛、眩晕等。
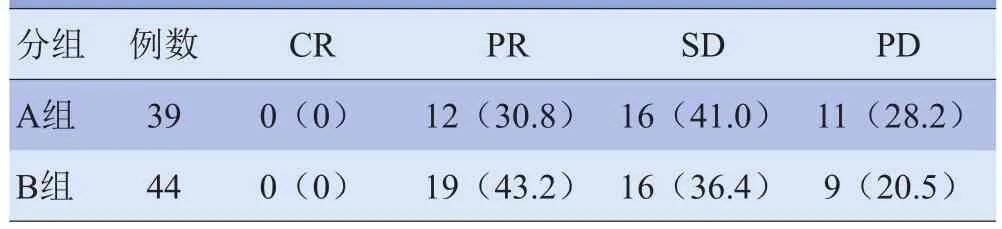
表1 两组患者经RECIST 1.1标准疗效评估比较[n(%)]
2.2 3种标准评估NSCLC脑转移放疗疗效的一致性WHO标准与RECIST1.0标准、RECIST1.1标准(Kappa=0.945、0.945,P<0.05)、RECIST 1.0标准与RECIST 1.1 标准(Kappa=1,P<0.05)评估 NSCLC 脑转移放疗疗效的一致性较好。WHO、RECIST 1.0、RECIST 1.1的RR%和PD%分别为36.1%、37.3%、37.3%和27.7%、24.1%、24.1%。3例WHO标准评价为PD,而RECIST 1.0/1.1标准评价1例为PR,2例为SD。
3 讨论
3.1 NSCLC脑转移两种放疗分割模式比较 进展期肺癌患者通常会发生脑转移,提示肿瘤细胞经血液转移到远处器官。脑是最容易发生转移的部位,而且通常会伴随颅外器官转移。NSCLC的脑转移率为20%~30%,低于小细胞肺癌的脑转移率(50%)[2]。脑转移常出现颅内高压症状,是导致患者死亡的直接原因。对于多个病灶或单个不能手术的病灶,WBRT是最常用、最有效的治疗方法,可以迅速减轻脑转移患者的神经系统症状,改善患者的神经功能,延长患者的无进展生存期。然而,大剂量WBRT可以造成放射性脑损伤,甚至引起脑萎缩和脑实质坏死[2]。因此,放疗剂量如何分割能达到最佳疗效、减轻患者的毒性反应,引起临床医师的关注。
本研究结果显示,行全脑照射DT 40 Gy/20次/4周后局部推量DT 20 Gy/10次/2周治疗后,患者近期疗效优于行全脑照射DT 30 Gy/10次/2周后局部推量DT 30 Gy/15次/3周的患者。治疗后6个月内,A组5例患者发生急性放射性脑水肿,其中脑白质水肿较灰质更为明显;3例表现为小脑神经损害症状;20例以头晕、头痛、乏力为主要症状。B组18例表现为嗜睡、厌食、情绪淡漠、头痛、眩晕等症状,毒性反应明显轻于A组。造成两组患者毒性反应不同的主要原因是剂量分割不同,其次是因为患者对射线的敏感度及病灶的单发与多发不同。在局部控制近期疗效方面,B组优于A组。WBRT加局部推量可以使脑转移受照射剂量大于全脑照射,使患者取得更大的临床获益,尤其是预期寿命较长的患者,提高放疗剂量可以改善局部控制率和总体生存率[9]。
3.2 WHO、RECIST 1.0与RECIST 1.1标准评估NSCLC脑转移放疗疗效的一致性 本研究结果发现WHO、RECIST 1.0和RECIST 1.1标准对肺癌脑转移放疗的疗效评估一致性较好,尽管WHO标准与RECIST 1.0标准和RECIST 1.1标准存在差异,3例WHO标准评价为PD,而RECIST 1.0/1.1标准评价1例为PR,2例为SD,但三者反应率相近(RR%分别为36.1%、37.3%、37.3%)。WHO 标 准 与 RECIST 1.0、RECIST 1.1 标准对PD的定义不同,当脑转移瘤瘤体最长径变化不大、而横径变化大时,WHO标准则与RECIST 1.0、RECIST 1.1标准存在差异。本研究结果发现RECIST 1.0标准和RECIST 1.1标准无差别,与既往研究[10]结果不同,其可能原因为RECIST 1.1标准规定短轴值>1.5 cm的淋巴结是可以检测和评估的目标病灶[7]。本研究仅评估了脑转移放疗疗效的一致性,肺内原发病灶及其他转移病灶不计,故未将淋巴结作为目标病灶,而 RECIST 1.0 标准和 RECIST 1.1 标准的区别在于RECIST 1.1标准中的肿大淋巴结,故RECIST 1.0标准和RECIST 1.1标准评估无差别。
本研究的局限性在于病例数少、随访时间短,只能比较两种放疗剂量分割模式的近期疗效和急性毒性反应,未能观察长期疗效。因此,有待于进一步深入研究,既能提高生存率又能控制毒性反应的具体放疗剂量。
总之,NSCLC脑转移患者采用全脑放疗DT 40 Gy/20次/4周后局部推量DT 20 Gy/10次/2周的治疗方案近期疗效较优,且放疗后急性毒性反应较低;WHO、RECIST 1.0、RECIST 1.1 标准每两种评价标准间均有较好的一致性。
[1] Kang KM, Jeong BK, Ha IB, et al.Concurrent chemoradiotherapy for elderly patients with stage III non-small cell lung cancer.Radiation oncology journal, 2012, 30(3): 140-145.
[2] Liu WJ, Zeng XT, Qin HF, et al.Whole brain radiotherapy plus chemotherapy in the treatment of brain metastases from lung cancer: a meta-analysis of 19 randomized controlled trails.Asian Pac J Cancer Prev, 2012, 13(7): 3253-3258.
[3] Zeng YD, Li Z, Hai L, et al.Gefitinib alone or with concomitant whole brain radiotherapy for patients with brain metastasis from non-small-cell lung cancer: a retrospective study.Asian Pac J Cancer Prev, 2012, 13(3): 909-914.
[4] Wang YL, Liu MY, Li JF, et al.Application value of apparent diffusion coefficient in differentiation of brain radiationinjuries and glioma recurrence.Zhongguo Yi Xue Ke Xue Yuan Xue Bao, 2012, 34(4): 396-400.
[5] 邱幸生 , 陈龙华 , 陈永清 , 等.非小细胞肺癌脑转移低分割放疗疗效分析.第一军医大学学报 , 2005, 25(11): 1375-1378.
[6] Riaz A, Memon K, Miller FH, et al.Role of the EASL,RECIST, and WHO response guidelines alone or in combination for hepatocellular carcinoma: radiologicpathologic correlation.J Hepatol, 2011, 54(4): 695-704.
[7] Eisenhauer EA, Therasse P, Bogaerts J, et al.New response evaluation criteria in solid tumours: revised RECIST guideline(version 1.1).Eur J Cancer, 2009, 45(2): 228-247.
[8] Konishi K, Kuriyama K, Chino S, et al.CT evaluation of response to chemotherapy and/or radiotherapy in primary lung cancer: comparison of response evaluation criteria in solid tumors (RECIST) and the WHO criteria, and comparison of both methods with the histological evaluation.Nihon Igaku Hoshasen Gakkai Zasshi, 2004, 64(1): 41-45.
[9] Rades D, Panzner A, Dziggel L, et al.Dose-escalation of whole-brain radiotherapy for brain metastasis in patients with a favorable survival prognosis.Cancer, 2012, 118(15): 3852-3859.
[10] 杨旭 , 许光 , 雷振 , 等.RECIST 1.1 与 WHO、RECIST 1.0标准评价周边型肺癌疗效比较.中国医学影像学杂志,2012, 20(5): 355-358, 362.

