MRI、钼靶和超声对乳腺非肿块样强化病变诊断的对比研究
李 晓
程流泉1 CHENG Liuquan
刘 梅3 LIU Mei
李俊来4 LI Junlai
王知力4 WANG Zhili
李席如5 LI Xiru
邢 宁1 XING Ning
1.解放军总医院放射科 北京 100853
2.河南中国平煤神马医疗集团总医院放射科河南平顶山 467000
3.解放军总医院病理科 北京 100853
4.解放军总医院超声科 北京 100853
5.解放军总医院普通外科 北京 100853
非肿块样强化(non-mass like enhancement, NMLE)病变的定义来源于MRI乳腺影像报告和数据系统(BI-RADS),指在MRI图像上无占位效应的一类病变[1]。由于NMLE病灶松散,病灶中间夹杂正常的纤维腺体和脂肪组织,多数病变经钼靶和超声检出的阳性率较低,动态增强MRI通过血供特征显示病灶,具有较高的敏感度[2-4]。本研究拟回顾性分析80例乳腺NMLE病变的MRI、超声和钼靶诊断效能,比较三者对NMLE病变的诊断价值。
1 资料与方法
1.1 研究对象 选择2009-01~2011-08在解放军总医院放射科完成乳腺MRI检查且有病理结果的NMLE患者80例,年龄21~70岁,平均(46±19)岁。纳入标准:①在MRI上由2位医师共同判断为NMLE,MRI上NMLE病灶的定义为:A.增强扫描无明确的占位效应;B.平扫T1WI病灶与周围脂肪、腺体信号无明确分界。②在1个月内先后接受钼靶、超声和MRI检查,期间无活检、手术等干扰因素。③未绝经妇女于月经后3~7 d接受乳腺检查。④检查后经穿刺或手术病理证实。排除标准:检查病灶与手术病理病灶不对应者。
1.2 仪器与方法 MRI扫描采用 GE Signa Excite 1.5T双梯度磁共振仪,4通道乳腺专用线圈。患者取俯卧位,双侧乳腺自然悬垂。扫描序列包括:①SE-T1WI序列,TR 500 ms,TE 8.3 ms,矩阵 256×224。② FSET2WI脂肪饱和序列,TR 4660 ms,TE 89 ms,矩阵320×256。③ EPI-DWI序列,TR 8400 ms,TE 73.2 ms,b值取0、1000 s/mm2,矩阵128×128。上述3个平扫序列均采用横轴位扫描,视野(FOV) 32~34 cm,层厚4 mm,间隔1 mm。④动态增强扫描使用三维扰相位梯度回波序列(VIBRANT 序列):TR 4.8 ms, TE 2.3 ms,层厚 1.2 mm,FOV 32~34 cm,矩阵 320×320。连续采集6个时相,每个时相扫描时间120 s,从第二个时相扫描开始按照0.2 mmol/kg静脉团注钆喷替酸葡甲胺,注射速度为2 ml/s,然后注射等量生理盐水冲刷。钼靶检查采用GE Senograph 2000D全视野数字化钼靶乳腺摄影机,标准四投照位,并根据需要局部点片,AOP全自动数字曝光参数。超声检查使用Aloka、Siemens和GE等彩色多普勒超声诊断仪,变频线阵探头频率为 5~13 MHz、7~10 MHz,检查内容包括灰阶和彩色多普勒,由超声科医师完成。
1.3 图像分析 MRI、钼靶和超声诊断均参考医疗诊断报告,由2位医师达成一致意见或者由5年以上经验医师诊断。所有病灶均按照美国放射学会BI-RADS分级标准进行分级,BI-RADS 1~4级病灶划分为良性,5级病灶划分为恶性。
1.4 病理检查 病理标本均采用HE染色及肿瘤细胞的免疫组化分析,做出良性或恶性的诊断。
1.5 统计学方法 以病理诊断为“金标准”,分别计算钼靶、超声、MRI诊断乳腺癌的敏感度、特异度及准确度。
2 结果
2.1 病理结果与诊断效能 80例患者病理诊断良性29例,恶性51例。29例浸润性导管癌中,21例合并弥漫的乳腺导管内癌(DCIS)成分,病理结果见表1。导管内乳头状瘤、不典型导管上皮增生(ADH)和纤维腺瘤均合并病灶周围腺病改变。
2.2 钼靶、超声及MRI的诊断效能 钼靶、超声和MRI诊断乳腺良、恶性病变与病理结果比较见表2,三者的诊断效能见表3。
2.3 影像特征与诊断分析 在钼靶诊断结果中,致密型62例,均衡型11例,疏松型7例。钼靶低估的30例病灶中,21例无异常发现(图1),均为致密型乳腺;高估的1例存在簇集样钙化,BI-RADS 4级。钼靶准确预测的21例病灶中,20例均存在钙化(簇集样、沙砾样、多形钙化),1例为不对称高密度(表4)。
超声低估的32例病灶中,3例报告为阴性;22例报告为无明显血流的低回声结节;7例乳腺增生和乳管扩张。超声高估的2例病灶中,1例导管内乳头状瘤有钙化,1例肉芽肿性乳腺炎有血流信号(表5)。
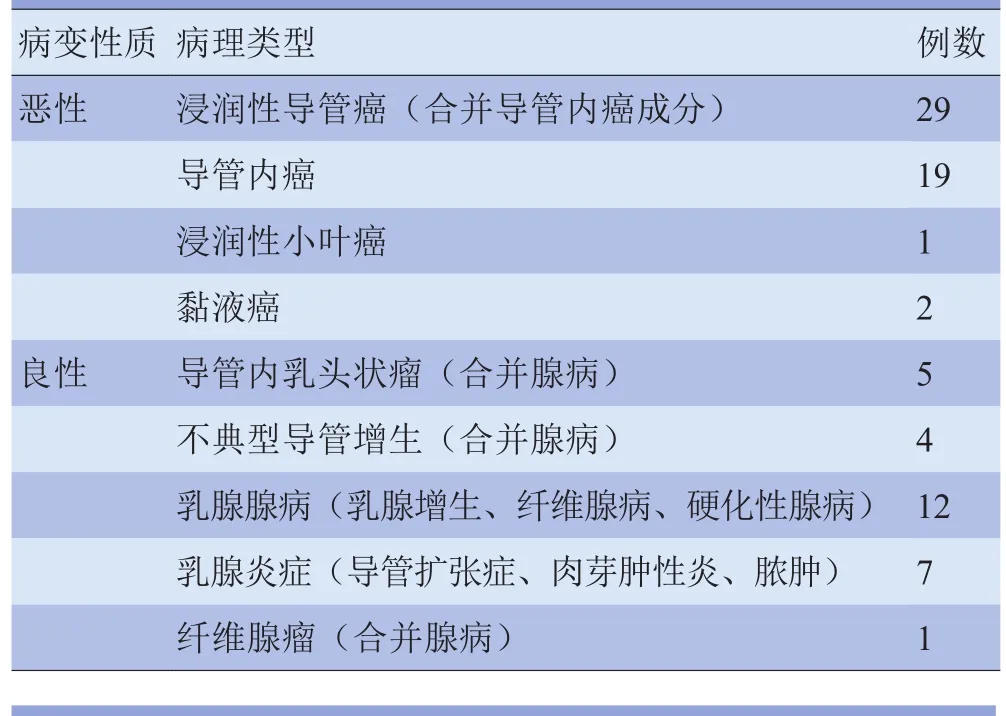
表1 80例患者的病理特征
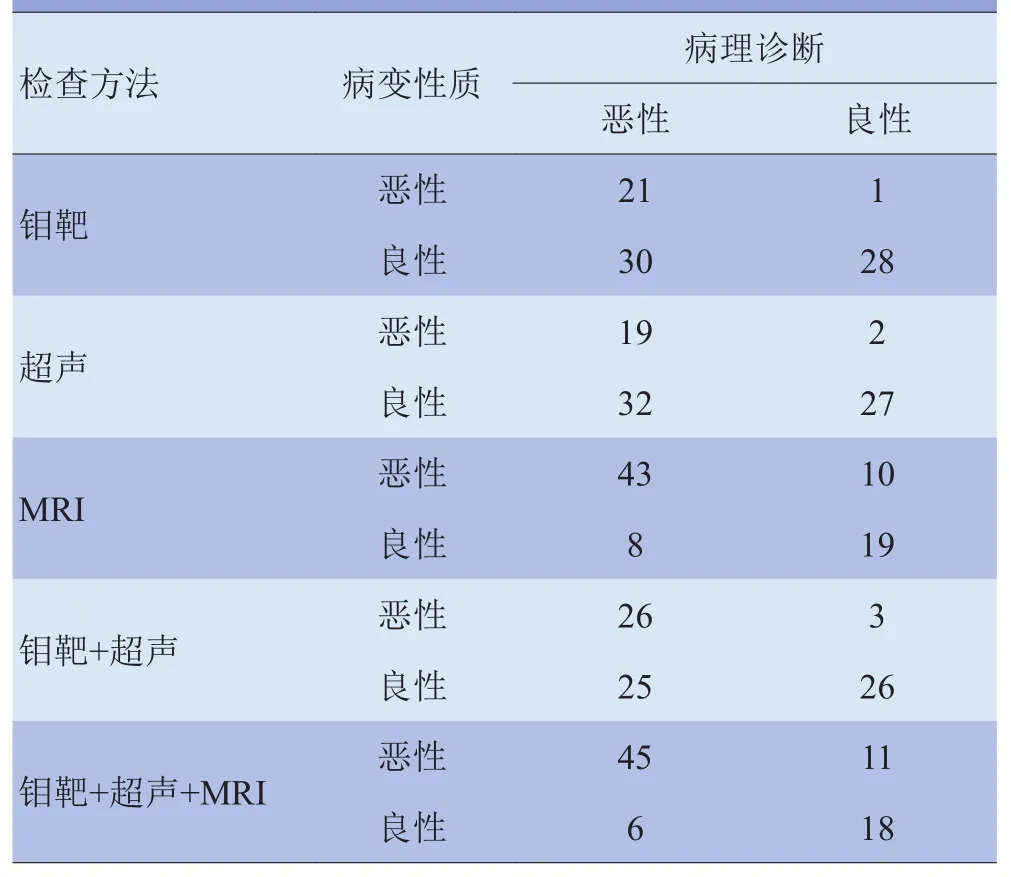
表2 钼靶、超声和MRI诊断乳腺良、恶性病变与病理结果比较
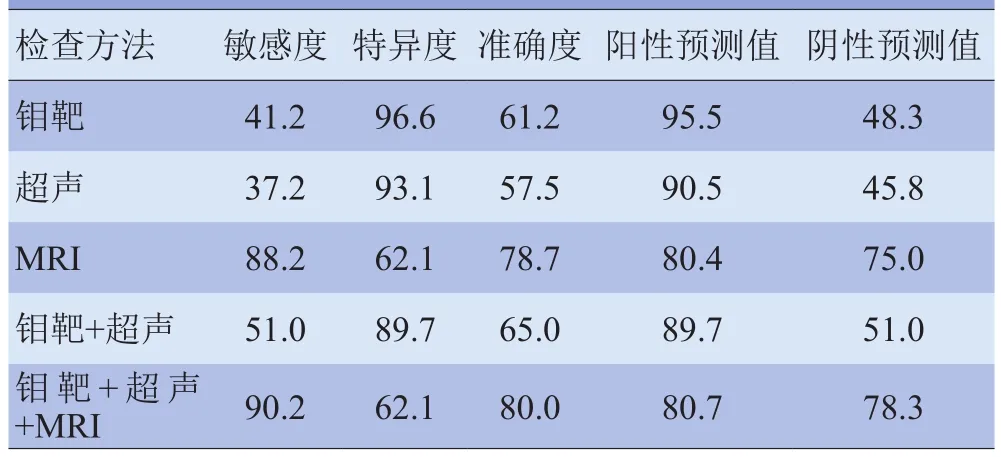
表3 钼靶、超声和MRI的诊断效能比较(%)
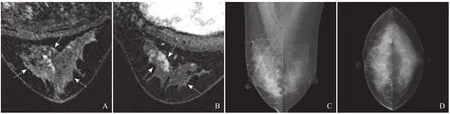
图1 双侧乳腺多发NMLE病灶。A.右侧乳腺沿导管分布的簇集样强化,BI-RADS 4级;B.左侧乳腺局灶强化,BI-RADS 4级;C、D分别为双侧乳腺斜位和轴位,在对应区域未见结构紊乱、不对称密度或钙化,BI-RADS 1级。病理:双侧乳腺导管内原位癌
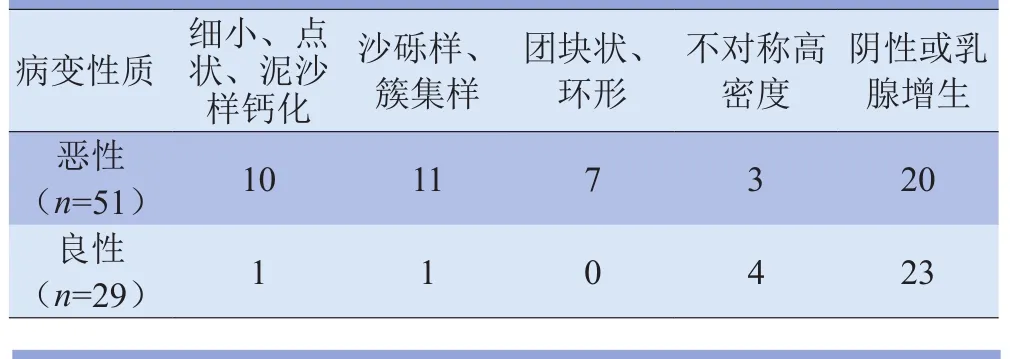
表4 病灶的钼靶影像特征
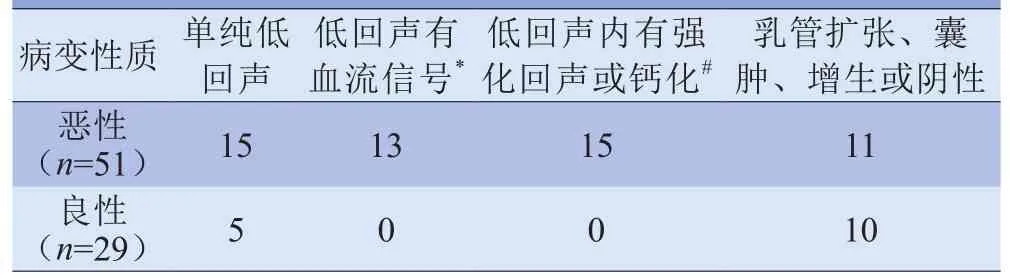
表5 病灶的超声影像特征
MRI低估的8例病灶中,1例为浸润性导管癌合并导管内癌成分,1例为浸润性小叶癌,1例为黏液腺癌,5例为高级别的DCIS。MRI高估的10例病灶中,2例导管内乳头状瘤,1例ADH,4例炎症(有乳腺导管扩张或脓肿),3例纤维腺病。58例MRI表现为小叶节段分布,其中44例预测为恶性,38例为病理恶性,4例为乳腺炎。时间-信号强度曲线(TIC)分型:廓清型(Ⅲ)曲线恶性病灶占86.1%(31/36),平台型(Ⅱ)曲线占 55.6%(15/27),流入型(Ⅰ)曲线占 26.7%(4/15)。ADC值<1.35×10-3mm2/s的病灶中恶性病灶占85.1%(40/47),见表6。
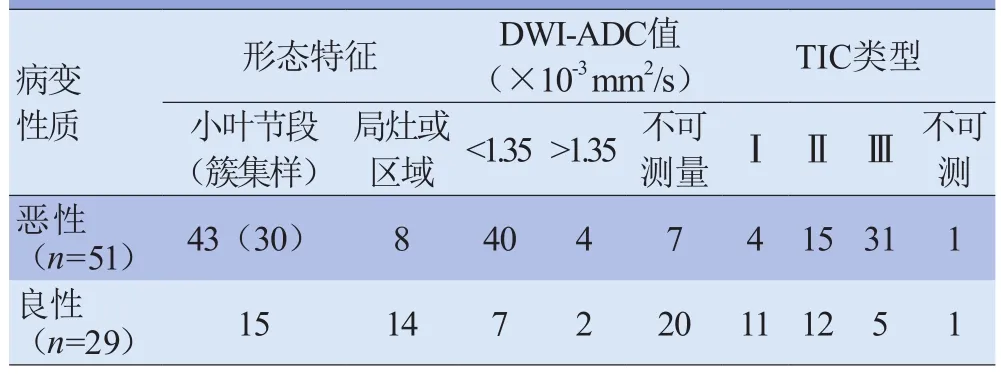
表6 病灶的 MRI影像特征
MRI低估的8例病灶中,2例钼靶诊断存在恶性钙化被钼靶校正,1例表现为不规则的低回声结节被超声校正;MRI高估的病变钼靶全部诊断为良性,而1例肉芽肿性炎和1例导管内乳头状瘤被超声诊断为恶性。超声低估的32例病灶中,19例表现为低回声结节且与MRI显示病灶范围不对应,超声诊断的低回声结节主要是MRI显示的小叶节段病灶中的较明显部分,具有一定的占位效应;27例真阴性预测中,10例未显示MRI报告的病灶,13例报告为低回声结节,与MRI报告的范围不对应(图2)。
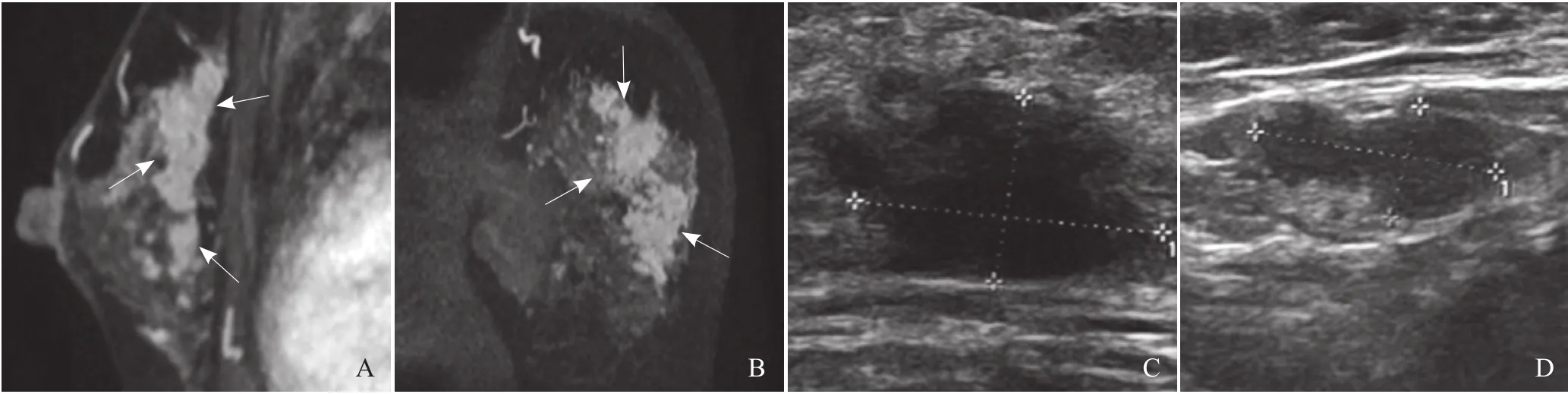
图2 左侧乳腺外上、内上象限NMLE病变。A、B分别为MRI矢状位和冠状位图像,显示病灶分布特征累及多个小叶节段、簇集样强化,病灶融合有肿块的特征,BI-RADS 5级;C.超声显示病灶内结节,距离乳头2 cm处,大小约1.7 cm×1.0 cm×1.4 cm,边缘不规则,彩色多普勒血流显像示少量点状血流,BI-RADS 5级;D.病灶周边多个小结节,较大者0.7 cm×0.6 cm,边缘不规则,彩色多普勒血流显像示少量点状血流。根据超声报告拟行保乳手术,MRI显示为NMLE病灶,范围接近1/2乳腺体积,大于超声报告范围,否认保乳手术。病理:浸润性乳腺癌伴大量导管内成分,病灶的实际范围与MRI一致
3 讨论
3.1 NMLE病变的定义与病理 NMLE病变的定义来自于MRI BI-RADS,在超声和钼靶的BI-RADS字汇中无NMLE或非肿块样病变的概念[5,6]。在MRI图像上,较小的NMLE病灶呈局灶分布,形态特征不明确,无特异性;较大的NMLE病灶呈区域分布或小叶节段分布,可以累及1个或多个象限。常规T2WI和T1WI与正常的腺体信号一致,较难分辨;在以血供为判断依据的增强MRI图像上,这些病灶突出显示[2,7]。NMLE病灶可以是乳腺癌的早期表现,如本研究中的1例浸润性小叶癌和2例黏液腺癌,因为病灶小且无明确边界,被划分为局灶分布的NMLE;良性病变合并周围腺病时,在分布特征上容易归为NMLE病灶。病理学研究表明,DCIS多表现为NMLE,而浸润性乳腺癌多表现为肿块型;表现为NMLE的乳腺癌在组织学上具有更高的异质性,以DCIS为主[8-12]。本研究中,单纯DCIS占恶性病变的37.3%(19/51),浸润性导管癌占恶性病变的56.8%(29/51),病理上多数浸润性导管癌合并弥漫的导管内成分,MRI图像上DCIS和浸润性导管癌多数呈小叶节段分布。
NMLE病灶的组织特征与邻近的纤维腺体相似,在超声上回声对比差异较小,无明确边界;钼靶主要表现为不对称高密度或钙化。本研究以MRI定义NMLE病变为研究对象,回顾性分析超声和钼靶的表现,结果显示,钼靶和超声的敏感度较低,分别为41.2%和37.2%,远低于MRI的88.2%,也低于国内文献报道的平均水平[13-17]。回顾分析这些相关文献,除王知力等[18]在超声研究中给出了明确的NMLE纳入标准外,其他研究并未给出具体的诊断标准,只是以钼靶或超声无明确边界、不规则低回声、非对称高密度、结构扭曲为依据纳入研究,其纳入研究对象与本研究存在差异。
3.2 超声诊断NMLE病变 超声主要依靠病灶内部回声、整体形态、周边是否侵及来判断病灶的性质;高频超声的局限性在于小的恶性肿瘤后方回声衰减显示率低[19,20]。NMLE的病变在超声上主要表现为片状的低回声或中等回声,伴或不伴钙化,灰阶差别不显著,不易被超声检测;对病灶性质的判断很大程度上依赖多普勒检测的血流信号和呈现为强回声的微钙化灶。然而,肿瘤内部血流信号检出率低,同时肿块内部微小钙化灶极少或微小钙化,导致诊断敏感度降低[21]。超声表现出的钙化与病例上的钙化相符率不高[22]。本研究分析超声测量的病灶大小发现,超声测量的低回声部分仅仅是MRI和病理病灶上的一部分,而非全部病灶,这些低回声来自肿瘤组织相对集中的区域,在MRI上有时表现为簇集样强化,甚至轻微占位效应。随着超声技术不断发展,超声增强造影、超声弹性成像等均有望突破组织回声的差别,提高显示病灶的效能[23]。
3.3 钼靶诊断NMLE病变 钼靶检测NMLE病灶显示为结构不对称、不规则的高密度、结构紊乱和钙化,但是在致密型乳腺中,结构不对称、不规则的高密度和结构紊乱显示效果较差,鉴别困难[13-17]。本研究中钼靶的诊断敏感度较低(41.2%),主要原因是致密型腺体较多(77.5%),这是与其他文献比较差异的来源。多数阳性预测都是因为钙化,但是发生在位于乳腺内或乳腺高位、深位的致密型病灶,以及在重度乳腺增生基础上并发的病灶,可以因增生而掩盖病灶,另外受操作及阅片水平等因素的影响,钼靶诊断阳性率不尽相同[3];特别是非肿块性病灶较松散,致使诊断阳性率进一步降低。
3.4 MRI诊断NMLE病变 本研究中MRI的诊断指标包括病灶的形态学特征、动态增强曲线和DWI-ADC值,形态学特征以血供为基础[4]。敏感度为88.2%,特异度为62.1%,诊断效能低于多数乳腺MRI研究[1,3,24],这主要是因为本研究以NMLE为研究对象。
NMLE病灶在诊断上与肿块型病变有差异[25]。在形态学方面,小叶节段分布和导管样分布提示恶性的阳性预测值为74.1%(43/58),但浆细胞乳腺炎(乳腺导管扩张症)可以表现为小叶节段分布或导管样分布,是导致形态学上过诊断的原因。Ⅲ型曲线提示恶性的阳性预测值为86.1%(31/36),Ⅱ型曲线对鉴别诊断无明显特异性,恶性病灶占55.6%(15/27)。DWI-ADC值对病灶性质的鉴别阈值是根据笔者自己的数据库通过ROC曲线分析获得的[26],与肿块的DWI-ADC阈值不同,肿块的ADC阈值是1.05×10-3mm2/s,NMLE的ADC阈值是1.35×10-3mm2/s。本研究中,多数良性NMLE病灶因为与正常的乳腺腺体信号一致而无法测量,这些正常腺体的 ADC 值为 1.6×10-3~1.8×10-3mm2/s,即75.9%(22/29)的良性病灶ADC值大于1.35×10-3mm2/s,ADC值低于1.35×10-3mm2/s的7例良性病灶中,4例为乳腺导管扩张症或脓肿,因为ADC值低于1.35×10-3mm2/s而被过诊断[27-29]。
3.5 超声、钼靶和MRI联合诊断NMLE病变 在诊断效能方面,虽然超声和钼靶有一定的互补性,但是两者联合使用并未提高诊断的敏感度和特异度,不能替代MRI。虽然有少量被MRI低估的病灶经超声或钼靶校正,但是三者联合应用并未提高或改善诊断效能。在病灶显示范围上,因为缺乏直接测量数据无法进行比较,但是从获得的超声、钼靶和MRI图像看,三者明显存在不一致。
总之,NMLE类型的病灶易被超声和钼靶漏诊,对于超声或钼靶的可疑病灶,建议行MRI进一步检查。
[1] Liberman L, Menell JH.Breast imaging reporting and data system(BI-RADS).Radiol Clin North Am, 2002, 40(3): 409-430.
[2] Shao Z, Wang H, Li X, et al.Morphological distribution and internal enhancement architecture of contrast-enhanced magnetic resonance imaging in the diagnosis of non-mass-like breast lesions: a meta-analysis.Breast J, 2013, 19(3): 259-268.
[3] Yabuuchi H, Matsuo Y, Kamitani T, et al.Non-mass-like enhancement on contrast-enhanced breast MR imaging: lesion characterization using combination of dynamic contrastenhanced and diffusion-weighted MR images.Eur J Radiol,2010, 75(1): e126-e132.
[4] 龚良庚, 程流泉.乳腺非肿块性浸润性导管癌的MRI诊断.中国医学影像学杂志 , 2011, 19(8): 601-604.
[5] Sakamoto N, Tozaki M, Higa K, et al.Categorization of nonmass-like breast lesions detected by MRI.Breast Cancer, 2008,15(3): 241-246.
[6] D'Orsi CJ, Newell MS.BI-RADS decoded: detailed guidance on potentially confusing issues.Radiol Clin North Am, 2007,45(5): 751-763.
[7] Imamura T, Isomoto I, Sueyoshi E, et al.Diagnostic performance of ADC for non-mass-like breast lesions on MR imaging.Magn Reson Med Sci, 2010, 9(4): 217-225.
[8] Chan S, Chen JH, Agrawal G, et al.Characterization of pure ductal carcinoma in situ on dynamic contrast-enhanced MR imaging: do nonhigh grade and high grade show different imaging features? J Oncol, 2010.
[9] Lehman CD.Magnetic resonance imaging in the evaluation of ductal carcinoma in situ.J Natl Cancer Inst Monogr, 2010,2010(41): 150-151.
[10] Marcotte-Bloch C, Balu-Maestro C, Chamorey E, et al.MRI for the size assessment of pure ductal carcinoma in situ (DCIS):a prospective study of 33 patients.Eur J Radiol, 2011, 77(3):462-467.
[11] Liu H, Peng W.MRI morphological classification of ductal carcinoma in situ (DCIS) correlating with different biological behavior.Eur J Radiol, 2012, 81(2): 214-217.
[12] Jiang L, Zhou Y, Wang Z, et al.Is there different correlation with prognostic factors between "non-mass" and "mass" type invasive ductal breast cancers? Eur J Radiol, 2013.
[13] 徐剑峰 , 刘万花 , 李敏达 , 等.全数字化乳腺摄影在非肿块型乳腺癌诊断中的应用.实用放射学杂志 , 2011, 27(12):1826-1829.
[14] 安向红, 张伟.非肿块型乳腺癌的CR钼靶诊断分析.实用诊断与治疗杂志 , 2008, 22(2): 126-127.
[15] 陈计赏 , 陈贵俦 , 冯玉珊 , 等.钼靶指导乳腺钙化灶切除在发现非肿块型早期乳腺癌中的应用.中国医药科学, 2012,2(3): 53-54, 56.
[16] 史叶锋, 刘怡文.非肿块型乳腺癌的钼靶X线诊断分析.实用医学杂志 , 2010, 26(24): 4548-4550.
[17] 克德娜 , 周海 , 杨蓉.非肿块型乳腺癌钼靶 X 线分析.中国医药 , 2012, 7(2): 182-183.
[18] 王知力 , 唐杰 , 李俊来 , 等.乳腺非肿块型病变的超声诊断.中国医学影像学杂志 , 2013, 21(1): 13-14.
[19] Abdullah N, Mesurolle B, El-Khoury M, et al.Breast imaging reporting and data system lexicon for US: interobserver agreement for assessment of breast masses.Radiology, 2009,252(3): 665-672.
[20] Sotome K, Yamamoto Y, Hirano A, et al.The role of contrast enhanced MRI in the diagnosis of non-mass image-forming lesions on breast ultrasonography.Breast Cancer, 2007, 14(4):371-380.
[21] Uematsu T.Non-mass-like lesions on breast ultrasonography: a systematic review.Breast Cancer, 2012, 19(4): 295-301.
[22] Carbognin G, Girardi V, Calciolari C, et al.Utility of secondlook ultrasound in the management of incidental enhancing lesions detected by breast MR imaging.Radiol Med, 2010,115(8): 1234-1245.
[23] Ko ES, Choi HY, Kim RB, et al.Application of sonoelastography: comparison of performance between mass and non-mass lesion.Eur J Radiol, 2012, 81(4): 731-736.
[24] Peters NH, Borel Rinkes IH, Zuithoff NP, et al.Meta-analysis of MR imaging in the diagnosis of breast lesions.Radiology,2008, 246(1): 116-124.
[25] Newell D, Nie Ke, Chen JH, et al.Selection of diagnostic features on breast MRI to differentiate between malignant and benign lesions using computer-aided diagnosis: differences in lesions presenting as mass and non-mass-like enhancement.Eur Radiol, 2010, 20(4): 771-781.
[26] Cheng L, Bai Y, Zhang J, et al.Optimization of apparent diffusion coefficient measured by diffusion-weighted MRI for diagnosis of breast lesions presenting as mass and non-masslike enhancement.Tumour Biol, 2013.
[27] Renz DM, Baltzer PA, Böttcher J, et al.Magnetic resonance imaging of inflammatory breast carcinoma and acute mastitis.A comparative study.Eur Radiol, 2008, 18(11): 2370-2380.
[28] Girardi V, Carbognin G, Camera L, et al.Inflammatory breast carcinoma and locally advanced breast carcinoma: characterisation with MR imaging.Radiol Med, 2011, 116(1): 71-83.
[29] Tan H, Li R, Peng W, et al.Radiological and clinical features of adult non-puerperal mastitis.Br J Radiol, 2013, 86(1024):20120657.

