胶质瘤复发与放射性脑损伤的影像研究现状
王玉林(综述) 马 林(审校)
胶质瘤是最常见的脑内原发性肿瘤,由于其具有浸润性生长的特性,手术难以彻底切除,而且易复发,因此治疗手段为手术切除后辅以放疗及靶向化疗。术后常规放疗可以延长患者的生存期并加强治疗效果,但也会带来负面效应。在接受脑部放疗后的一段时间内(3个月~10年),部分患者会出现不同程度的放射性脑损伤,主要包括由于血-脑屏障破坏所致放射性脑坏死和射线所致广泛脑白质脱髓鞘[1-3],放射性脑损伤的最终结果为放射性脑坏死。即使患者行全脑放疗,放射性脑损伤通常也仅出现于原发肿瘤的部位,这种现象的机制目前尚不明确,可能是由于术后原发肿瘤部位周围出现血管性水肿,而使邻近的脑白质更容易被射线损伤[4]。一旦脑内出现新的异常强化病灶,需要鉴别该强化灶是肿瘤复发还是放射性脑损伤。目前用于鉴别两者的诊断方法有扩散加权成像(DWI)、灌注成像(PWI)、三维动脉自旋标记(3D-ASL)、磁共振波谱(MRS)、正电子发射体层摄影术(PET)、单光子发射计算机体层摄影术(SPECT)等。
常规MR检查较难鉴别胶质瘤是复发还是放射性脑损伤。放射性脑损伤在常规MRI上通常表现为瑞士奶酪样强化病灶,伴周围组织水肿和明显的占位效应,与胶质瘤复发相仿;此外,放射性脑损伤多出现在治疗结束后2年左右,与胶质瘤复发的时间相近。影像新技术为研究脑内胶质瘤治疗后的影像学改变提供了依据,有重要临床意义。
1 DWI
DWI可以检测胶质瘤治疗后水分子扩散的变化,并对治疗反应作出早期定量分析。低ADC值反映肿瘤组织的增殖和存活,提示肿瘤复发或进展;高ADC值提示肿瘤坏死,可能与肿瘤组织细胞坏死、数目减少等有关。肿瘤的细胞密度决定其ADC值,胶质瘤的ADC值与肿瘤的细胞密度呈显著负线性相关,即低ADC值提示高度恶性肿瘤。Zeng等[5]研究发现胶质瘤复发强化区ADC值为(1.20±0.08)×10-3mm2/s,放射性脑损伤强化区ADC值为(1.39±0.09)×10-3mm2/s,即胶质瘤复发患者的ADC值明显低于放射性脑损伤患者,这可能是因为胶质瘤复发患者肿瘤细胞数目较多,细胞间隙较小,细胞核浆比较大,导致水分子弥散受限,ADC值降低。Hein等[6]研究发现,胶质瘤复发组ADC值[(1.18±0.13)×10-3mm2/s]明显低于放射性脑损伤组[(1.40±0.17)×10-3mm2/s],差异有统计学意义。但在胶质瘤复发组中,二次手术病理证实为胶质母细胞瘤和间变型胶质瘤的ADC值间差异无统计学意义。Bobek-Billewicz等[3]研究发现,无论是ADCce平均值还是ADC比值平均值在胶质瘤复发组和放射性脑损伤组间差异均无统计学意义。
2 MRS
MRS成像是利用磁共振现象和化学位移现象进行特定原子核及其化合物定量分析的方法。不同的化合物在谱线上对应一个或数个特征性化学位移点,MRS在神经系统观察的代谢物包括海马N-乙酰天门冬氨酸(NAA)、胆碱(Cho)、肌酸(Cr)、乳酸、脂质等。Cho是细胞膜磷脂代谢成分之一,波峰位于3.22 ppm,反映了细胞膜的合成及分解水平。与放射性脑损伤相比较,胶质瘤复发的波谱表现为Cho/Cr、Cho/NAA升高,其中应用Cho/Cr作为参数最为常见,诊断阈值为1.5~2.0[7,8]。Cho/Cr比值升高,表示细胞膜分裂增生旺盛;Cho波峰的高低提示肿瘤细胞的增殖状况。但Cho/Cr比值在脱髓鞘病变、膜磷脂成分释放时也会升高,这主要由磷脂降解产物堆积所致。Sugahara等[1]研究显示在少数严重的放射性坏死患者体内,由于放射性脑损伤脱髓鞘,细胞膜崩解、胶质增生、炎症细胞浸润,Cho也会升高,导致胶质瘤复发的假阳性诊断。Rabinov等[9]利用3.0T MR研究多体素MRS诊断胶质瘤复发,以Cho/Cr比值作为诊断指标,认为此值大于1.3即可诊断为肿瘤复发,小于1.3则考虑为治疗后改变。多体素波谱覆盖面积大,采样面积小,空间分辨力高,并可以在一次数据采集中获得多点波谱信息,将成为MRS的一大发展趋势。
3 PET
PET应用释放正电子的核素为标记物,可在形态学出现异常改变之前发现代谢异常,有助于脑胶质瘤和放射性脑损伤的鉴别。氟代脱氧葡萄糖(18F-FDG)是最常用的示踪剂,可以检测局部脑组织葡萄糖代谢率。Langleben等[10]研究认为FDG诊断肿瘤复发的敏感度为81%~86%,特异度为40%~94%。由于FDG在正常脑灰质组织中也表现为浓聚,所以诊断有一定困难。
4 SPECT
SPECT脑血流灌注显像对胶质瘤的诊断不如MR,但对鉴别胶质瘤复发有一定的意义。复发的胶质瘤可以表现为相对脑血流量(rCBF)升高,而瘢痕、水肿、坏死等改变表现为rCBF减少。rCBF与201Tl做双核素显像,201Tl局部放射性浓聚更支持肿瘤复发。
Tie等[11]用201Tl-SPECT鉴别胶质瘤复发和放射性脑损伤,灵敏度和特异度分别为83%和83%,但空间分辨力低、解剖定位不准确、容易混淆生理性摄取和病理性摄取。201Tl-SPECT对胶质瘤复发和放射性脑损伤的鉴别有一定价值,尤其是低度恶性胶质瘤,201Tl的总体诊断准确度、敏感度和特异度分别为83%、88%和76%,当201Tl摄取指数截值设为1.25时,诊断的敏感度和特异度分别达到90%和80%,故当患者疑为低度恶性胶质瘤复发时,201Tl-SPECT应与MR同列为常规检查,以便更清晰地确定肿瘤的边缘。
5 MR 灌注扫描
目前主要应用的方法为PWI和3D-ASL;动态磁敏感对比增强灌注磁共振成像通过静脉快速团注顺磁性对比剂观察脑血流动力学改变,对比剂通过局部血管时,组织T2或T2*缩短,导致相应的T2WI或T2*WI上的信号一过性降低。动态磁敏感对比增强灌注磁共振成像可以反映组织的毛细血管微循环信息,肿瘤细胞的生长和细胞更新的加快导致其新陈代谢需求增加,使肿瘤局部处于低血糖和缺氧状态,这种状态会刺激机体产生促进血管生成的细胞活性物质,导致肿瘤内部新的血管生成。病理显示这些肿瘤新生血管多为不成熟血管,有大的细胞间隙、不完整的基底膜和缺少平滑肌层,因此肿瘤新生血管具有更高的渗透性。PWI通过相对脑血容量(rCBV)、rCBF及平均通过时间(MTT)等多种血液动力学参数量化胶质瘤复发后的高血管化状态。灌注扫描通过单位体积脑组织内的血管管腔的容积(CBV)、单位时间内通过单位体积脑组织的血流量(CBF)、MTT量化脑胶质瘤复发后的高血管化的状态。在脑肿瘤灌注的定量描述中,最常用的参数为CBV。Fuss等[12]应用PWI检查25例组织学证实的纤维性星形细胞瘤放疗前后的rCBV变化规律,认为PWI是一种可行的无创性评估肿瘤血管生成的方法。见图1、2。
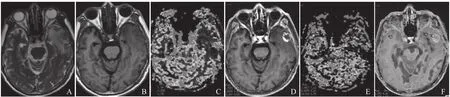
图1 患者男,75岁,肺癌脑转移放疗后。A、B.横轴位T2WI和T1WI示左侧颞叶类圆形稍长T1稍长T2信号,周围可见大片状长T2水肿信号,ASL及灌注均呈低灌注,考虑放射性脑损伤;C~F分别为CBV、CBF、MTT及3D-ASL图
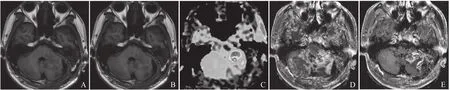
图2 患者男,20岁,小脑胶质瘤术后放疗后。A、B.横轴位T2WI和T1WI示左侧桥臂及小脑半球可见斑片状稍长T1稍长T2信号应,四脑室受压移位;ASL及灌注扫描均呈高灌注,考虑胶质瘤复发;C~E分别为3D-ASL、CBF、MTT图
Sugahara等[1]的研究认为rCBV大于2.6可以诊断为脑胶质瘤复发,rCBV小于0.6则可以诊断为放射性脑损伤,对于rCBV在二者之间的情况,则需要行PET检查,做出最后的诊断。Barajas等[13]根据rCBV比值ROC曲线得出的分界值为1.75,但依据此比值鉴别放射性脑损伤及脑胶质瘤复发并不完全可靠(灵敏度为78.92%,特异度为71.58%)。Fink等[14]研究发现胶质瘤复发的rCBV为3.62±0.65,明显高于放射性脑损伤的1.31±0.50,ROC曲线显示rCBV鉴别两者的曲线下面积为0.917。Ruben等[15]研究显示rCBV在放射性脑损伤中为0.39~2.57,而在胶质瘤复发中为2.10~10.00;两者差异有统计学意义。Bobek-Billewicz等[3]研究认为脑胶质瘤复发组rCBVmax为2.44±0.73,放射性脑损伤组rCBVmax为 0.78±0.46(P<0.001),脑 胶 质 瘤 复 发 组 rCBVmean为1.46±0.49,放射性脑损伤组rCBVmean为0.49±0.38(P<0.004);并且认为rCBVmax大于 1.7,同时rCBVmean大于1.25高度提示脑胶质瘤复发;rCBVmax小于1.0,同时rCBVmean小于0.5高度提示放射性脑损伤。
3D-ASL是一种磁共振功能成像,可以在多个器官内应用,但目前该技术主要用于无创性地评价脑部灌注信息,获得rCBF。与对比增强灌注技术相比,ASL利用射频和脉冲序列将供血动脉内自然存在的质子进行翻转,从而获得脑部灌注信息;并且采用脉冲-连续式标记技术、3D-FSE序列、Spiral采集方式,显著提高3D-ASL采集效率,同时还克服了以往ASL技术信噪比低及磁敏感伪影较重的问题。同PWI相比,3D-ASL因为无外源性造影剂的注入,不存在造影剂渗漏的问题,所以对于病灶的灌注信息评估理论上应该更准确。但3D-ASL空间分辨率略低,对于较小的病灶定位及定量分析欠准确;并且3D-ASL图像对于病灶边界的显示及勾画较PWI略显不足。
总之,PWI、3D-ASL、DWI、MRS检查快速、经济、空间分辨力较PET、SPECT高。PET、SPECT对胶质瘤复发的诊断有一定的优势。PET的空间分辨力略高于SPECT,但后者应用更普及。在临床工作中,MR常规平扫与增强扫描结合MRS、DWI、PWI可以发现和鉴别胶质瘤复发和放射性脑损伤,而且经济、快捷,是目前公认的检查方式。
[1] Sugahara T, Korogi Y, Tomiguchi S, et al.Posttherapeutic intraaxial brain tumor: the value of perfusion-sensitive contrastenhanced MR imaging for differentiating tumor recurrence from nonneoplastic contrast-enhancing tissue.Am J Neuroradiol, 2000,21(5): 901-909.
[2] Mitsuya K, Nakasu Y, Horiguchi S, et al.Perfusion weighted magnetic resonance imaging to distinguish the recurrence of metastatic brain tumors from radiation necrosis after stereotactic radiosurgery.J Neurooncol, 2010, 99(1): 81-88.
[3] Bobek-Billewicz B, Stasik-Pres G, Majchrzak H, et al.Differentiation between brain tumor recurrence and radiation injury using perfusion, diffusion-weighted imaging and MR spectroscopy.Folia Neuropathol, 2010, 48(2): 81-92.
[4] Preul MC, Leblanc R, Caramanos Z, et al.Magnetic resonance spectroscopy guided brain tumor resection: differentiation between recurrent glioma and radiation change in two diagnostically difficult cases.Can J Neurol Sci, 1998, 25(1): 13-22.
[5] Zeng QS, Li CF, Zhang K, et al.Multivoxel 3D proton MR spectroscopy in the distinction of recurrent glioma from radiation injury.J Neurooncol, 2007, 84(1): 63-69.
[6] Hein PA, Eskey CJ, Dunn JF, et al.Diffusion-weighted imaging in the follow-up of treated high-grade gliomas: tumor recurrence versus radiation injury.Am J Neuroradiol, 2004, 25(2): 201-209.
[7] Kumar AJ, Leeds NE, Fuller GN, et al.Malignant gliomas: MR imaging spectrum of radiation therapy- and chemotherapy-induced necrosis of the brain after treatment.Radiology, 2000, 217(2): 377-384.
[8] Szigety SK, Allen PS, Huyser-Wierenga D, et al.The effect of radiation on normal human CNS as detected by NMR spectroscopy.Int J Radiat Oncol Biol Phys, 1993, 25(4): 695-701.
[9] Rabinov JD, Lee PL, Barker FG, et al.In vivo 3-T MR spectroscopy in the distinction of recurrent glioma versus radiation effects: initial experience.Radiology, 2002, 225(3): 871-879.
[10] Langleben DD, Segall GM.PET in differentiation of recurrent brain tumor from radiation injury.J Nucl Med, 2000, 41(11): 1861-1867.
[11] Tie J, Gunawardana DH, Rosenthal MA.Differentiation of tumor recurrence from radiation necrosis in high-grade gliomas using 201Tl-SPECT.J Clin Neurosci, 2008, 15(12): 1327-1334.
[12] Fuss M, Wenz F, Essig M, et al.Tumor angiogenesis of lowgrade astrocytomas measured by dynamic susceptibility contrastenhanced MRI (DSC-MRI) is predictive of local tumor control after radiation therapy.Int J Radiat Oncol Biol Phys, 2001, 51(2):478-482.
[13] Barajas RF Jr, Chang JS, Segal MR, et al.Differentiation of recurrent glioblastoma multiforme from radiation necrosis after external beam radiation therapy with dynamic susceptibilityweighted contrast-enhanced perfusion MR imaging.Radiology,2009, 253(2): 486-496.
[14] Fink JR, Carr RB, Matsusue E, et al.Comparison of 3 tesla proton MR spectroscopy, MR perfusion and MR diffusion for distinguishing glioma recurrence from posttreatment effects.J Magn Reson Imaging, 2012, 35(1): 56-63.
[15] Ruben JD, Dally M, Bailey M, et al.Cerebral radiation necrosis:incidence, outcomes, and risk factors with emphasis on radiation parameters and chemotherapy.Int J Radiat Oncol Biol Phys, 2006,65(2): 499-508.

