抗艾滋病病毒蛋白CVNH在*大肠杆菌中表达条件的优化
李 宁,孙君波,韦 剑,丘力功,王 艇,苏应娟
(1.中山大学生命科学学院,广东广州 510275;2.广州拜迪生物医药有限公司,广东广州 511495;3.中国科学院武汉植物园湿地演化与生态恢复湖北省重点实验室,湖北武汉 430074)
蓝藻抗病毒蛋白(cyanovirin-N,CVN)是由美国学者Boyd等[1]从椭孢念珠藻Nosto celliposporum提取物中发现的一种新型、具抗艾滋病病毒活性的蛋白。CVN为单链蛋白,含101个氨基酸。它可被分为两个重复单元,每个单元长约50个氨基酸,且含一个二硫键 (分别为C8-C22和C58-C73);该蛋白无翻译后修饰[2]。三维结构上,两个CVN重复借助一者的三链β折叠和另一者的β发夹之间的相互作用,彼此结合形成包含两个折叠型结构域、沿长轴伸展的长椭圆形对称分子[3]。和糖蛋白中寡糖结合的位点就分别位于长轴两端的深缝中,但它们同糖的亲和性一高一低[4]。CVN的物理化学性质非常稳定,能抵抗变性剂、去垢剂和有机溶剂的作用以及反复冻融和高温处理。经100℃加热15 min后,CVN仍能保持抗病毒活性。CVN的抗HIV活性主要表现在它能阻断由HIV表面糖蛋白介导的病毒—细胞融合途径[1]。体外研究表明,CVN能和HIV衣壳糖蛋白gp120特异、高亲合性地结合,干扰gp120与靶细胞受体CD4分子之间的相互作用,并抑制HIV感染宿主细胞[1,5-6]。此外,CVN 对埃博拉病毒 (Ebola)和流感病毒也有很高的抗病毒活性[7-8]。
除蓝细菌外,在一些细菌、真菌和蕨类植物中也发现有 CVN同源基因 (cyanovirin-N homology,CVNH)存在,它们共同组成CVNH蛋白家族。该家族成员的结构域折叠方式同蓝藻 CVN相匹配。进化上,它们所共有的抗HIV结构域在真核生物中极其保守,而且表现出相似的抗病毒活性[4,9-10]。
目前,有关CVN的研究主要集中在蛋白质晶体的三维结构、抗HIV活性及其机制等方面[1,11],而涉及CVNH的研究则还相对很少。在前期研究中,我们首次获得水蕨Ceratopteris thalictroides CVNH基因 (CtCVNH)的全长序列[10]。随后,在对水蕨CVNH编码序列进行优化后,又构建出pET32a-CtCVNH的原核表达载体,并对其进行了诱导表达。在诱导表达的过程中,很多因素影响重组菌的生长及目的蛋白表达。这些因素包括培养基的类型及成分、培养基初始pH值、接种量、培养温度、诱导时机、诱导剂的浓度及诱导时间等。本研究对CVNH蛋白在大肠杆菌中表达条件展开了优化,以期获得较高的CVNH蛋白表达量,这为进一步开展CVNH的药物研制和开发奠定了基础。
1 材料与方法
1.1 菌种
表达菌株Rosetta 2(DE3)为本实验室保存。
1.2 培养基
种子液体培养基为LB,其它培养基为 TB、SOB、SOC、M9、2×YT,配制方法参考《分子克隆实验指南》[12]。使用前添加氨苄青霉素 (100 μg·mL-1)、氯霉素 (34 μg·mL-1)。
1.3 试剂与仪器
Yeast Extract、Tryptone均为英国OXOID公司生产;丙烯酰胺、三羟甲基氨基甲烷 (Tris)、十二烷基硫酸钠 (SDS)、异丙基硫代-β-D半乳糖苷 (IPTG)为Genview公司生产;氨苄青霉素、甘油、甲叉双丙烯酰胺为Sigma公司生产;考马斯亮蓝R-250为USB分装;N,N,N',N'-四甲基乙二胺 (TEMED)、过硫酸铵 (APS)为生工生物工程 (上海)有限公司生产;乳糖为广东环凯微生物科技有限公司生产;其余试剂均为国产分析纯。
SW-CJ-1FD型单人单面净化工作台 (苏州净化设备有限公司);101-1A型数显式电热恒温干燥箱 (沪越科学实验仪器厂);恒温培养摇床THZ-100(上海一恒科学仪器有限公司);DYY-8C型电泳仪 (北京市六一仪器厂);Eppendorf AG离心机;CyberScan pH510台式pH计。
1.4 培养方法
取-80℃保存的重组CVNH甘油菌,划LB固体培养基平板,37℃培养12 h,挑取单克隆菌落接入LB液体培养基中,37℃,220 r·min-1摇床振荡培养过夜,获得种子液。优化前的培养条件为:将培养好的种子液按1%接种量接入装有LB培养基的三角瓶中,37℃,220 r·min-1摇床振荡培养3 h时 (A600nm约为0.6~0.9),取1 mL诱导前的菌液4℃保存备用。之后,用IPTG(1 mmol·L-1)诱导表达4 h,取1 mL诱导后的菌液,将诱导前后的菌液12 000 r·min-1离心1 min收集沉淀。将菌体重悬于40 μL蒸馏水中,加入10 μL 5×蛋白点样缓冲液。100℃水煮裂解10 min后,制成SDS-PAGE电泳蛋白样品,-20℃保存备用。点样前,样品12 000 r·min-1离心10 min。
1.5 菌体浓度的测定
比色法测定,以600 nm处的吸光度A600nm表示。
1.6 CVNH蛋白表达量的表示方法
1.6.1 目的蛋白含量 (%) 取电泳蛋白样品上清液上样,采用w=5%浓缩胶和w=15%分离胶的SDS-PAGE电泳。考马斯亮蓝R-250染色。脱色后,用BandScan软件对凝胶进行分析,计算每条泳道中目的蛋白的含量。
1.6.2 菌体干质量 (菌体生长量) 取10 mL诱导后的样品,12 000 r·min-1离心3 min,获菌体沉淀,80℃烘干至恒量,称量[13]。
CVNH蛋白表达量=目的蛋白含量×菌体干质量[14]。
2 结果与分析
2.1 菌体生长曲线的测定
在20 mL TB培养基中按1%接种量接入种子液,37℃,220 r·min-1摇床振荡培养,在第0-5 h间,每隔半小时取菌液300 μL测A600nm值;在第5-8 h间,每隔1 h取菌液300 μL测A600nm值。实验重复2次。菌体生长曲线如图1。
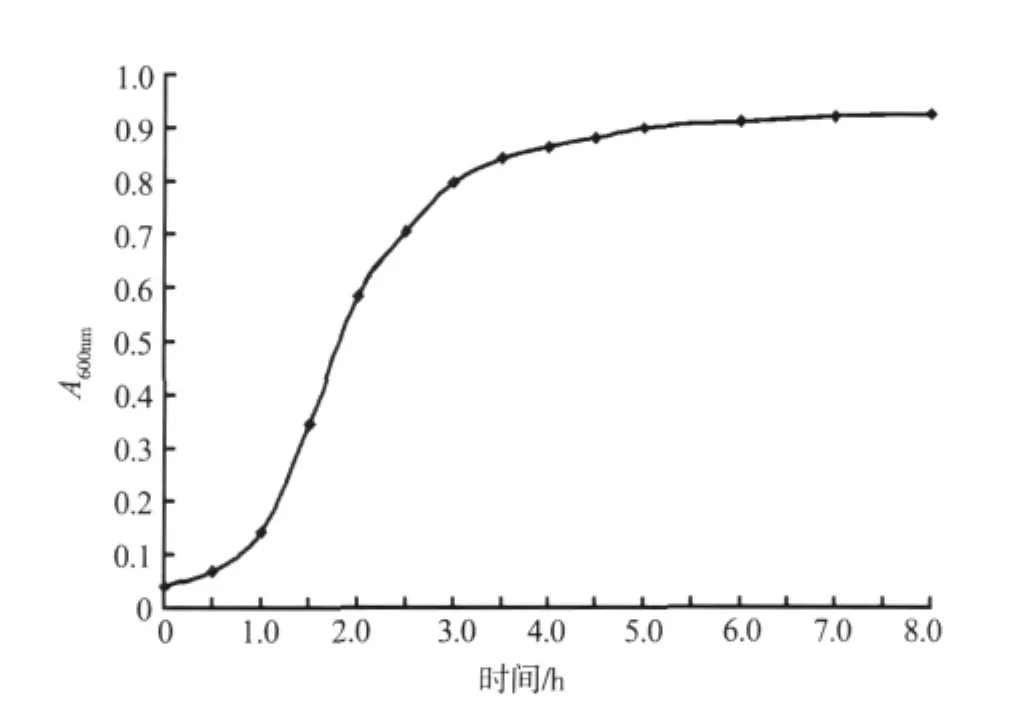
图1 重组大肠杆菌的生长曲线Fig.1 Growth curve of recombinant E.coli
菌体生长曲线呈典型的S型,第0-0.5 h间为停滞期,第0.5-1 h间为对数生长前期,第1-2 h间为对数生长中期,第2-3 h间为对数生长后期,第3-8 h间为稳定期。
2.2 不同培养基对CVNH蛋白产量的影响
本实验分别选取LB、TB、SOB、SOC、M9、2×YT、LB+M9和2×YT+M9八种培养基,在其它条件相同的情况下培养大肠杆菌,根据CVNH蛋白产量来确定最佳培养基。实验重复2次,结果见图2。
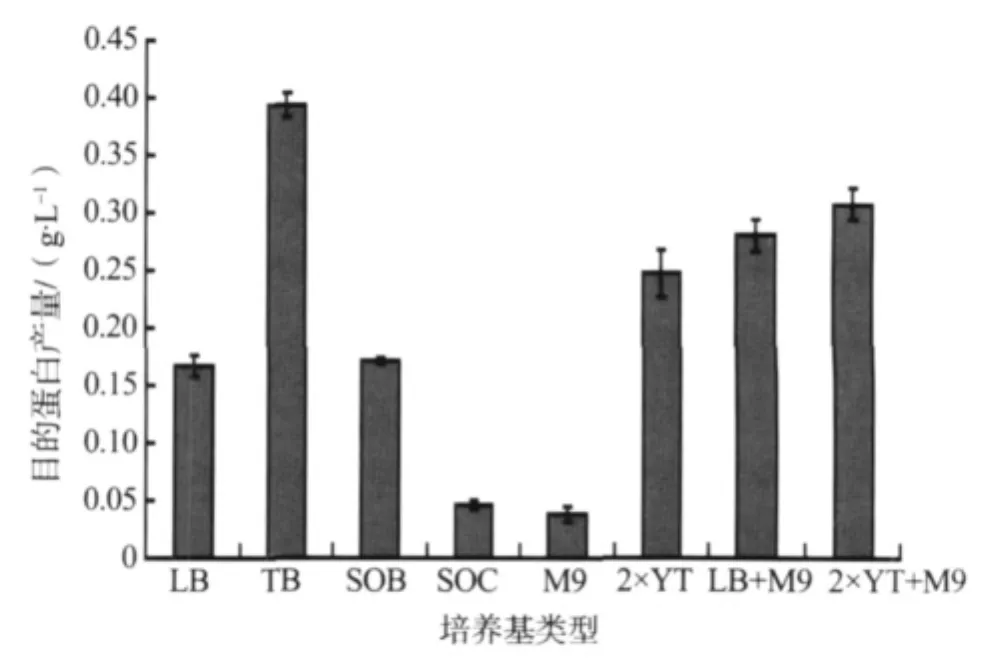
图2 不同培养基对CVNH蛋白产量的影响Fig.2 Influence of different culture media on CVNH protein yields
CVNH蛋白产量在TB培养基中最高。TB培养基含有较多的有机物、氨基酸、核苷酸、生长因子以及一些微量元素,被确定为CVNH蛋白表达的最佳培养基。
2.3 不同诱导时机对CVNH蛋白产量的影响
当A600nm分别为 0.1、0.2、0.3、0.4、0.5、0.6、0.7、0.8和0.9时加入IPTG进行诱导,在其它条件相同的情况下培养大肠杆菌,根据CVNH蛋白产量来确定最佳诱导时机。实验重复2次,结果见图3。
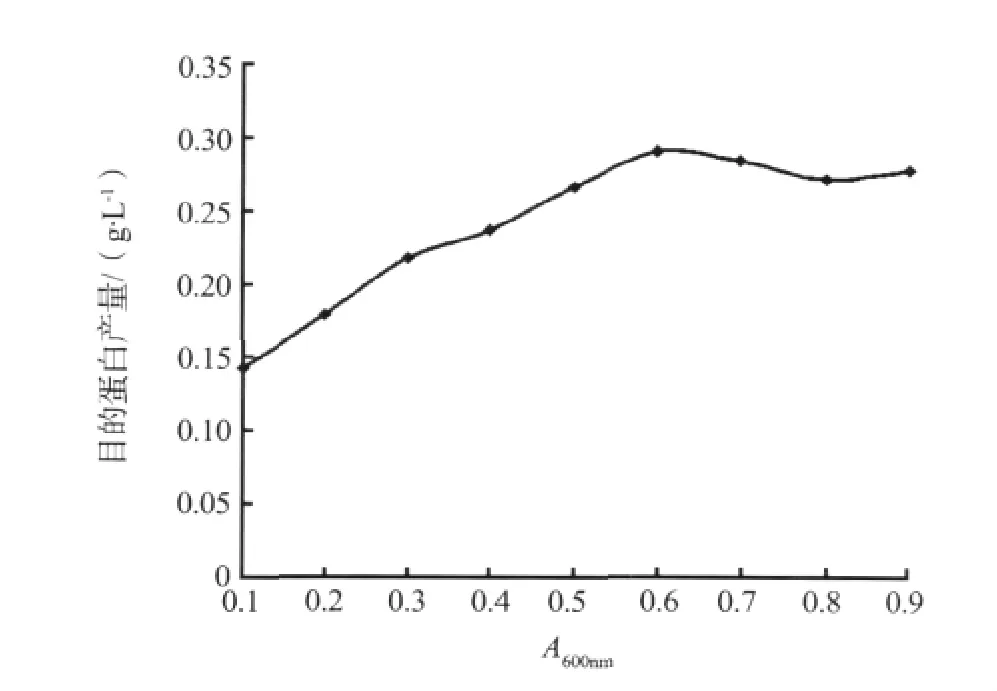
图3 不同诱导时机对CVNH蛋白产量的影响Fig.3 Influence of different induction time on CVNH protein yields
结果发现,CVNH蛋白产量随着A600nm的增加呈现先增加后减少的趋势。当A600nm为0.6时,CVNH蛋白产量最高。当A600nm值小于 0.6时,CVNH蛋白产量随着A600nm的增加而增加。此时,大肠杆菌生长状态为潜伏期及对数生长前期,菌体密度较低,蛋白总产量较低。当A600nm为0.6时,大肠杆菌处于对数生长中期。此时菌体密度较高,可诱导产生最多的目的蛋白。当A600nm继续增加时,目的蛋白的产量会稍有下降。此时处于稳定期及衰亡期,部分菌体已死亡,蛋白开始自溶,导致蛋白产量降低。
2.4 不同诱导剂浓度对CVNH蛋白产量的影响
本文比较了IPTG和乳糖的诱导效果。IPTG的浓度分别为 0.012 5、0.025、0.05、0.1、0.2、0.4、0.8、1.6 和 3.2 mmol·L-1,而乳糖的质量浓度分别为 0.012 5、0.025、0.05、0.1、0.2、0.4、0.8、1.6和3.2 g·L-1。在其它条件相同的情况下培养大肠杆菌,根据CVNH蛋白产量来确定最佳诱导浓度。实验重复2次,结果见图4。

图4 不同诱导剂浓度对CVNH蛋白产量的影响Fig.4 Effects of concentrations of different induction agents on CVNH protein yields
随着IPTG和乳糖质量浓度的增加,CVNH蛋白产量均呈现先增加后减少的趋势,但变化趋势不明显,说明菌种对IPTG和乳糖的诱导作用比较敏感。当IPTG诱导时,随着其浓度的增加,菌体的质量呈下降趋势;而乳糖作诱导剂时,菌体的质量基本不变。表明IPTG对菌的生长具有抑制作用。IPTG浓度达到0.8 mmol·L-1时,目的蛋白的产量最高。IPTG浓度继续增加,其抑制菌种效果也增加,目的蛋白的产量随之降低。乳糖质量浓度在1.6 g·L-1时,目的蛋白产量最高,且高于IPTG诱导的产量。乳糖质量浓度继续增加,其降解物葡萄糖浓度也增加,就会产生抑制菌种生长的乙酸等物质,导致目的蛋白的产量降低。因此,确定1.6 g·L-1的乳糖为最佳诱导剂。
2.5 不同诱导时间对CVNH蛋白产量的影响
本文用1.6 g·L-1乳糖分别诱导1、2、3、4、5、6、8和10 h,并以 IPTG诱导4 h作为对照(ck)。在其它条件相同的情况下培养大肠杆菌,根据CVNH蛋白产量来确定最佳诱导时间。实验重复2次,结果见图5。
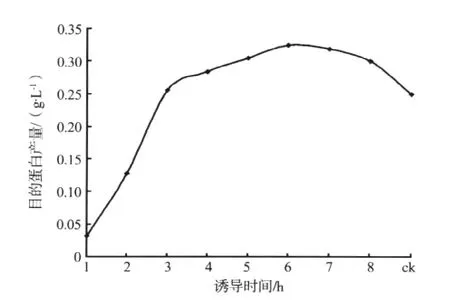
图5 不同诱导时间对CVNH蛋白产量的影响Fig.5 Effect of different expression time on CVNH protein yields
随着乳糖诱导时间的增加,CVNH蛋白产量先升高后降低。当乳糖诱导6 h时,CVNH蛋白的产量最高,而且比IPTG诱导4 h的CVNH蛋白量高。乳糖是二糖诱导剂,需先降解为葡萄糖和半乳糖,半乳糖再诱导CVNH蛋白的表达。这一过程需要多种酶的参与,因此诱导时间比IPTG长。但随着时间的增加,会产生乙酸等抑制物,导致CVNH蛋白产量降低。故选用乳糖诱导6 h作为最佳诱导时间。
2.6 不同碳源对CVNH蛋白产量的影响
本文在TB培养基中分别添加:φ=2%甘油、20 g·L-1葡萄糖、20 g·L-1蔗糖、φ =2% 甲醇、φ=2%乙醇、φ=2%异丙醇和φ=2%丙酮为碳源,以不加碳源的TB培养基为对照 (ck)。在其它条件相同的情况下培养大肠杆菌,根据CVNH蛋白产量来确定最佳碳源。实验重复2次,结果见图6。
当培养基中无任何碳源时,CVNH蛋白产量最高。以葡萄糖为碳源时,CVNH蛋白的产量最低,但它的菌体干质量最高,说明葡萄糖可促进菌体生长。另外,以乳糖作为诱导剂时,乳糖分解会产生葡萄糖,二者共同作用,使葡萄糖的含量增加,促进菌体生长。然而,乳糖也会产生大量乙酸,抑制目的蛋白表达,使其表达量降低。另外,以醇类及酮等有机试剂为碳源时,目的蛋白的产量与添加糖类相差不大。因而,CVNH蛋白表达不需再添加任何碳源。
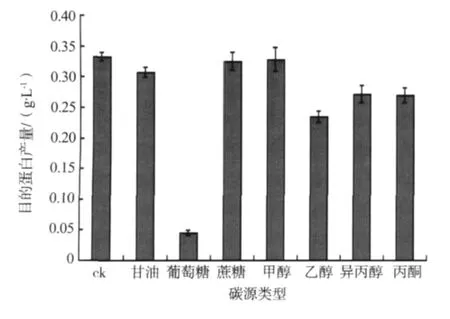
图6 不同碳源对CVNH蛋白产量的影响Fig.6 Influence of different carbon source on CVNH protein yields
2.7 不同氮源对CVNH蛋白产量的影响
本文使用的TB培养基含有胰蛋白胨和酵母提取物两种氮源,二者的比例不同会影响CVNH蛋白的表达。首先固定胰蛋白胨质量浓度 (12 g·L-1),改变酵母提取物的添加量,分别为0、4、6、12、24和36 g·L-1(即添加比例分别为胰蛋白胨:酵母提取物 =1∶0、3∶1、2∶1、1∶1、1∶2、1∶3);然后固定酵母提取物含量 (24 g·L-1),改变胰蛋白胨的添加量,分别为0、8、12、24、48和72 g·L-1(即添加比例分别为酵母提取物:胰蛋白胨=1∶0、3∶1、2∶1、1∶1、1∶2、1∶3)。另外,其他无机氮源对蛋白表达量也有影响。为此,我们固定酵母提取物 (24 g·L-1)和胰蛋白胨 (12 g·L-1)含量,分别添加了硫酸铵、氯化铵、硝酸铵,尿素和乙酸铵五种无机氮源,添加量以氮元素摩尔数相等为依据。在其它条件相同的情况下培养大肠杆菌,根据CVNH蛋白产量来确定最佳氮源。实验重复2次,结果见图7。
当氮源为 24 g·L-1酵母提取物和 72 g·L-1胰蛋白胨时,CVNH蛋白产量达到最高。虽然曲线仍处于上升趋势,但变化趋势变小。仅以胰蛋白胨为氮源,CVNH蛋白百分含量较高,但菌体干质量偏低,表明胰蛋白胨可促进蛋白表达。而仅以酵母提取物为氮源,菌体干质量较高,但CVNH蛋白含量较低,说明酵母提取物能促进菌体生长。另外,添加的其它无机氮源并没有明显提高蛋白表达量。因此,考虑到培养的经济性,我们决定不再增加其他氮源。故选取 24 g·L-1酵母提取物和 72 g·L-1胰蛋白胨作为最佳氮源。
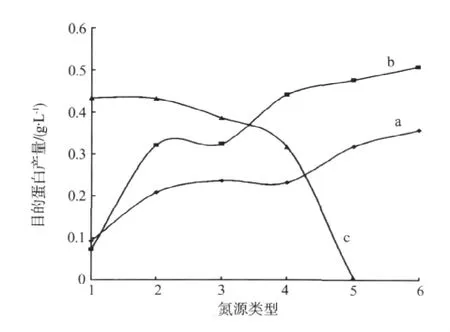
图7 不同氮源对CVNH蛋白产量的影响Fig.7 Effect of different nitrogen source on CVNH protein yields
2.8 不同初始pH对CVNH蛋白产量的影响
本文初始 pH分别为 5.0、5.5、6.0、6.5、7.0、7.5、8.0和8.5,在其它条件相同的情况下培养大肠杆菌,根据CVNH蛋白产量确定最佳初始pH。实验重复2次,结果见图8。

图8 不同初始pH对CVNH蛋白产量的影响Fig.8 Influence of different initial pH on CVNH protein yields
随着培养基初始pH的增加,CVNH蛋白产量先增加后减少,当初始pH为8.0时,CVNH蛋白产量达到最高。本研究优化的最佳培养基初始pH为8.0。
2.9 CVNH蛋白产量优化前后的对比
在不同影响因素的优化过程中,存在多种外部因素的影响,如菌种和培养环境的差异。为检测优化后的蛋白表达效果,在相同的条件下,我们比较了优化前后的蛋白表达量。优化后的实验条件为:含 24 g·L-1酵母提取物和 72 g·L-1胰蛋白胨的 TB培养基,培养基初始pH为8.0,菌液A600nm为0.6时加入1.6 g·L-1乳糖诱导6 h。根据CVNH蛋白产量判断优化的效果。实验重复2次,结果见图9。
优化后的目的蛋白表达量增高,CVNH蛋白的表达量较优化前提高了1.9倍,说明优化效果明显。
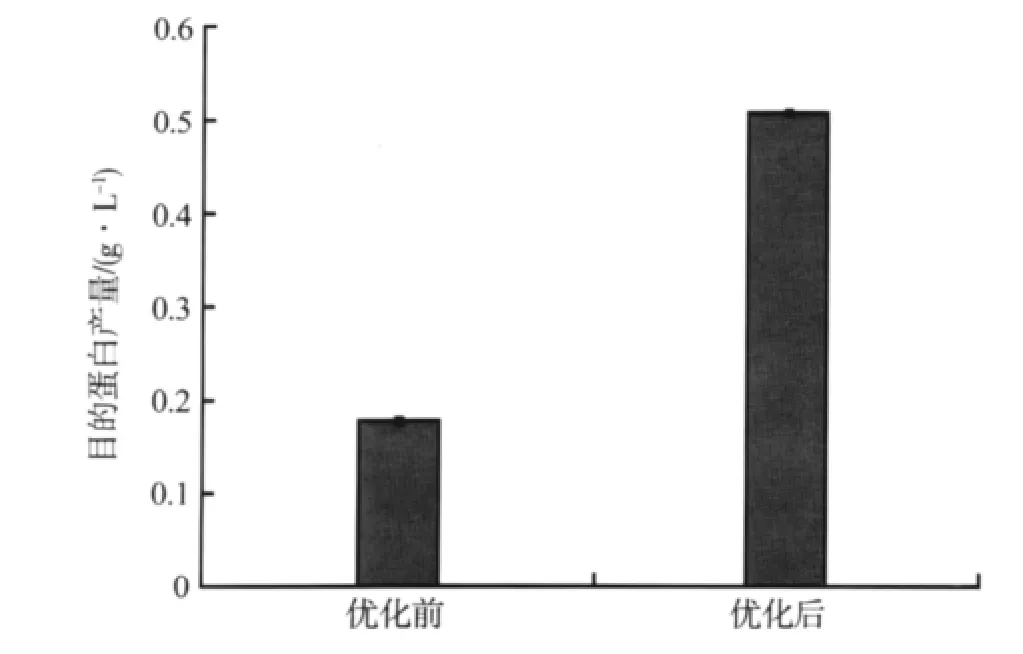
图9 优化前后CVNH蛋白产量的对比Fig.9 Comparison of CVNH protein yields between optimized and not optimized conditions
3 讨论
以大肠杆菌为代表的原核表达系统目前广泛用于外源基因的表达。作为宿主菌,大肠杆菌遗传背景清晰、易于控制、培养条件简单、生长迅速,短时间内可获得大量的蛋白质[15]。大肠杆菌Rosetta 2是BL21的改造菌种,增加了相容性的氯霉素抗性质粒,补充了七种稀有密码子 (AUA、AGG、AGA、CUA、CCC、GGA、CGG)对应的的tRNA,因而提高了含稀有密码子外源基因的表达量[16]。CVNH蛋白是最近发现的CVNH蛋白家族新成员,含有与CVN非常相似的抗HIV结构域。在前期研究中,我们首先尝试利用CVNH编码序列进行重组蛋白的制备。由于在编码序列中含有多个稀有密码子,而且存在两个稀有密码子串联存在的现象,我们选择可以额外提供稀有密码子tRNA的Rosetta 2(DE3)作为表达宿主菌,避免由稀有密码子造成的翻译问题[17]。
pET表达系统是一种高效的原核表达系统,它利用T7启动子控制外源基因的表达,而T7启动子由乳糖操纵子操控的T7 RNA聚合酶控制。外源基因克隆到宿主菌中并不立即表达,只有在诱导剂的作用下,诱导乳糖操纵子操控的T7 RNA聚合酶表达,从而启动外源基因的表达。因此,将菌体的生长和外源蛋白的表达分开,可以避免相互影响,便于控制。
本文主要探讨了最佳培养基类型及成分、培养基初始pH、诱导时机、诱导剂浓度及诱导时间对CVNH蛋白在大肠杆菌中表达的影响。以摇瓶培养的方式,对CVNH在大肠杆菌E.coliRosetta 2(DE3)中的培养条件进行了优化。具体分述如下:①培养基是宿主菌生长繁殖和目的蛋白积累的能量和物质来源,不同培养基的营养物质不同,它们对大肠杆菌的生长和CVNH蛋白的表达有影响[18]。本文确定TB培养基为最佳培养基。该培养基以甘油为碳源,可减少培养过程中乙酸的产生;磷酸盐缓冲液可维持pH的稳定,有利于宿主菌的生长及CVNH蛋白的表达。②诱导的时机非常重要[19]。诱导时机的不同,会导致宿主菌生长状态和菌体密度的不同,因而蛋白的表达量也不同。我们确定A600nm在0.6时为最佳诱导时机。③诱导剂对于外源基因的高效、稳定表达也极为重要,不同类型和浓度的诱导剂对于目的蛋白的表达量有影响[20]。IPTG虽然是常用的诱导剂,能高效的诱导蛋白的表达。但对菌体存在抑制作用和毒性,会影响质粒的稳定性,促使质粒丢失,而且价格昂贵,不适于大规模发酵生产。发酵生产中常使用乳糖为诱导剂,替代IPTG。乳糖对宿主菌没有抑制作用,可提供碳源。本文确定1.6 g·L-1的乳糖为最佳诱导剂。④诱导时间的长短能影响蛋白的表达量。诱导时间短,CVNH蛋白的表达量低;诱导时间长,乙酸等抑制物的产生会导致CVNH蛋白产量降低。本文选用乳糖诱导6 h为最佳诱导时间。⑤碳源是大肠杆菌生长过程中的能量来源,能提供合成原料和细胞碳架,因而不同的碳源对蛋白产量的影响较大[21]。本文CVNH蛋白表达不需再添加任何额外的碳源。⑥氮源是宿主菌代谢过程中含氮物的原料。培养基的氮源有两类:无机氮源和有机氮源。本文添加的其它无机氮源并没有明显提高CVNH蛋白表达量,因而决定不再增加其他氮源,仅以TB 培养基中的 24 g·L-1酵母提取物和 72 g·L-1胰蛋白胨作为最佳氮源。⑦pH能影响培养基中营养物质的离子化程度和酶的活性,从而影响宿主菌对营养物质的吸收和目的蛋白的高效表达[22]。大肠杆菌表达外源蛋白一般最佳pH为6.0~6.5,而本研究优化的最佳培养基初始pH为8.0。这是因为大肠杆菌在培养过程中,会有乙酸等代谢物的产生和累积,使培养基的pH值下降到接近最佳外源蛋白表达的pH范围。
因此,优化后的诱导条件是:含24 g·L-1酵母提取物和72 g·L-1胰蛋白胨的TB培养基、培养基初始pH为8.0、菌液A600nm为0.6时加入1.6 g·L-1乳糖诱导6 h。另外,CVNH蛋白的表达量较优化前提高了1.9倍,优化效果明显。这为工业化发酵提供了理论依据,也为进一步开展CVNH的药物研制和开发奠定了基础。
[1]BOYD M R,GUSTAFSON K R,MCMAHON J B,et al.Discovery of cyanovirin-N,a novel human immunodeficiency virus-inactivating protein that binds viral surface envelope glycoprotein gp120:potential applications to microbicide development[J].Antimicrobial Agents Chemother,1997,41(7):1521 -1530.
[2]GUSTAFSON K R,SOWDER R C,HENDERSON L E,et al.Isolation,primary sequence determination,and disulfide bond structure of cyanovirin-N,an anti-HIV(human immunodeficiency virus)protein from the cyanobacteriumNostoc ellipsosporum[J].Biochem Biophys Res Commun,1997,238(1):223 -228.
[3]YANG F,BEWLEY C A,LOUIS J M,et al.Crystal structure of cyanovirin-N,a potent HIV-inactivating protein,shows unexpected domain swapping[J].J Mol Biol,1999,288(3):403 -412.
[4]PERCUDANI R,MONTANINI B,OTTONELLO S.The anti-HIV cyanovirin-N domain is evolutionarily conserved and occurs as a protein module in eukaryotes[J].Proteins,2005,60(4):670 -678.
[5]BEWLEY C A,GUSTAFSON K R,BOYD M R,et al.Solution structure of cyanovirin-N,a potent HIV-inactivating protein[J].Nature Structural Biology,1998,5(7):571-578.
[6]BOLMSTEDT A J,O'KEEFE B R,SHENOY S R,et al.Cyanovirin-N defines a new class of antiviral agent targeting N-linked,high-mannose glycans in an oligosaccharide-specificmanner[J]. MolecularPharmacology,2001,59(5):949-954.
[7]BARRIENTOS L G,O'KEEFE B R,BRAY M,et al.Cyanovirin-N binds to the viral surface glycoprotein,GP1,2and inhibits infectivity of Ebola virus[J].Antivir Res,2003,58(1):47-56.
[8]O'KEEFE B R,SMEE D F,TURPIN J A,et al.Potent anti-influenza activity of cyanovirin-N and interactions with viral hemagglutinin[J].Antimicrob Agents Chemother,2003,47(8):2518 -2525.
[9]齐小琼,高磊,苏应娟,等.CVNH结构域的进化分析和选择压力检测[J].遗传,2010,32(1):87-94.
[10]QI Xiaoqiong,YANG Yongxia,SU Yingjuan,et al.Molecular cloning and sequence analysis of cyanovirin-N homology gene inCeratopteris thalictroides[J].A-merican Fern Journal,2009,99(2):78 -92.
[11]BEWLEY C A,OTERO-QUINTERO S.The potent anti-HIV protein cyanovirin-N contains two novel carbohydrate binding sites that selectively bind to Man8D1D3 and Man9with nanomolar affinity:implications for binding to the HIV envelope protein gp120[J].J Am Chem Soc,2001,123(17):3892-3902.
[12]SAMBROOK J,FRITSCH E F,MANIATIS T.分子克隆实验指南[M].2版.金冬雁,黎孟枫,等译.北京:科学出版社,1992:908-910.
[13]TABANDEH F,KHODABANDEH M,YAKHCHALI B,et al.Response surface methodology for optimizing the induction conditions of recombinant interferon beta during high cell density culture[J].Chemical Engineering Science,2008,63(9):2477-2483.
[14]王晓洲,刘丹.大肠杆菌工程菌发酵工艺中诱导条件的研究[J].四川文理学院学报,2010,20(2):46-48.
[15]戎晶晶,刁振宇,周国华.大肠杆菌表达系统的研究
进展[J].药物生物技术,2005,12(6):416-420.
[16]解庭波.大肠杆菌表达系统的研究进展[J].长江大学学报:自然科学版,2008,5(3):77 -82.
[17]BURGESS-BROWN N A,SHARMA S,SOBOTT F,et al.Codon optimization can improve expression of human genes inEscherichia coli:A multi-gene study[J].Protein Expression and Purification,2008,59(1):94-102.
[18]杨炜,王伟刚,田海英,等.重组大肠杆菌高表达高密度发酵研究[J].生物技术,2006,16(3):83-86.
[19]周宇荀,曹巍,魏东芝,等.抗菌肽Adenoregulin基因工程菌培养条件的优化及分批发酵研究[J].生物工程学报,2005,21(4):615 -621.
[20]RABHI-ESSAFI I,SADOK A,KHALAF N,et al.A strategy for high-level expression of soluble and functional human interferon α as a GST-fusion protein inE.coli[J].Protein Eng Des Sel,2007,20(5):201 -209.
[21]周德庆.微生物学教程[M].2版.北京:高等教育出版社,2002.
[22]魏蔚,刘萍,白斌,等.重组大肠杆菌DH5α生产rh-Tum-5-NGR培养条件的优化[J].西北大学学报:自然科学版,2010,40(4):622 -626.

