一株DEP降解菌的筛选及其休止细胞的降解特性
邱乐泉,王子超,陈 阳,董申华,钟卫鸿
(浙江工业大学 生物与环境工程学院,浙江 杭州 310032)
一株DEP降解菌的筛选及其休止细胞的降解特性
邱乐泉,王子超,陈 阳,董申华,钟卫鸿
(浙江工业大学 生物与环境工程学院,浙江 杭州 310032)
从杭州市河道污水出口的淤泥中筛选到一株邻苯二甲酸二乙酯(DEP)降解菌HZ3,研究了该菌株的休止细胞对DEP的降解特性,结果表明:该休止细胞浓度为2×108~6×108cpu/mL,pH 7.0,30℃,180 r/min条件下,可在6 h内将118 mg/L的DEP完全降解,37℃下的降解效率也无明显差异,加入0.01 g/L Tween-80则对降解效率产生了一定的抑制.休止细胞对118~1 436 mg/L的DEP表现出较高的降解能力,而生长细胞则对1 062 mg/L的DEP无降解能力.
邻苯二甲酸二乙酯;休止细胞;生物降解
邻苯二甲酸酯类化合物(Phthalicacidesters,PAEs)是世界上广泛使用的人工合成难降解有机化合物,主要用于塑料增塑剂、涂料、油漆等化工生产中.美国国家环保局(EPA)1999年公布的129种优先污染物中包括了6种PAEs类化合物[1],我国也已将其中的邻苯二甲酸二正辛酯(DOP)、邻苯二甲酸二乙酯(DEP)和邻苯二甲酸二甲酯(DMP)列为环境优先污染物[2].已有证据表明:PAEs是一类环境内分泌干扰物,其最明显的危害是使生殖机能下降,对动物及人类生殖系统有一定损害,可引起睾丸萎缩、精子减少以及生殖细胞超微结构改变.且对胚胎发育有一定毒作用[3-4].目前,PAEs在全球主要工业国的环境中已普遍检出.在土壤、河流、湖泊、海洋底质、饮用水、垃圾场乃至食品中都有检测到PAEs的存在[5-6].邻苯二甲酸酯类化合物在环境中的水解、光解速率非常缓慢,属于难降解物质.因此,微生物降解被认为是自然环境中PAEs完全矿化的主要过程[7-8].
生长细胞受到外界化学或物理作用后会相应地发生变化,如基因表达、蛋白稳定性的变化等[9].而采用休止细胞则可以避免这种影响,利用微生物自身生长代谢产酶或诱导产酶的特点将微生物培养到对数生长末期,分离菌体并以一定的浓度悬于生理缓冲液中,此时微生物已经基本停止生长代谢,但保持酶的活性,其主要优点是反应专一性强,可以提高底物转化率,不易染杂菌,可以减少产物对菌体生长及酶合成的抑制[10].为了获得高效的邻苯二甲酸酯降解菌株,有效解决邻苯二甲酸酯类化合物的环境污染,笔者以DEP为模式化合物,从杭州河道污水出口的淤泥中分离出1株DEP降解菌HZ3,研究其休止细胞对DEP的降解特性.
1 材料与方法
1.1 试剂与仪器
DEP(99.5%,上海凌峰试剂有限公司),甲醇(色谱级,天津四友化工有限公司),其余试剂均为分析纯.JEOL JEM-1230型透射电子显微镜(日本),Agilent1100高效液相色谱仪(美国).
1.2 培养基
基础无机盐培养基:K2HPO4·3H2O 1.0 g/L,NaCl 1.0 g/L,(NH4)2SO40.5 g/L,MgSO4·7H2O 0.4 g/L,CaCl20.075 5 g/L,FeCl3·6 H2O 0.014 3 g/L,pH 7.0.
选择培养基:每升无机盐培养基加适量DEP的甲醇溶液,使DEP终质量浓度为118 mg/L.
LB培养基:蛋白胨10 g,酵母膏5 g,NaCl 10 g,蒸馏水1 000 mL,pH 7.0,121℃灭菌20 min.
1.3 方 法
1.3.1 DEP降解菌的筛选
取杭州市河道污水出口处淤泥1 g置于100 mL水中,混匀,静置,然后取1 mL加入到250 mL选择培养基中,DEP初始质量浓度为118 mg/L,30℃,180 r/min培养4 d,重复多次驯化.将有明显生长的培养液稀释涂布培养,同时测DEP降解情况,平板涂布法分离得到单菌落,观察菌落形态并挑取单菌落做进一步鉴定.
1.3.2 DEP降解菌的休止细胞的制备
将菌株接种到LB培养基,30℃,180 r/min培养到对数末期,4 000 r/min离心收集细胞,用无菌水洗1次,沉淀悬浮于pH 7.0的0.1 mol/L磷酸钾缓冲液中,加入少量葡萄糖,制成菌悬液,使其菌体浓度约为2×108~6×108cpu/mL.
1.3.3 不同条件下休止细胞对DEP降解的影响
通过改变温度、pH、DEP质量浓度、休止细胞浓度及Tween-80等条件,考察不同降解条件下休止细胞对DEP降解的影响.
1.3.4 DEP检测方法
取5 mL培养液,置于具塞试管中,加入等体积石油醚,剧烈振荡,静置2.5 h,取有机层测OD240,根据DEP标准曲线计算降解率.将上层有机相在旋转蒸发仪上蒸干后用1 mL甲醇定容,以20μL进样,进一步用HPLC Agilent 1100 HPLC检测,检测条件:流动相甲醇:H2O,90:10,流速1.0 mL/min,Hypersil BDS C18色谱柱,二极管阵列(DAD)检测器,检测波长240 nm,DEP保留时间为3.414 min.
2 结果与分析
2.1 DEP降解菌的筛选与分离
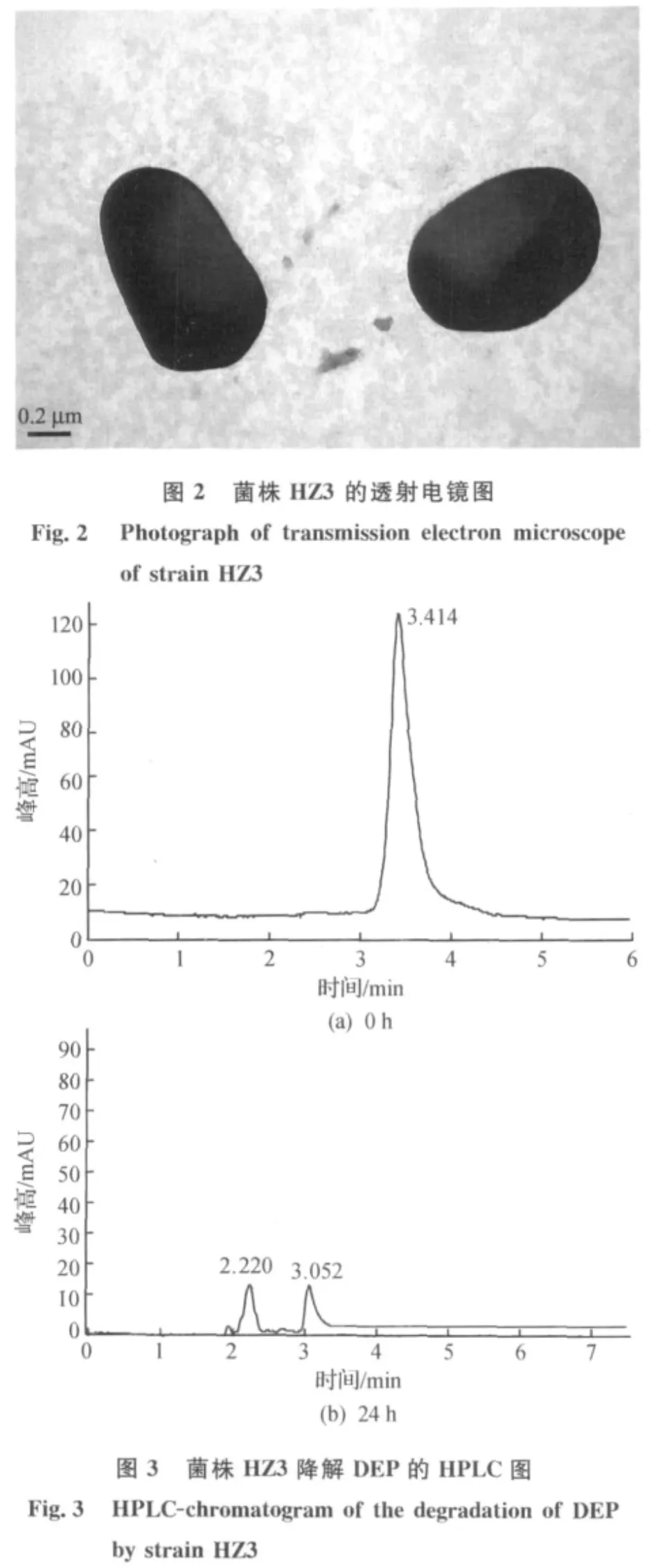
将经过多次驯化后的菌液稀释后涂布,挑取形态不同的9个单菌落接入选择培养基进一步检测,结果如图1所示,菌株HZ3的降解效果最优,在第1 d即可将DEP降解完全,而菌株HZ8,HZ9至第5 d仍未能完全降解DEP,故选取菌株HZ3作进一步研究.菌株HZ3在固体选择平板上形成的菌落呈圆形,凸起,湿润有光泽,乳白色,不透明.通过透射电镜观察(图2),菌株HZ3呈短杆状,无鞭毛.大小约0.6μm×0.35μm.HPLC分析结果表明:培养24 h后,菌株HZ3已将118 mg/L DEP完全降解(图3).
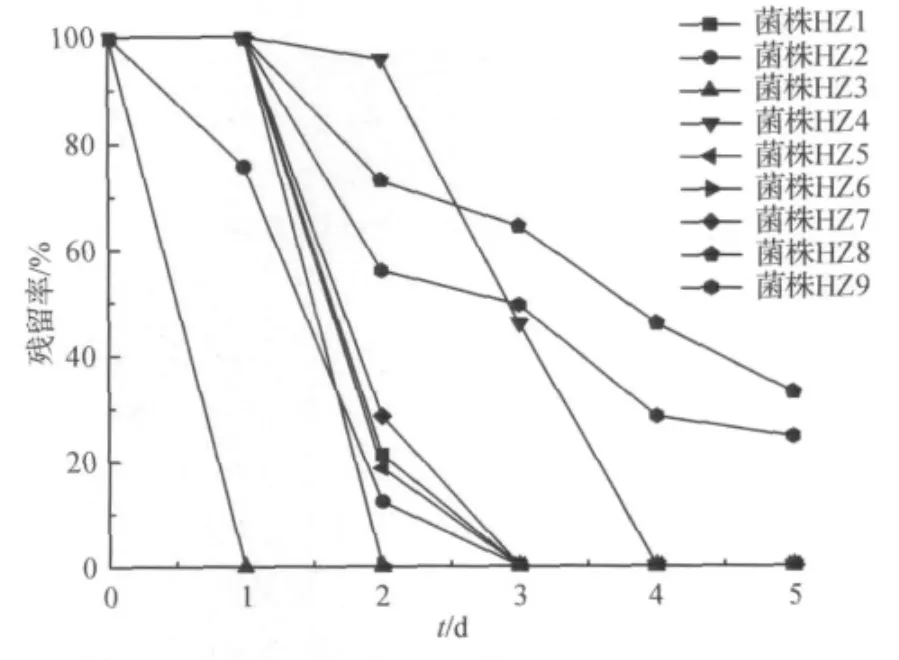
图1 DEP降解菌的筛选结果Fig.1 Screening results of DEP-degrading bacterium
2.2 温度对休止细胞降解DEP的影响
采用休止细胞浓度为2×108~6×108cpu/mL,DEP初始质量浓度为118 mg/L,30℃,180 r/min,不同温度对休止细胞降解DEP的影响如图4(a)所示,在37℃和30℃下DEP降解效率无明显差异,在6 h均能快速有效完全降解DEP.
2.3 pH对休止细胞降解DEP的影响
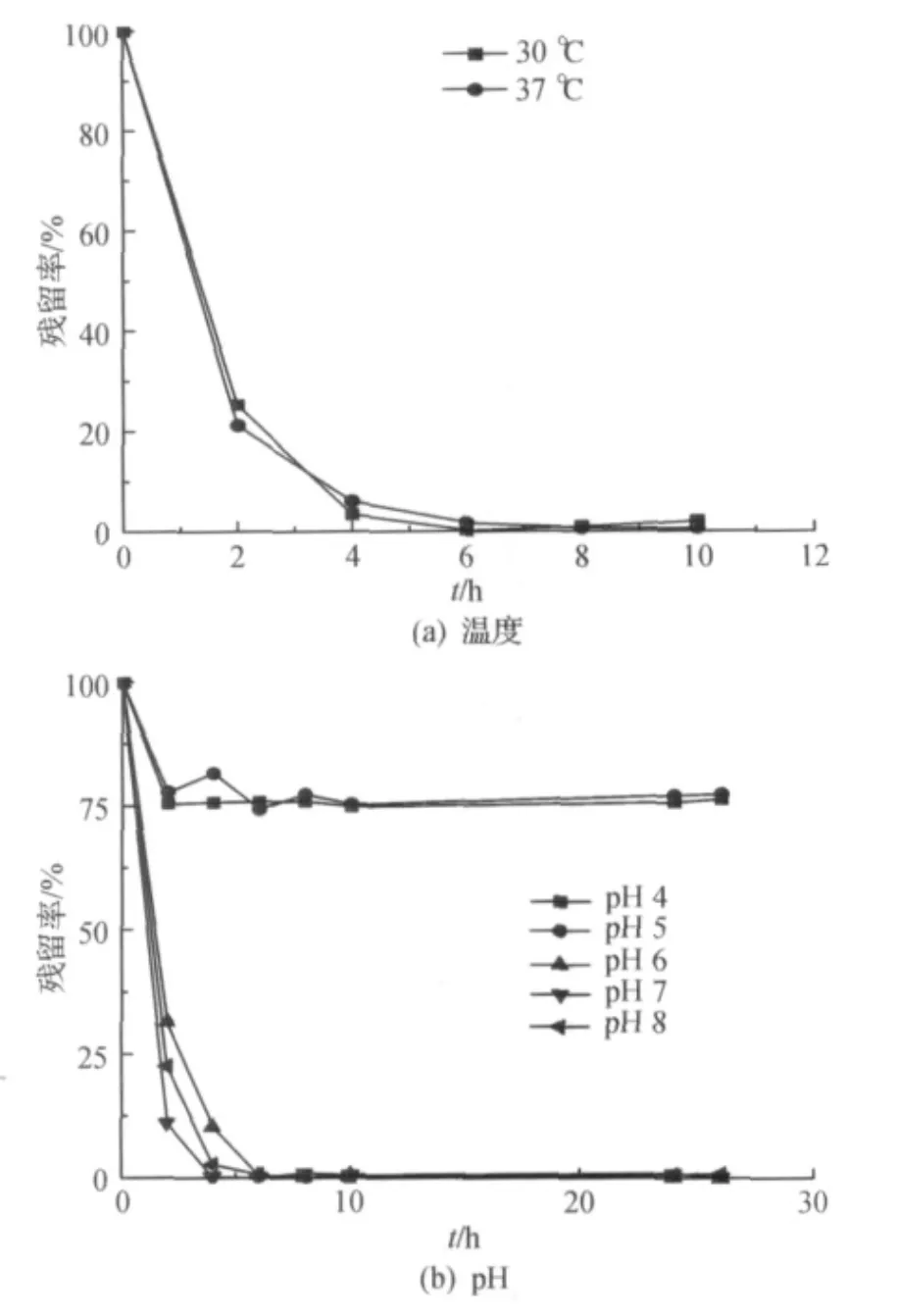
图4 温度及pH对休止细胞降解DEP的影响Fig.4 Effects of temperature and pH on the DEP-degradation of resting cells
pH 4.0,5.0的降解体系采用 HAC-NaAC缓冲液,pH 6.0,7.0,8.0的降解体系采用 PB缓冲液,休止细胞浓度为2×108~6×108cpu/mL,DEP初始质量浓度为118 mg/L,30℃,180 r/min,菌株HZ3的休止细胞降解DEP的影响如图4(b)所示,pH 7.0时降解最快,6 h将DEP完全降解.而pH4.0及5.0时,2 h时DEP降解20%左右,但在2 h以后DEP几乎不被降解.Walker等[11]曾对难降解有机物处理过程中产生的生物吸附作用进行过研究与分析,认为细菌在对污染物降解的同时对其有吸附作用,吸附作用可在几分钟到几小时完成,而在降解过程中,这2种作用同时存在并相互影响,推测在pH 4.0与5.0条件下,2 h内可降解20%,但其后则不再降解的现象可能与菌体对DEP的吸附有关.
2.4 休止细胞浓度对DEP降解的影响
分别将休止细胞浓度调为0.4×108~1.2×108,0.8×108~2.4×108,1.2×108~3.6×108,1.6×108~4.8×108,2×108~6×108cpu/mL,其他降解条件为118 mg/L DEP,30 ℃,180 r/min,菌株HZ3的休止细胞降解DEP的影响如图5(a)所示,休止细胞浓度为2×108~6×108cpu/mL略优于浓度1.6×108~4.8×108cpu/mL的降解效率,在4 h已接近完全降解DEP.随着菌液浓度的减少,降解效率也随之降低,但均能在6 h完全降解DEP.
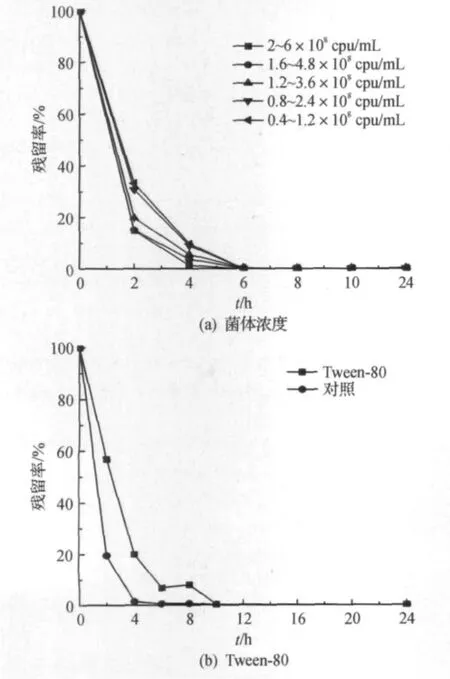
图5 菌体浓度及Tween-80对休止细胞降解DEP的影响Fig.5 Effects of cell concentration and Tween-80 on the DEP-degradation of resting cells
2.5 Tween-80对休止细胞降解DEP的影响
添加表面活性剂,可以促进DEP与水相形成微乳液,提高传质效果,从而有利于DEP的降解.取适量表面活性剂Tween-80并且加入DEP,混合后加入45 mL pH 7.0的磷酸缓冲液,使Tween-80最终质量浓度为0.01 g/L,休止细胞浓度为2×108~6×108cpu/mL,DEP质量浓度为118 mg/L,30℃,180 r/min,以未加入Tween-80的DEP磷酸缓冲液为对照.休止细胞降解DEP的影响如图5(b)所示,添加Tween-80对休止细胞的降解效率产生了一定的抑制,在10 h将DEP完全降解,而对照的完全降解时间为6 h.其原因可能Tween-80对菌体有一定的毒害作用,从而对降解产生抑制,在以后的研究中拟加入细胞毒性更小的表面活性剂如鼠李糖脂,以提高降解能力.
2.6 底物浓度对休止细胞及生长细胞降解DEP的影响
分别采用含有不同DEP质量浓度的磷酸缓冲液,休止细胞浓度2×108~6×108cpu/mL,30℃,180 r/min,底物质量浓度对休止细胞降解DEP的影响如图6(a)所示,结果表明:休止细胞对各质量浓度的DEP均能有效降解,其中118 mg/L和236 mg/L的DEP均能在6 h内完全降解.随着DEP质量浓度的增加,降解效率也随之下降,DEP被完全降解所需时间也延长,24 h可将1 436 mg/L的DEP完全降解.
此外,为了比较休止细胞与生长细胞对DEP降解能力的差异,还分别添加不同质量浓度的DEP于无机盐培养基中,30℃,180 r/min摇床培养,检测培养基中DEP残留率,结果表明:菌株HZ3的生长细胞对1 062 mg/L的DEP已无降解能力,当DEP质量浓度低于944 mg/L以下时,随DEP初始质量浓度的降低而其完全降解所需时间也缩短,但与其休止细胞相比,无论是完全降解所需的时间还是最高耐受浓度,休止细胞均远优于生长细胞,如图6(b)所示.
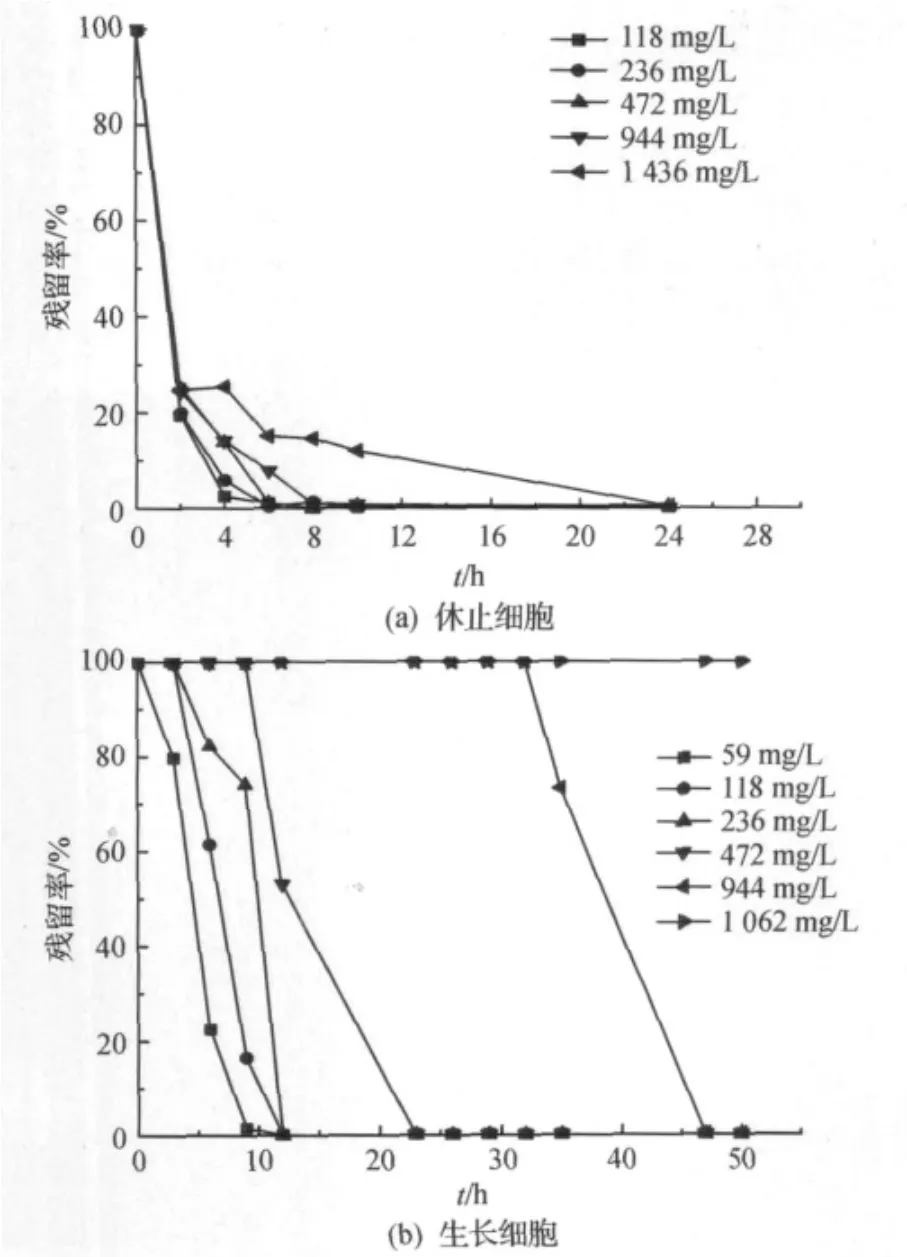
图6 不同底物浓度对休止细胞及生长细胞降解DEP的影响Fig.6 Effects of different concentration of DEP and Tween-80 on the DEP-degradation of resting cells
3 结 论
1)以DEP为唯一碳源,从杭州市河道污水出口处淤泥中筛选到一株DEP降解菌HZ3,可在1天内将118 mg/L的DEP完全降解.
2)基于休止细胞在生物降解中的优点,制备了菌株HZ3的休止细胞,考察了不同因子对休止细胞降解DEP的影响,结果表明:在休止细胞浓度为2×108~6×108cpu/mL,pH 7.0,30 ℃,180 r/min条件下,可在6 h内将118 mg/L的DEP完全降解,37℃下的降解效率也无明显差异,加入0.01 g/L Tween-80则对降解效率产生了一定的抑制.
3)休止细胞对1 436 mg/L的DEP表现出较高的降解能力,可在24 h内将其完全降解,而生长细胞则对1 062 mg/L的DEP已无降解能力,当DEP质量浓度低于944 mg/L以下时,随DEP初始质量浓度的降低将其完全降解所需时间也缩短,但休止细胞无论从降解时间还是耐受浓度上均明显优于生长细胞.
[1]周文敏.环境优先污染物[M].北京:中国环境科学出版社,1989:11-13.
[2]胡晓宇,张克荣,孙俊红.中国环境中邻苯二甲酸酯类化合物污染的研究[J].中国卫生检验杂志,2003,13(2):9-14.
[3]FATOKI O S,OGUNFOWOKAN A O.Determination of phthalate ester plasticizers in the aquatic environment of southwestern nigeria[J].Environ Int,1993,19:619-623.
[4]WANG Ying-ying,FAN Yan-zhen,GU Ji-dong.Dimetbyl phtbalate ester degradation by two planktonic and immobilized bacterial consortia[J].Int Biodeter Biodegr,2004,53:93-101.
[5]PETERSEN J H,BREINDAHL T.Plasticizers in total diet samples:baby food and infant formulae[J].Food Addit Contam,2000,17:133-14l.
[6]GU Ji-dong,LI Ji-xi,WANG Ying-ying.Biochemical pathway and degradation of phthalate ester isomers by bacteria[J].Water Sci Technol,2005,52:241-248.
[7]STAPLES C A,PETERSON D R,PARKERTON T F,et al.The environmental fate of phthalate esters:a literature review[J].Chemosphere,1997,35:667-749.
[8]骆祝华,黄翔玲,叶德赞.环境内分泌干扰物—邻苯二甲酸酯的生物降解研究进展[J].应用与环境生物学报,2008,14(6):890-897.
[9]HYUNG J C,RANJAN S,VIKRAMN V,et al.Green fluorescent protein as noninvasive stress probe in restingEscherichiacoli[J].Cells,1999,34:409-414.
[10]KILBANE J J.Desulfurization of coal:the microbial solution[J].Trends Biotechnol,1989,7(4):97-101.
[11]WALKER G M,WEATHERLEY L R.Biodegradation and biosorption of acid anthraquinone dye[J].Environmental Pollution,2000,108(2):219-223.
Screening of a diethyl phthalate-degrading bacterium and biodegradation characteristics of its resting cell
QIU Le-quan,WANG Zi-chao,CHEN Yang,DONG Shen-hua,ZHONG Wei-hong
(College of Biology and Environment Engineering,Zhejiang University of Technology,Hangzhou 310032,China)
A bacterial strain HZ3,which could degrade DEP,was isolated from sludge of river of Hangzhou city.This research focused on DEP-degrading characteristics using resting cell of strain HZ3.When the degradation conditions were 2×108~6×108cpu/mL of the resting cell concentration,pH 7.0,30℃,and 180 r/min,118 mg/L DEP could be completely degraded in 6 h,and no significant difference was found in the degradation efficiency when occurred at 37℃.After adding 0.01 g/L Tween-80,the degradation efficiency of DEP was decreased.The resting cells still showed a high degradation capacity for a wide range of initial DEP concentrations of 118~1 436 mg/L,the growing cells,however,were not capable of degrading the DEP with an initial concentration of 1 062 mg/L.
diethyl phthalate;resting cell;biodegradation
X172
A
1006-4303(2013)02-0178-05
2012-03-20
邱乐泉(1974—),男,江西乐安人,讲师,研究方向为应用微生物学,E-mail:lqqiu@sohu.com.
(
陈石平)

