光镜下突触数——阳性突触素颗粒数的体视学估计
彭 彬,林菁艳,杨正伟
(1.川北医学院细胞化学研究室;2.川北医学院附属医院麻醉科;3.川北医学院形态定量研究室,四川南充 637000)
突触是神经网络中神经元之间或神经元与效应细胞之间信息传递的关键结构,其数量是反应神经系统发育及功能状态的重要参数。突触的可塑性,即一定条件下其形态(包括数量等)与功能的改变[1-2],是近年来神经领域的研究热点。发育、学习与记忆以及衰老与疾病可能伴随突触的生成与解离(突触更新)[3-5],从而引起突触数量的改变,这是突触传递效能可塑性的结构基础,因此估计特定功能区域的器官组织内突触数量的变化在疾病机制及药效评价研究中具有重要意义。
突触由突触前成分、突触间隙和突触后成分组成,只有用电镜才能清晰观察。但电镜切片(超薄切片)太薄,难以在切片内连续“断层扫描”观察突触,因此我们必须采用多张连续电镜切片根据物理体视框技术进行突触数估计[6]。Tang 等[7-9]就用这样的方法估计过突触数。但这样估计突触数不仅要作连续超薄切片,还要在不同切片上的相同部位拍照、观察并计数突触;不仅要注意保证计数足够数量的突触,还要注意估计切片厚度(以估计体视框的高度)。这些都是比较困难的。
突触的突触前成分包括突触前膨大和突触前膜两部分,在光镜下为直径约0.5 μm至数微米不等的纽扣状结构,称为终扣,内含大量突触小泡[10]。人们发现,突触小泡有一种分子量为38 KD的酸性钙结合糖蛋白——突触素(英文可缩写成 SYP、SYN、p38),它特异性地分布于突触小泡的膜上,几乎存在于中枢和外周神经系统的所有神经末梢[11-12]。由于突触素的发现,人们从1985年开始采用组化技术在光镜下显示并观察突触——突触素阳性颗粒,它实际上是成簇的突触小泡[13],因此,光镜下观察的突触素颗粒数,可以反映突触数。现在已有研究[14-16]用体视学方法在光镜下估计突触素颗粒数,并以此反映突触数。例如,我们曾估计过大鼠脊髓背角内的突触素颗粒数,发现坐骨神经切断或松结扎所致神经病理性疼痛导致脊髓背角内突触素颗粒数增加70%以上[15-16]。虽然突触素颗粒数未必完全等于突触数,突触素颗粒数与突触数之间的差异以及突触素颗粒数与突触传递功能的关系等尚需研究确定,但由于在光镜下估计突触素颗粒数远比在电镜下估计突触数简便得多,我们认为值得推广运用。下面介绍光镜下估计突触素颗粒数的基本方法以及我们的经验体会。
1 切片制备
1.1 切片与染色
石蜡切片或冰冻切片均可用于突触素免疫组化染色[14-17],其中石蜡切片是最常用、最基本的方法。根据标记物的不同,免疫组化常用的染色方法有免疫荧光法、免疫酶标法与亲和组织化学法,后者敏感性更高,有利于微量抗原(抗体)在细胞或亚细胞水平的定位,其中抗生物素-生物素方法最常用[18]。
尤其要注意的是,封片剂有水溶性和油溶性两种,由于水溶性封片剂不能长期保存且盖玻片容易脱落。因此,最后封片要用油溶性封片剂,国内常用的是中性树胶。用它封片后切片将干燥、固定,便于用油镜观察(见下面)。此外,与水溶性封片剂相比,中性树胶与镜油的折光率更一致[19],这样才能更准确的测量体视框的高度(见下面)。

1.2 切片厚度
突触素颗粒呈棕黄色的颗粒状、点状或圈状(图1、图2)。根据我们的测量,其直径为0.6~1.5 μm(平均约0.9 μm)。因此,从利于辨认与计数的角度考虑,我们以为实际测量(用于突触素颗粒计数)的切片厚度不宜小于3 μm。考虑到切片上表面约1 μm的组织可能凹凸不平、存在组织破坏甚至染色不佳,因此我们不计数这个厚度(监视厚度)的切片组织,而从其下面的聚焦平面开始计数。又考虑到切片厚度的变异[20],实际观测切片(染色后的切片)的厚度应不宜小于5 μm。再考虑到切片染色过程中的切片压缩[20],石蜡切片的厚度(切片机设定的切片厚度)可能不宜小于7 μm。
我们曾用石蜡切片染色显示突触素颗粒,切片机设定的切片厚度是14 μm,由于切片、染色过程中的切片压缩,最后实际观测切片的厚度约为10 μm。突触素颗粒染色可穿透整个这个厚度的切片,即整个切片厚度内均可见阳性突触素颗粒[15-16]。
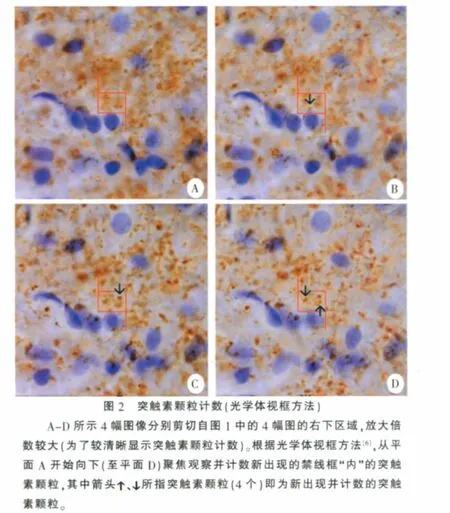
2 突触素颗粒计数
突触素颗粒计数的基本方法是光学体视框,其基本方法如下[6]:用油镜摄取图像,在电脑显示屏上观察;均匀随机抽选测试视野,在视野上叠加一定数量的测点和禁线框(图1、图2);先在切片的上表面聚焦,然后手动向下移动一定距离(监视厚度),从此聚焦平面开始,再向下连续聚焦一定距离(计数厚度)的切片组织,边聚焦边观察并计数(这个厚度的切片组织内)禁线框“内”新出现的突触素颗粒(图1、图2)。这里,计数颗粒的空间即体视框,其底面积为禁线框的面积,高为用于计数的切片组织的厚度(计数厚度)。通过上下移动油镜而在厚切片内连续观察的聚焦平面即光学切片(不是用切片机切的物理切片),因此这种技术叫光学体视框。
应注意:①用光学体视框的计数既要用油镜,也要用中性树胶封固切片。用油镜不仅仅是为了能清晰地连续“断层扫描”观察切片及结构,也是为了更准确的测量光学切片的移动距离(体视框高度),因为镜油(与空气相比)的折光率与切片组织(树胶封固)的折光率更一致[19],这样测量的载物台(或油镜)移动距离才更准确的反映体视框高度。②为估计用于颗粒计数的体视框的数量或总体积,在每个视野上要定义一定数量的测点,并计数位于所测组织区域内的测点数,以此估计用于颗粒计数的所测组织(体视框)的总体积[6]。
3 突触素颗粒数估计
用于计数突触素颗粒的禁线框有一定面积a,将之乘以体视框高度h以及所用禁线框总数n(根据测点计数估计,见上述),即得体视框的总体积V(V=a×h×n)。结合所计数到的突触素颗粒总数Q-,即可估计所测组织内突触素颗粒的数密度NV(=Q-/V)。再结合所测器官组织(经一系列组织处理后的器官组织)的总体积V’,即可估计所测器官组织内的颗粒总数N(=NV×V’)。
吴亮生等[14]曾用这种方法估计过大鼠松果体内的突触素颗粒总数。这种方法中,处理后器官组织的体积V'估计较难[6]。为避免估计这个体积,我们可采用分合法(结合光学体视框)进行估计[6],也可在计数突触素颗粒的同时,计数数量较稳定的神经元的数量,以突触素颗粒和神经元数量之比反映突触素颗粒总数[15-16],见下面的实例。
4 实例:L5节段脊髓背角内突触素颗粒数的估计
4.1 切片制备
4月龄SD大鼠1只,作左侧坐骨神经松结扎[15],28 d后用4%多聚甲醛经心脏进行灌注固定,然后打开椎管并根据脊神经根的位置沿垂直于脊髓长轴的方向切取脊髓腰膨大(L4~L6)。用4%多聚甲醛浸润固定(后固定)腰膨大24 h,用70%乙醇脱水2 d,然后沿垂直于脊髓长轴的方向将腰膨大均匀切分成6块(每块约2 mm厚),取其中第3或第4块(即中间2块中的1块)做石蜡包埋。(之所以只取1块,一方面是为了减少工作量,另一方面是因为这其中1块是坐骨神经在脊髓的主要投射区域。)从石蜡包埋的组织块连续切取30张14 μm厚的连续切片(脊髓横断面切片),从中等距随机抽选5张(第1张切片从第1~6张连续切片中随机抽选,以后每6张抽选1张)用于甲苯胺蓝染色,另等距随机抽选5张用于突触素免疫组化染色。切片、裱片过程中特别注意了脊髓切片的头尾侧或左右侧方向。
4.2 染色方法
甲苯胺蓝染色方法:常规脱蜡至水后,切片放入57℃的0.01%甲苯胺蓝溶液中染色5 min,再经95%乙醇分色1 min,常规脱水、透明及中性树胶封片。
突触素免疫组化染色方法:常规脱蜡至水后,切片放入3%H2O2孵育10 min,再经热抗原修复,山羊血清封闭15 min,然后用突触素(synaptophysin)的小鼠单克隆抗体(1∶200)孵育(4℃)过夜;接着依次用生物素标记的羊抗鼠IgG和辣根酶标记链酶卵白素(S-A/HRP)各孵育(37℃)15 min,最后在室温下用DAB显色4 min,苏木精复染4 min,常规脱水、透明、中性树胶封片。
4.3 体视学估计
4.3.1 突触素颗粒数估计 用体视学图像系统(丹麦Visiopharm产品)观测突触素颗粒染色切片(5张)。先在4×物镜下用光标圈定拟测的脊髓背角区域,然后用100×油镜(UPlanSApo,NA 1.40)观察切片,切片图像在电脑显示屏上的最后放大倍数为2 240。先设定视野抽样面积(实测视野面积)为脊髓背角区域面积的0.5%,然后依次等距随机抽选并观察视野。在每个视野上叠加9个测点及4个禁线框(每个面积为57.62 μm2),见图1。先计数位于脊髓背角内的测点数,然后计数每个禁线框“内”的突触素颗粒数:先在切片上表面聚焦,然后向下移动0.5 μm(监视厚度),从此计数平面开始,手动向下连续聚焦7 μm(计数厚度),同时观察并计数在这7 μm厚的切片组织内禁线框里新出现的突触素颗粒。
5张切片中,位于左侧脊髓背角内的测点总数(P左)为404,背角里计数到的突触素颗粒数()总共为694。右侧脊髓背角内的测点总数(P右)为435,背角里计数到的突触素颗粒数()总共为425。
每个测点所关联的体视框的体积(VP)为179.26μm3=(4×57.62×7/9)μm3。左侧脊髓背角内突触素颗粒的数密度:
5张切片左侧脊髓背角区域的总面积A左为:(P左×4×57.62/9)/0.5% =2.07 mm2,因此左侧脊髓背角区域横断面的平均面积为 0.41 mm2(=A左/5)。基于此,单位长度(例如每毫米长)脊髓的左侧脊髓背角内的突触素颗粒总数为:
NL(左)=NV(左)×=3.93×106(mm-1)
同样地,单位长度右侧脊髓背角内的突触素颗粒总数为:
NL(右)=NV(右)×=2.45×106(mm-1)
鉴于新鲜脊髓组织在固定、脱水、染色、封片等步骤中会缩短约43%[15-16],因此单位长度新鲜脊髓的左侧脊髓背角内的突触素颗粒总数为:
NL(左)×(100%-43%)=2.24×106(mm-1)
单位长度新鲜脊髓的右侧脊髓背角内的突触素颗粒总数为:
NL(右)×(100%-43%)=1.40×106(mm-1)
4.3.2 神经元数估计 如上所述,用体视学图像系统观测甲苯胺蓝染色切片(5张)。不过,这里计数的是脊髓背角内的神经元细胞核的核仁,每个视野只测了1个面积为2 074 μm2的禁线框,实测视野面积为脊髓背角面积的5%。
5张切片里,位于左侧脊髓背角内的测点总数(P左)为576,背角里计数到的神经元(核仁)数()总共为105。右侧脊髓背角内的测点总数(P右)为543,背角里计数到的神经元(核仁)数()总共为108。
根据上述计算方法,单位长度脊髓(处理后,非新鲜)的左侧脊髓背角内的神经元总数为60.00×103(mm-1),单位长度(处理后)右侧脊髓背角内的神经元总数为61.71×103(mm-1)。
4.3.3 突触素颗粒与神经元数量之比 把处理后左侧单位长度脊髓背角内的突触素颗粒总数,除以处理后左侧单位长度脊髓背角内的神经元总数,即得左侧脊髓背角内突触素颗粒与神经元数量之比为65.50。同样获得右侧脊髓背角内突触素颗粒与神经元数量之比,结果为39.70。这两个(左侧与右侧)结果说明了左侧坐骨神经松结扎使左侧腰膨大脊髓背角内的突触素颗粒数增加了65%(与右侧相比)。对此项结果解释说明:假设坐骨神经松结扎在不同动物的左、右两侧交替进行,假设65.50和39.70分别为结扎侧与对侧(对照)的平均结果(突触素颗粒与神经元数量之比)且差异有统计学意义,那么这两个结果说明坐骨神经松结扎使结扎侧腰膨大脊髓背角内的突触素颗粒数增加了65%(与对侧相比)。这是因为,假设坐骨神经松扎术不会影响任一侧脊髓背角内神经元的数量,那么任一侧脊髓背角内突触素颗粒与神经元数量之比的增减即突触素颗粒数的增减[15-16]。
[1] Cotman CW,Nieto-Sampedro M.Cell biology of synaptic plasticity[J].Science,1984,225(4668):1287-1294
[2] 张 强,叶桂兰.神经突触可塑性[J].神经疾病与精神卫生,2002,2(2):115-117
[3] 吴 萍,周 洁,邓锦波.突触的发生与神经退行性病变[J].医学研究杂志,2011,40(2):116-120
[4] Borlikova GG,Trejo M,Mably AJ,et al.Alzheimer brain-derived amyloid β-protein impairs synaptic remodeling and memory consolidation[J].Neurobiol Aging,2013,34(5):1315-1327
[5] Balietti M,Tamagnini F,Fattoretti P,et al.Impairments of synaptic plasticity in aged animals and in animal models of Alzheimer's disease[J].Rejuvenation Res,2012,15(2):235-238
[6] 杨正伟.生物组织形态定量研究基本工具:实用体视学方法[M].北京:科学出版社,2012
[7] Tang Y,Nyengaard JR,Pakkenberg B,et al.Stereology of neuronal connections(myelinated fibers of white matter and synapses of neocortex)in human brain[J].Image Anal Stereol,2003,22(3):171-182
[8] Brown SM ,Napper RM ,Mercerl AR.Analysis of structural plasticity in the honey bee brain using the Cavalieri estimator of volume and the disector method[J].Image Anal Stereol,2000,19:139-144
[9] 朱 华,李利华,杨举伦,等.吗啡对大鼠心理依赖相关脑区超微结构和突触数量的影响[J].解剖学杂志,2005,28(2):185-187
[10]成令忠,钟翠平,蔡文琴.现代组织学[M].上海:上海科学技术文献出版社,2003
[11] Wiedenmann B,Franke WW.Identification and localization of synaptophysin,an integral membrane glycoprotein of Mr 38,000 characteristic of presynaptic vesicles[J].Cell,1985,41(3):1017-1028
[12] Navone F,Jahn R,Di Gioia G,et al.Protein p38:an integral membrane protein specific for small vesicles of neurons and neuroendocrine cells[J].J Cell Biol,1986,103(6Pt 1):2511-2527
[13] Jahn R,Schiebler W,Ouimet C,et al.A 38,000-dalton membrane protein(p38)present in synaptic vesicles[J].Proc Natl Acad Sci USA,1985,82(12):4137-4141
[14]吴亮生,王 蕾,马玉琼,等.大鼠松果体的神经支配——免疫组织化学及光镜体视学研究[J].解剖学报,2005,36(3):288-291
[15] Peng B,Lin JY,Shang Y,et al.Plasticity in the synaptic number associated with neuropathic pain in the rat spinal dorsal horn:a stereological study[J].Neurosci Lett,2010,486(1):24-28
[16] Lin JY,Peng B,Yang ZW,et al.Number of synapses increased in the rat spinal dorsal horn after sciatic nerve transection:a stereological study[J].Brain Research Bulletin,2011,84(6):430-433
[17] Dlugos CA,Pentney RJ.Quantitative immunocytochemistry of GABA and synaptophysin in the cerebellar cortex of old ethanol-fed rats[J].Alcohol Clin Exp Res,2002,26(11):1728-1733
[18]蔡文琴.现代实用细胞与分子生物学实验技术[M].北京:人民军医出版社,2003
[19] Andersen BB,Gundersen HJ.Pronounced loss of cell nuclei and anisotropic deformation of thick sections[J].J Microscopy,1999,1969(1):69-73
[20]彭 彬,陈茂山,李 惠,等.不同器官石蜡包埋切片的切片压缩研究[J].中国体视学与图像分析,2012,17(3):219-225

