江西部分地区猪痘病毒PCR检测及P35基因的分析
邓舜洲,蒋新华,冷 闯,朱芝秀,邬向东,戴益民,张文波
(江西农业大学动物科学技术学院,江西南昌330045)
猪痘病毒(Swinepox virus,SWPV)是痘病毒科(Poxviridae)脊椎动物亚科(Chordopoxvirinae,ChPV)猪痘病毒属(Suipoxvirus)的唯一成员[1],以引起猪的发热,表皮损伤,形成痘疹和结痂为特征;主要危害4月龄以内的仔猪,发病率可达100%,成年猪呈温和性感染,而且其发病率与饲养环境有关[2]。SWPV具有严格的宿主特异性,猪是该病毒的唯一自然感染宿主。1842年Spinola首次在欧洲发现本病并报道,1960年Kasza L等[3]利用PK-15细胞分离到猪痘病毒;2011年Maria M L等[4]报道巴西某猪场的保育猪暴发猪痘。目前,猪痘呈世界性分布[2]。
由于猪痘对养猪业造成的直接损失较小,虽然也有猪痘病毒感染引起流产或死胎等繁殖障碍的报道[5],但猪痘临床上主要表现部分猪皮肤出现不同程度的损伤(如水疱、痘痂、局部溃烂等),大部分感染猪能自行康复,因此,猪痘防控工作常被畜牧兽医工作者忽视。猪痘病毒的研究主要集中于猪痘病毒作为表达载体[6-8]。国内也有猪痘病例报道,但仅限于临床诊断[9-11],未见从分子生物学角度进行猪痘流行病学调查的报道。
本研究根据NCBI登录的SWPV(AF410153.1)P35保守基因序列,设计并合成一对引物,从江西省36个规模化猪场采集疑似猪痘病猪的皮肤痘痂,提取DNA后进行PCR检测,了解江西省猪群中猪痘病毒的感染情况。在此基础上,对江西省部分地区猪痘病毒阳性病料的P35保守基因进行测序,通过对P35基因比对分析,了解江西株之间及其与参考毒株间的亲缘关系,为今后进行猪痘病毒的相关研究积累资料。
1 材料与方法
1.1 材料
1.1.1 主要试剂 Taq DNA聚合酶、dNTPs、DNA Marker DL 2 000、pEASY-T3Cloning Kit均购自北京全式金生物技术有限公司;PCR产物胶回收试剂盒购自天根生化科技(北京)有限公司;JM109工程菌由江西农业大学预防兽医学实验室保存。
1.1.2 病料 55份猪皮肤痘痂为2011年-2012年采集自江西省7个地区(市)共36个规模化猪场中发生明显皮肤痘斑的保育猪(30日龄~70日龄)或母猪,用于测序分析的猪痘病毒阳性病料的背景资料见表1。
1.1.3 引物设计与合成 根据GenBank登录的猪痘病毒(AF410153.1)基因序列,采用Primer5.0软件设计一对扩增猪痘病毒P35基因的引物:

扩增目的片段大小为975bp,上、下游引物分别引入EcoRⅠ和XhoⅠ酶切位点,引物由Invitrogen (上海)有限公司合成。

表1 猪痘病毒阳性皮肤痘痂来源背景Table 1 The background of swinepox virus positive skin variolar crust in Jiangxi province
1.2 方法
1.2.1 病料中猪痘病毒P35基因的PCR检测 分别取疑似猪痘的皮肤痘痂0.5g剪碎,加入800μL生理盐水匀浆,12 000r/min离心10min,取上清液600μL,按奥斯伯等[12]介绍的方法,以提取的DNA为模板进行PCR扩增。PCR反应体系为50μL,其中含10×EasyTaqbuffer 5μL,5U/μL的DNA聚 合 酶 0.5 μL,2.5mmol/L dNTPs 4 μL,20μmol/L的上下游引物各0.5μL,模板2μL,ddH2O 37.5μL。PCR反应条件为:95℃5min;95℃45s,54℃1min,72℃1min,共30个循环;最后72℃延伸8mim。PCR产物用10g/L琼脂糖凝胶电泳,胶回收扩增产物,送Invitrogen(上海)有限公司测序。
1.2.2 P35基因的克隆及测序 按照天根生化科技(北京)有限公司胶回收试剂盒说明书对PCR产物进行回收纯化,回收产物与pEASY-T3克隆载体连接,转化至感受态JM109宿主菌,筛选阳性重组菌。挑取单个菌落送Invitrogen(上海)有限公司进行测序。
1.2.3 序列分析及系统发育树绘制 将测序得到的P35基因核苷酸序列及其推导的氨基酸序列与GenBank登录的序列进行比较,利用DNA Star软件中的MegAlign进行P35基因核苷酸序列的同源性和变异分析,并构建相应的系统发育进化树。
2 结果
2.1 病料的PCR扩增结果
从55份疑似猪痘的猪皮肤痘痂中提取DNA,经PCR扩增,电泳后可见部分病料(44/55)扩增出与预期大小一致的单一条带,而正常猪皮肤(无痘斑)则未见扩增条带(图1)。结果表明以上7地区的部分猪群中存在猪痘病毒的感染。

图1 病料PCR扩增结果Fig.1 PCR results of skin vesicles
2.2 P35基因序列分析结果
对其中19份PCR产物进行测序、分析,结果表明所测序列与SWPV参考毒株(登录号:AF410153.1)的P35序列核苷酸同源性为96.3%~98.4%,推导的氨基酸同源性为87.5%~88.5%;所测序列间的核苷酸同源性为97.7%~100%,推导的氨基酸序列同源性为98.2%~100%(图2)。
2.3 系统进化分析
利用DNA Star软件构建P35基因序列的分子进化树(图3)。共分成两个大的分支,其中SWPVJX03、SWPV-JX04和SWPV-01自成一个分支,与参考毒株(AF10153.1)亲缘关系最远;其他与参考毒株组成一个大的分支,其中与参考毒株亲缘关系最近的是SWPV-JX07和SWPV-JX08;各阳性病料之间的同源性都很高。
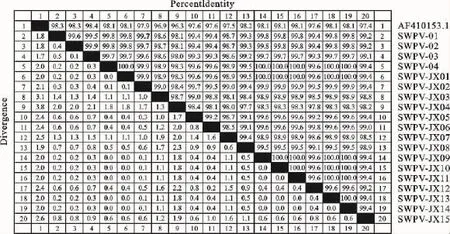
图2 P35基因核苷酸序列同源性比较Fig.2 Nucleotide identity of nucleotides from SWPV-JX P35gene

图3 P35基因核苷酸序列分子进化树Fig.3 Phylogenetic tree of nucleotides from SWPV-JX P35gene in Jiangxi province
3 讨论
欧洲、北美和大洋洲均有暴发猪痘的报道,还有先天性感 染 SWPV 的 报 道[2,13-14]。2010年-2011年,巴西圣保罗的3个养猪场共3 460头猪有850头出现皮肤脓疱、丘疹症状,最后结痂,利用分子生物学方法确定该病原为SWPV[4]。国内安徽、黑龙江等也有关于猪痘病例的报道,发病猪主要集中在保育到育肥阶段[9-11],但仅限于临床诊断,均未从分子生物学方面进行研究。
SWPV的全基因组序列测定已完成,其基因组大小约为146kb,含有150个开放阅读框(ORF)。其中P35基因编码猪痘病毒胞内成熟病毒粒子(IMV)囊膜表面的一个主要结构蛋白P35,其同源基因也存在于其他痘病毒属,且具有高度保守性[1],推测其在猪痘病毒中也具有保守性,可用于猪痘病毒的检测和分析。国外Olivia等利用P35保守基因的同源基因进行痘病毒属之间的亲缘关系比较分析。
近年来,在江西部分地区的规模化猪场的保育仔猪常出现疑似SWPV感染的皮肤痘疹样病变,为了解其病原和感染情况,本文利用PCR方法从收集的55份样品中检测到44份阳性病例,阳性率达80%,证实江西省部分地区猪群中存在猪痘病毒感染。随机取19份PCR产物进行测序和序列分析,结果所测的序列与SWPV参考毒株的核苷酸同源性为96.3%~98.4%,推导的氨基酸同源性为87.5%~88.5%;所测的19条序列之间的核苷酸同源性为97.7%~100%,推导的氨基酸序列同源性为98.2%~100%。表明本次扩增的基因均为SWPV的P35基因序列,与参考毒株的相应序列相比,变异度不大,保守性较强,可用于SWPV的分子流行病学调查和作为SWP诊断的靶标。
本试验从江西部分规模化猪场采集可疑猪痘病毒病料,进行PCR检测,并对部分PCR产物进行序列测定和分析,并分析比较了地方毒之间、地方毒与国外分离毒之间P35基因变异情况,为江西省猪痘病毒的诊断、预防及流行病学研究积累了基础资料。
[1] Afonso C L,Tulman E R,Lu Z,et al.The Genome of swinepox virus[J].J Virol,2002,76(2):783-790.
[2] Straw B E,Zimmerman J J,D’Allaire S,et al.Diseases of swine(9th Edition)[M].Ames(IA):Iowa State University Press,2006:483-487.
[3] Kasza L,Bohl E H,Jones D O.Isolation and cultivation of swinepox virus in primary cell cultures of swine origin[J].Am J Vet Res,1960,21:269-273.
[4] Medaglia M L,Pereira Ade C,Freitas T R,et al.Swinepox virus outbreak,Brazil,2011[J].Emerg Infect Dis,2011,17(10):1976-1978.
[5] Thibault S,Drolet R,Alain R,et al.Congenital swine pox:A sporadic skin disorder in nursing piglets[J].Swine Health and Production,1998,6(6):276-278.
[6] Van der Leek M L,Feller J A,Sorense G,et al.Evaluation of swinepox virus as a vaccine vector in pigs using an Aujeszky’s disease(pseudorabies)virus gene insert coding for glycoproteins gp50and gp63[J].Vet Rec,1994,134(1):13-18.
[7] Hahn J,Park S H,Song J Y,et al.Construction of recombinant swinepox viruses and expression of the classical swine fever virus E2protein[J].Virol Meth,2001,93(1-2):49-56.
[8] Lin H X,Huang D Y,Wang Y,et al.A novel vaccine against Streptococcus equi ssp.zooepidemicus infections:The recombinant swinepox virus expressing M-like protein[J].Vaccine,2011,29(40):7027-7034.
[9] 孙坤林,张 俊,魏居正.猪痘临诊调查[J].中国兽医杂志,1997,23(9):30.
[10] 范永青,张传明,袁永财,等.仔猪痘样疹的诊治[J].畜禽生产,2008(8):46.
[11] 黎 丽,俞 宁,何 刚.猪痘的诊断与防制[J].畜牧与饲料科学,2009,30(7-8):60-61.
[12] 奥斯伯著;颜子颖,王海林译.精编分子生物学试验指南[M].北京:科学出版社,1998.
[13] Jubb T F,Ellis T M,Peet R L,et al.Swinepox in pigs in northern Western Australia[J].Aust Vet,1992,69(4):99.
[14] Borst G H,Kimman TG,Gielkens A L,et al.Four sporadic cases of congenital swinepox[J].Vet Rec,1990,127(3):61-63.

