胎羊肾细胞用于增殖H1N1亚型流感病毒的初步研究
向 敏,高其双,陈志华,黄海军,卢 顺,彭 霞,陶弼菲,占才耀,夏 瑜,华 娟,童伟文,王莲芳
(武汉市畜牧兽医科学研究所,湖北 武汉 430208)
近年来,流行的甲型H1N1流感和H5N1高致病性禽流感,传播速度快,波及范围广,给人们的健康和养殖业带来了新的威胁。直到目前,人类还没有研制出用于治疗流感的特效药物,预防和控制流感主要依靠接种流感疫苗。在我国,流感疫苗的生产还主要依靠传统的鸡胚培养技术[1]。这种技术需要耗用大量的优质鸡胚,生产成本高,质量难以控制。此外,利用鸡胚生产流感疫苗,在处理废弃的鸡胚残体时只能采用焚烧或其他无害化的处理方法,对环境有一定的污染。相比之下,细胞培养流感病毒具有周期短、质量易控制、抗原性好和环保等优点,所以WHO建议使用哺乳动物细胞培养流感病毒来替代鸡胚制备流感疫苗[2]。国内外的研究者也将细胞培养流感病毒作为流感疫苗研究的方向,探索用细胞培养流感病毒的生产工艺。目前用于培养流感病毒的细胞主要有MDCK细胞和猴肾细胞(Vero),关于流感病毒疫苗的研究也主要依靠这两种细胞[3]。因此,寻找新的适合于流感病毒增殖的细胞,能为流感病毒及其疫苗的研究工作提供更多的选择。
本研究取胎羊肾组织制备原代细胞,研究胎羊肾细胞用于流感病毒增殖的可能性。
1 材料与方法
1.1 材料
1.1.1 细胞及毒株 MDCK细胞由华中农业大学动物医学院惠赠;H1N1亚型流感病毒A/WS/33株购自武汉大学典型培养物保藏中心,由本研究室保存。
1.1.2 鸡胚与实验动物 SPF鸡胚购自梅里亚维通公司;怀孕60d的健康麻城黑山羊。
1.1.3 主要试剂 DMEM高糖培养基(粉剂)、胎牛血清(FBS)和胰蛋白酶购自GIBCO公司;新生牛血清购自武汉双博亚农业生物科技有限公司;双抗和TPCK胰酶购自Sigma公司;地高辛糖苷键分析试剂盒(DIG glycan differentiation kit)购自Roche公司;荧光素标记的鼠抗地高辛抗体购自Jackson公司。
1.2 方法
1.2.1 细胞培养液和消化液的配制 细胞培养液及消化液参考文献[4]所述的方法进行配制。细胞培养液:DMEM高糖培养基按说明书配制成溶液,0.22μm滤膜过滤除菌,加入150mL/L胎牛血清(或新生牛血清)和青霉素、链霉素各100单位/L,4℃保存备用。消化液:取胰蛋白酶粉剂,用0.01mol/L的无Ca、Mg的PBS配制成2.5g/L胰蛋白酶-0.2mL/L EDTA 的细胞消化液,0.22μm滤膜过滤除菌,分装10mL小瓶,置-20℃冻存备用。
1.2.2 细胞分离与原代培养 将怀孕60d的母羊麻醉,在无菌环境中作剖腹手术取出胎儿,立即放入盛有约100mL灭菌无Ca、Mg的PBS的烧杯中,密封杯口,快速移入无菌室,在超净工作台内取出胎儿肾组织。参考文献[5]所述的方法,用眼科剪将肾皮质区域剪成糜状,吸取无Ca、Mg的PBS液反复冲洗,加入消化液于37℃消化30min,离心收集细胞制备成单个细胞悬液,用培养液调整细胞密度至2×104个/mL,分装于100mL规格的一次性细胞瓶中,于37℃、体积分数为5%的CO2培养箱中进行原代培养。
1.2.3 肾上皮细胞的初步纯化和传代 原代细胞长满细胞瓶底之后,吸弃培养上清,用细胞消化液消化细胞。将消化好的细胞用培养液重悬,参考文献[6]对原代细胞进行初步纯化。具体方法:重悬的细胞于37℃静置30min,稍加振荡,将培养液连同尚未贴壁的细胞一起吸到另一细胞瓶中静置培养。细胞长满瓶底后,按此方法进一步纯化。3次纯化后,细胞按1∶2的比例(1瓶内的细胞接种到2个细胞瓶内)进行传代培养。
1.2.4 流感病毒受体的检测 取生长状态良好的胎羊肾细胞,弃去培养液,用地高辛糖苷键分析试剂盒中地高辛标记的凝集素DIG-SNA和DIG-MAA作为一抗,于室温下与待检的细胞孵育1h。PBS洗涤3次以后,加入荧光素标记的鼠抗地高辛抗体,室温下避光孵育1h。再次用PBS洗涤3次,置荧光显微镜下观察。同法检测MDCK细胞流感病毒受体,并设置一抗空白对照。
1.2.5 流感病毒增殖试验
1.2.5.1 流感病毒的准备 H1N1亚型流感病毒经SPF鸡胚传代扩增后,无菌收获尿囊液,置-80℃冻存备用。接种前,用含2μg/mL TPCK胰酶的维持液(含20g/L FBS的DMEM高糖培养基)稀释病毒。
1.2.5.2 病毒增殖及血凝价测定 选取培养48h生长良好的胎羊肾细胞若干瓶,弃去培养液,向每个瓶中加入稀释的病毒液1mL,摇晃使病毒液沾满细胞培养面,移入37℃培养箱静置1h,让病毒充分吸附细胞。吸附后向培养瓶中补加维持液5mL,放入培养箱中继续培养。每12h在显微镜下观察细胞一次,当细胞出现80%以上细胞病变时,立即将培养瓶移入-20℃冰箱中冻融2次,收获冻融物,直接血凝法测定病毒的血凝价[7]。同法用于 MDCK细胞检测,重复试验5次。
1.2.5.3 病毒在不同代次细胞中增殖的情况 将细胞进行传代培养,连传10代。每代细胞长满单层后,用流感病毒进行感染,待细胞出现80%以上病变时收获细胞培养物并冻融2次,直接血凝法测定每代细胞培养物的血凝价。
2 结果
2.1 细胞生长情况
原代的胎羊肾细胞静置培养至3d时,可看到部分细胞已贴壁生长,从形态上看主要是圆粒状细胞,也有一些长梭形的纤维细胞。培养至5d时,大部分贴壁的细胞均能分裂繁殖并形成细胞克隆,圆粒状细胞和梭形细胞克隆之间的界限较为明显(图1A)。经初步纯化后,大部分纤维细胞被去除,剩下的细胞经3次传代培养后,具有典型的上皮细胞特征。细胞的形态呈多角形,形态均一,折光性好,细胞之间排列紧密,形成鹅卵石样的单层聚集(图1B)。经数代体外培养,细胞的生长速度加快,由最初的5d传代一次变为3d传代一次。
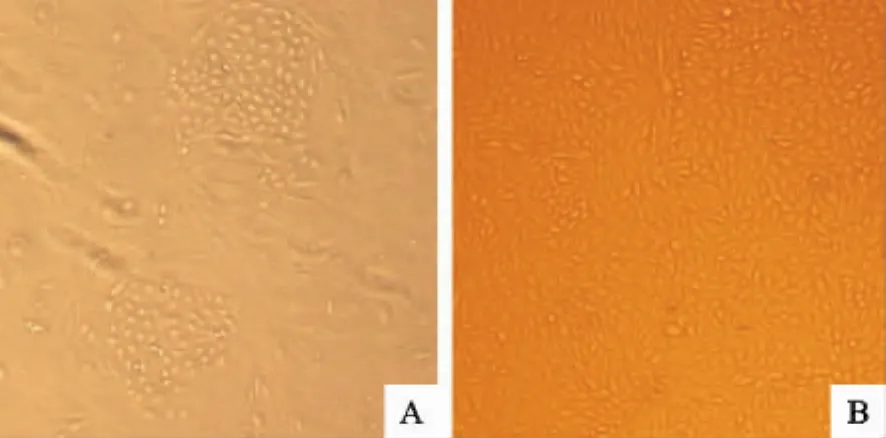
图1 原代的胎羊肾细胞和传代的胎羊肾细胞(10×10)Fig.1 Primary goat embryonic kidney cells and subculture goat embryonic kidney cells(10×10)
2.2 细胞表面受体的检测
间接免疫荧光试验结果显示,胎羊肾细胞在荧光显微镜下呈现明亮的绿色荧光,表明细胞表面有较为丰富的α2,6-Gal和α2,3-Gal受体(图2)。其中α2,6-Gal受体的荧光信号较MDCK细胞组更强烈,提示胎羊肾细胞的α2,6-Gal受体的含量比MDCK细胞更为丰富。未加一抗的细胞对照均无明显的荧光信号。
2.3 病毒增殖情况
胎羊肾细胞在感染流感病毒24h后,开始出现明显的细胞病变,细胞逐渐变圆,脱落。同样处理的MDCK细胞在接毒后40h才出现病变。通过比较5次血凝试验所测得的血凝价发现,胎羊肾细胞培养物的血凝价比MDCK细胞对照的血凝价稍高,具体见表1。
图2 胎羊肾细胞表面流感病毒受体的检测(40×10)Fig.2 Detection of influenza virus receptors on the surface of goat embryonic kidney cells(40×10)

表1 流感病毒血凝价的测定Table1 Determination of hemagglutination titers of influenza virus
通过测定不同代次胎羊肾细胞病毒培养物的血凝价发现,细胞传代没有对病毒的增殖造成明显的影响,10代细胞培养物的血凝价稳定在29以上(图3)。
图3 流感病毒在不同代次胎羊肾细胞培养物中的血凝价Fig.3 Hemagglutination titers influenza virus in different generations of goat embryonic kidney cell culture
3 讨论
根据细胞对不同病毒易感性的差异,人们可选择合适的细胞用于不同病毒的培养和疫苗生产。在体外培养中,较容易获得成功的是幼年动物的肾组织上皮细胞。比如猪肾细胞 (PK-15)、乳仓鼠肾细胞(BHK-21)、MDCK细胞和 Vero细胞等,均源于动物的肾脏组织。本研究选取胎羊的肾上皮细胞作为研究对象,研究其用于流感病毒增殖的可能性。初步的研究结果表明,该细胞可进行体外传代培养,且能用于流感病毒的增殖,具有很好的应用前景。
本研究结果表明,贴壁培养的胎羊肾细胞含有上皮细胞和成纤维细胞。利用成纤维细胞贴壁较快的特点,对原代细胞进行了初步的分离纯化,最终得到了较典型的上皮样细胞。原代的肾上皮细胞近似圆粒状,贴壁较浅。传代培养后,细胞的形态发生改变,逐渐变为多角形,生长速度有所加快。这说明胎羊肾细胞能适应体外培养环境,且具有稳定增殖的能力。
一种细胞是否对某种病毒易感,与该细胞表面的受体差异有很大的关系[8]。研究胎羊肾细胞表面的流感病毒受体,可直接证明该细胞用于增殖流感病毒的潜能。流感病毒的受体主要有α2,3-Gal和α2,6-Gal两种[9],受体表达的丰度将直接影响到病毒的复制效率。间接免疫荧光结果显示,胎羊肾细胞表面的流感病毒受体,特别是α2,6-Gal受体,含量明显高于流感病毒研究中最常用的MDCK细胞,这可能是用本细胞培养的流感病毒血凝价高于MDCK细胞的原因之一。病毒增殖试验进一步证实该细胞能用于培养流感病毒,且细胞的传代培养对病毒的增殖没有造成明显的影响。当然,本研究仅用了H1N1亚型流感病毒,是否所有A型流感病毒都能在该细胞内大量增殖还有待研究。
目前用于增殖流感病毒的细胞主要是MDCK细胞和Vero细胞,但这两种细胞表面的病毒受体表达丰度并不高[10],导致细胞对病毒的敏感性偏低。本研究所获得的胎羊肾细胞兼具敏感性高和产毒量大的特点,如果能将该细胞驯化成传代细胞,则有望开发成一种新的流感疫苗生产用细胞系。此外,该细胞感染流感病毒后,病变较快,可及时得知接毒是否成功,这对病毒分离和培养非常有利。
[1]杨 琴,张兴晓,杨灵芝.3种细胞培养流感病毒的比较[J].动物医学进展,2009,30(11):76-79.
[2]Perdue M L,Arnold F,Li S,et al.The future of cell culturebased influenza vaccine productions[J].Expert Rev Vaccines,2011,10(8):1183-1194.
[3]吕宏亮,付秀华,郑 明.传代细胞制备流感病毒疫苗工艺研究进展[J].中国兽药杂志,2009,43(6):43-48.
[4]薛庆善.体外培养的原理与技术[M].北京:科学出版社,2001:57-71.
[5]Lash L H,Putt D A,Hueni S E,et al.Molecular markers of trichloroethylene-induced toxicity in human kidney cells[J].Toxicol Appl Pharm,2005,206:157-168.
[6]周 峰,杜贤进,董长垣,等.原代肾上皮细胞改良培养方法[J].中国组织工程研究与临床康复,2009,13(11):2101-2103.
[7]郭元吉,程小雯.流行性感冒病毒及其实验技术[M].北京:三峡出版社,1997:64-69.
[8]李明远.病毒感染与病毒受体[J].病毒学杂志,1989,3:219-226.
[9]Govorkova E A,Murti G,Meignier B,et al.African green monkey kidney(Vero)cells provide an alternative host cell system for influenza A and B viruses[J].J Virol,1996,70(8):5519-5524.
[10]姚志东,张良艳,刘 坤,等.甲型H1N1流感病毒疫苗株高适应性MDCK细胞的筛选及鉴定[J].免疫学杂志,2011,27(3):189-192.

