姜黄素通过内质网应激途径诱导宫颈癌HeLa细胞凋亡的实验研究*
姜黄素(Curcumin)提纯自中药姜黄(Curcuma longa L.)的根茎,属于酚性色素,其化学名为阿魏酰甲烷(Difcruloylmethane)。中医认为姜黄具有祛风活血以及通络止痛等功效。从20世纪80年代至今,大量研究表明,姜黄素具有较强的抗肿瘤活性,可诱导肿瘤细胞凋亡[1-2]。近年研究表明,内质网应激(Endoplasmic Reticulum Stress,ERS)是有别于线粒体途径及死亡受体途径的可诱导细胞凋亡的独立通路。本研究采用姜黄素对宫颈癌HeLa细胞进行干预,探讨姜黄素是否能够通过ERS途径诱导HeLa细胞凋亡,为姜黄素的临床应用提供新的依据。
材料与方法
1 材 料 宫颈癌细胞株HeLa购自中国科学院细胞库;四甲基偶氮唑蓝(MTT)、姜黄素(C21H20O6,纯度≥98%)、ERS抑制剂4-苯基丁酸钠(4-PBA)购自美国Sigma-Aldrich公司;DMEM细胞培养基以及胎牛血清(FBS)购自美国Hyclone公司;Trizol总RNA提取试剂盒购自美国Invitrogen公司;Prime-Script RT Master Mix试剂盒以及SYBR Premix Ex TaqTMII试剂盒购自日本Takara公司;葡萄糖调节蛋白78(GRP78),C/EBP同源蛋白质(CHOP)以及β-Actin引物均由日本Takara公司合成;GRP78及CHOP抗体均购自美国Cell Signaling Technology公司;β-Actin抗体及辣根过氧化物酶标记二抗均购自美国Santa Cruz公司。
2 宫颈癌HeLa细胞培养 向DMEM培养基中加入10%FBS、0.1U/L链霉素以及0.1U/L青霉素制成细胞培养液对HeLa细胞进行培养。培养条件为37℃、饱和湿度以及5%CO2环境,隔天更换细胞培养液,细胞密度为80%以上时按照1∶3的比例对细胞进行传代,取处于对数生长期的HeLa细胞进行进一步试验。
3 MTT法检测姜黄素对HeLa细胞增殖的抑制作用 将HeLa细胞制成浓度为1×105/ml的细胞悬液,将该细胞悬液加入96孔板(GREINER,德国),共设6个平行孔,每孔加入100μl细胞悬液。6个平行孔中加入的姜黄素溶液(均由DMEM培养基配制)浓度分 别 为 0μmol/L(阴 性 对 照)、3.125μmol/L、6.25μmol/L、12.5μmol/L、25μmol/L 以及50μmol/L。干预48h后,向每孔中加入浓度为5mg/ml的 MTT溶液20μl继续培养4h,弃去上清液后加入二甲基亚砜(DMSO)150μl,充分震荡后,使用酶标仪测定波长为570nm处的吸光度值(A值)。采用以下公式对细胞生长抑制率进行计算:细胞生长抑制率=(1-样本平均A值/阴性对照平均A值)×100%。
4 试验分组 本研究中将细胞样本共分为对照组(Ctrl)、对照+4-PBA组(Ctrl+PBA)、姜黄素组(Cur)以及姜黄素+4-PBA组(Cur+PBA)。姜黄素浓度为下文MTT法中筛选出的姜黄素最适浓度;根据Kubota等 的 研 究[3],选 择 3mmol/L 作 为 4-PBA 溶 液 (由DMEM细胞培养基溶解)的干预浓度。
5 流式细胞仪测定宫颈癌HeLa细胞凋亡 将各组样本细胞分别离心,采用含0.2%FBS的磷酸盐缓冲液(PBS)对细胞进行洗涤后加入70%乙醇溶液中固定,将各组样本细胞悬液浓度调整为1×106/ml后先后采用Anexin V及PI(BD,美国)进行双染,流式细胞仪(FACSCalibur,BD,美国)检测荧光强度后进行分析。
6 Real-time PCR 收集细胞样本后,采用 Trizol法提取总Mrna,紫外分光光度计检测纯度,琼脂糖凝胶电泳检测完整性后,采用PrimeScript RT Master Mix试剂盒进行逆转录合成cDNA,并以该cDNA为模板采用SYBR Premix Ex TaqTMII试剂盒进行Real-time PCR。GRP78、CHOP及β-Actin的引物序列[4]详见表1。扩增条件如下:94℃预变性5min,94℃变性30s,56℃退火30s,再以72℃延伸45s,共进行25个循环,最后再以72℃延伸10min。上述试剂盒使用均严格按照厂家说明书进行。以β-Actin mRNA表达水平作为内参,Bio-Rad IQ5(Bio-Rad,美国)软件对所得数据进行分析。
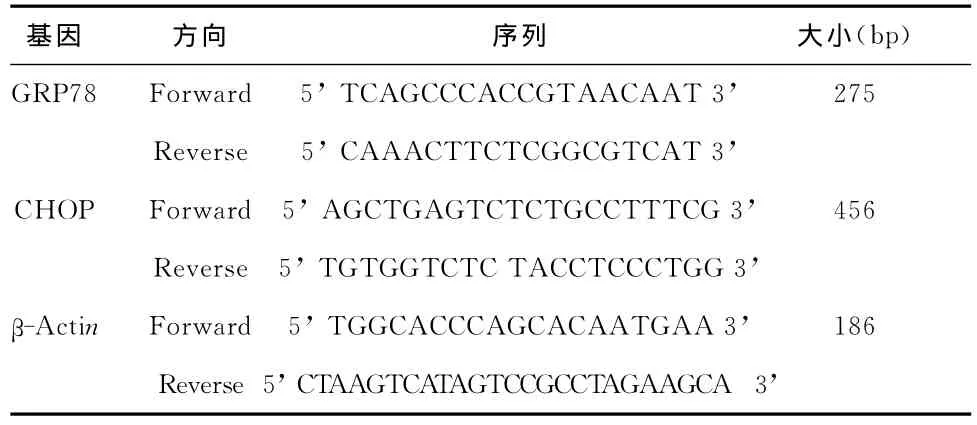
表1 Real-time PCR引物序列
7 Western Blotting 将样本细胞离心,PBS洗涤2次,采用加入PMSF(Santa Cruz,美国)RIPA裂解缓冲液(Santa Cruz,美国)对细胞进行处理,采用BCA法对获得的蛋白浓度进行测定后,加入等量1×SDSPAGE loading buffer,100℃ 变 性 5min 后 进 行 SDSPAGE垂直电泳,电转至PVDF膜上,10%脱脂牛奶封闭1h,一抗孵育过夜,充分洗涤后加入二抗(1∶5000)孵育2h,充分洗涤后,采用Super Signal West Pico化学荧光发光试剂盒(Thermo,美国)对所检测蛋白进行显影,X胶片曝光后,以β-Actin作为内参,采用Image-Pro Plus(Version 5.0.2)软件对结果进行分析。
8 统计学处理 本研究所得数据均采用(均数±标准差)表示,数据均录入Excel并采用统计学软件SPSS 17.0进行分析处理,统计方法为单因素方差分析,均以P<0.05为差异具有统计学意义。
结 果
1 MTT法检测姜黄素对HeLa细胞的生长抑制率与姜黄素干预浓度确定 阴性对照HeLa细胞生长活跃,分 别 采 用 3.125μmol/L、6.25μmol/L、12.5μmol/L、25μmol/L以及50μmol/L浓度的姜黄素溶液对HeLa细胞干预48h后,细胞生长均受到不同程度的抑制,并呈现出浓度依赖性,与阴性对照相比具有统计学意义(P<0.05)。本研究选取25μmol/L作为后续试验中姜黄素的干预浓度。见表2。
2 姜黄素对各组HeLa细胞凋亡的影响 在流式细胞分析图上,正常细胞处于Q3区,早期凋亡细胞处于Q4区,晚期凋亡细胞/坏死细胞处于Q2区,细胞碎片则处于Q1区。处于(Q2+Q4)区的细胞占细胞总数的百分比即为细胞凋亡诱导率。本研究发现,Ctrl组、Ctrl+PBA组、Cur组以及Cur+PBA组凋亡诱导率分别为4.15%、5.22%、68.37%以及49.28%。与Ctrl及Ctrl+PBA组相比,Cur组HeLa细胞凋亡诱导率显著升高(P<0.05);与Cur组相比,Cur+PBA组HeLa细胞凋亡率显著降低(P<0.05)。见图1。

图1 流式细胞术检测各组HeLa细胞凋亡情况比较
3 姜黄素对各组HeLa细胞GRP78及CHOP mRNA表达的影响 本研究发现,与Ctrl组及Ctrl+PBA组相比,Cur组GRP78及CHOP mRNA表达水平均显著升高(P<0.05);与Cur组相比,Cur+PBA组GRP78及CHOP mRNA表达水平均显著降低(P<0.05)。见图2。
4 姜黄素对各组HeLa细胞GRP78及CHOP蛋白表达水平的影响 本研究发现,与Ctrl组及Ctrl+PBA组相比,Cur组GRP78及CHOP蛋白表达水平均显著升高(P<0.05);与Cur组相比,Cur+PBA组GRP78及CHOP蛋白表达水平均显著降低(P<0.05)。见图3。

表2 不同浓度姜黄素溶液对HeLa细胞生长抑制的情况(48h)

图2 姜黄素对各组HeLa细胞GRP78及CHOP mRNA水平的影响

图3 姜黄素对各组HeLa细胞GRP78及CHOP蛋白表达水平的影响
讨 论
作为发病率仅次于乳腺癌的第二大女性恶性肿瘤,宫颈癌对女性健康危害极大。目前,对于早期宫颈癌,临床治疗以手术切除为主,而对于中晚期患者,化学治疗等药物治疗则成为主要治疗方式。虽具有较强的抗肿瘤活性,但化学治疗药物具有细胞毒性大、不良反应多等缺点,因此具有高效低毒特点的抗肿瘤药物具有广阔的应用前景。姜黄素为中药姜黄的主要有效成分,研究表明除具有抗炎、抗脂质过氧化、降血压以及抗纤维化等药理活性外[5],近年越来越多的研究表明,姜黄素还具有显著的抗肿瘤活性,对人肝癌细胞SMMC7721、乳腺癌、人类白血病细胞 HL-60以及人舌癌细胞Tca8113等细胞系均具有显著的抑制作用,能够诱导肿瘤细胞出现显著的凋亡[6]。
细胞凋亡又称为程序性细胞死亡,是有别于细胞坏死的细胞死亡方式。诱导肿瘤细胞凋亡是多种化疗药物的共同作用机制,可以作为药物抗肿瘤能力的衡量标准之一。已经有研究证实,姜黄素不但能抑制宫颈癌细胞系Siha在体内、外的增殖,而且姜黄素能够诱导宫颈癌细胞系HeLa、SiHa、CaSki以及C33A发生明显凋亡[7-8]。本研究通过 MTT法及流式细胞术证实,姜黄素不但对宫颈癌细胞系HeLa增殖具有显著的抑制作用,而且能够诱导其发生凋亡,这与既往文献报道一致。
一般认为,内、外因素能够通过线粒体途径、死亡受体途径以及ERS途径诱导细胞凋亡。ER是重要的细胞器,是新生蛋白质合成与加工的重要场所,对维持细胞内环境稳定与正常功能具有关键作用。在不良信号的刺激下,内质网所发生的钙离子平衡失调以及未折叠蛋白反应(UPR)等,称为ERS[9]。严重而持续的ERS可直接导致细胞凋亡的发生。作为定位于内质网内的折叠伴侣蛋白,GRP78被认为是ERS发生的主要分子标志之一[10]。ERS发生可最终导致转录因子CHOP的活化,作为ERS诱导凋亡信号通路下游的关键分子,表达增高的CHOP不仅可抑制抗凋亡蛋白BCL-2的表达,而且能够促进促凋亡蛋白BAX/BAK的表达,最终诱发Caspase分子级联反应,DNA内切酶PARP活化,后者使细胞核内的DNA降解,细胞发生凋亡[11]。4-PBA属于低分子量游离脂肪酸的一种,是一种用于治疗鸟氨酸循环障碍疾病的经典药物。新近研究表明,作为一种化学伴侣,4-PBA对ERS可起到抑制作用[12]。
本研究发现,使用姜黄素处理HeLa细胞后,在发生增殖抑制及细胞凋亡的同时,HeLa细胞内GRP78及CHOP在转录水平及翻译水平表达增高,提示姜黄素可通过内质网应激途径诱导HeLa细胞凋亡。本研究进一步发现,在使用姜黄素对HeLa细胞进行干预后,使用ERS抑制剂4-PBA能够显著降低HeLa细胞的凋亡率,同时HeLa细胞内内质网应激标志物GRP78与凋亡诱导分子CHOP的mRNA及蛋白表达水平均被显著抑制,该结果进一步说明姜黄素能够通过激活ERS相关通路诱导宫颈癌HeLa细胞凋亡。
[1] 朱 青,张王刚,刘苏虎,等.姜黄素诱导肿瘤细胞凋亡的实验研究[J].陕西医学杂志,2005,34(10):1185-1186,1192.
[2] Anand P,Sundaram C,Jhurani S,et al.Curcumin and cancer:an“old-age”disease with an“age-old”solution[J].Cancer Lett,2008,267(1):133-164.
[3] Kubota K,Niinuma Y,Kaneko M,et al.Suppressive effects of 4-phenylbutyrate on the aggregation of Pael receptors and endoplasmic reticulum stress[J].J Neurochem,2006,97(5):1259-1268.
[4] Chen J,Wei H,Xie B,et al.Endoplasmic reticulum stress contributes to arsenic trioxide-induced apoptosis in drugsensitive and-resistant leukemia cells[J].Leuk Res,2012,36(12):1526-1535.
[5] Kuo JJ,Chang HH,Tsai TH,et al.Positive effect of cur-cumin on inflammation and mitochondrial dysfunction in obese mice with liver steatosis[J].Int J Mol Med,2012,30(3):673-679.
[6] Masuelli L,Benvenuto M,Fantini M,et al.Curcumin induces apoptosis in breast cancer cell lines and delays the growth of mammary tumors in neu transgenic mice[J].J Biol Regul Homeost Agents,2013,27(1):105-119.
[7] Singh M,Singh N.Curcumin counteracts the proliferative effect of estradiol and induces apoptosis in cervical cancer cells[J].Mol Cell Biochem,2011,347(1-2):1-11.
[8] 邓怀慈,韩苏夏,陈 谦.姜黄素对人宫颈癌Hela细胞放射敏感性影响的实验研究[J].陕西医学杂志,2004,33(5):393-394.
[9] Cao SS,Kaufman RJ.Targeting endoplasmic reticulum stress in metabolic disease[J].Expert Opin Ther Targets,2013,17(4):437-448.
[10] Xu YY,You YW,Ren XH,et al.Endoplasmic reticulum stress-mediated signaling pathway of gastric cancer apoptosis[J].Hepatogastroenterology,2012,59(120):2377-2384.
[11] Guo FJ,Liu Y,Zhou J.XBP1Sprotects cells from ER stress-induced apoptosis through Erk1/2signaling pathway involving CHOP[J].Histochem Cell Biol,2012,138(3):447-460.
[12] Kim DS,Li B,Rhew KY,et al.The regulatory mechanism of 4-phenylbutyric acid against ER stress-induced autophagy in human gingival fibroblasts[J].Arch Pharm Res,2012,35(7):1269-1278.

