大鼠脊髓挤压伤后硫酸软骨素蛋白多糖NG2在时间和空间的变化*
中枢神经系统损伤后,星形胶质细胞(AST)活化,活化的AST又激活其它胶质细胞一起形成胶质瘢痕,以前认为胶质瘢痕以物理方式阻碍神经细胞和轴突的再生,进一步的研究发现硫酸软骨素蛋白多糖(CSPGs)是瘢痕中最重要的再生抑制物之一。脊髓损伤早期神经再生失败的可能原因有Nogo-A、MAG及OMgp等的影响,最终诱导生长锥塌陷,抑制轴突再生。而CSPGs是神经胶质瘢痕中最重要的再生抑制物,应用硫酸软骨素酶(Chondroitinase ABC)直接中和CSPGs被认为是最有希望的再生治疗策略。CSPGs是一类细胞外基质分子,主要由星行胶质细胞(AST)产生。脊髓损伤局部通过免疫沉淀或原位杂交方法显示CSPGs高表达,而且CSPGs沉积部位正是轴突停止再生的部位[1];其次是体外多种CSPGs分子对轴突生长的抑制作用。研究表明蛋白多糖是中枢神经系统细胞外基质的主要成分,每个神经元周围基质中硫酸软骨素蛋白多糖的含量不同,提示它是调节神经元微环境的关键因素[2]。以上这些实验都说明CSPGs是一种抑制中枢神经轴突生长的物质。CS-56的表达反映着NG2(神经元胶原抗原2,neuron-glial antigen 2)的水平,NG2是CSPGs的主要成分,因此也就是反映着CSPGs的抑制水平。CSPGs成员众多,迄今已发现有30多种,按照蛋白质和糖链组成和连接的不同,可以分为3类,我们选择最主要的成分NG2作为研究对象。观察大鼠脊髓挤压伤后硫酸软骨素蛋白多糖NG2在时间和空间的变化,现报道如下。
材料与方法
1 实验动物 成年雄性Sprague-Dawley大鼠,体重200~230g(西安交通大学实验动物中心提供)(n=6),采用大鼠脊髓挤压伤模型[3],注意大鼠术后护理:每日2次挤尿,保持皮肤干燥,预防褥疮。
2 脊髓坏死面积的测量 选取包含脊髓损伤中心在内的矢状位HE切片,在OlympusBX-60光学显微镜(Olympus,日本)的明视野下,经4倍镜对损伤区组织进行观察并采集数字化图象,在Camera lucida(Opton,德国)显微描绘器下将同一切片同视野坏死区的轮廓和比例尺放大描绘于A4打印纸上。随后利用Photoshop7.0图象处理软件(Adobe,美国)获得所选区面积的总像素值,计算显微照片的标尺长度,在照片上绘制单位面积,计算机软件读取其面积内的像素值,可获取单位面积的像素值,再乘以单位面积的实际面积,即得到坏死区的实际面积。
3 大鼠脊髓损伤区CS-56免疫荧光染色 应用ABC法进行免疫组织化学染色。切片经空气干燥后,入0.01mol/L的磷酸盐缓冲液(PBS,pH 7.4)清洗30 min,用含1%小牛血清白蛋白和0.3%Triton X-100的抗体稀释液室温下封闭2h,然后加入CS-56抗体(CS-56,1︰1000,Sigma),室温下孵育过夜,切片经PBS清洗后,加入生物素化的的抗山羊IgG(1︰200,Sigma)室温下孵育3h,再经PBS清洗后,置于ABC复合物中(1︰400,Sigma)室温下孵育3h,经PBS清洗后用葡萄糖-葡萄糖氧化酶-硫酸镍铵-DAB加强法进行显色,切片在显色液中孵育15~25min,显色液为100ml 0.1mol/L醋酸盐缓冲液含有70mg DAB、200mg葡萄糖、40mg NH4Cl、3g硫酸镍铵和1mg葡萄糖氧化酶。然后在空气中干燥,梯度酒精脱水,二甲苯透明,DPX封片,O-lympus BX-51显微镜下观察照相。
结 果
1 挤压伤后各时相点坏死区平均面积 见附表。脊髓挤压伤后由于出血,组织坏死等原因坏死区面积逐渐增大,到72h后达到峰值。随后由于出血吸收,坏死区面积趋于稳定。

附表 挤压伤后各时相点坏死区平均面积(mm2)计算结果
2 CS-56和GFAP的关系 CS-56是CSPGs的特异性标记物。脊髓挤压后在损伤部位即可见到CS-56免疫反应增加,CS-56表达于24h内开始升高,分布于星形胶质细胞内。到2周时明显增多,充填于空洞腔内。GFAP于受伤当时主要分布于脊髓损伤的紧靠断端附近,分布比较稀疏;24h后主要分布于损伤区的周围,而损伤的断端逐渐减少;48h后GFAP的“积聚”表达现象最为明显;1周时GFAP的表达达到高峰,而2周时的表达呈明显地下降趋势。CSPGs主要集中表达于损伤中心,GFAP表达阳性产物则逐渐向损伤区域的边缘集中形成星形细胞瘢痕及其界膜,在损伤区内部少见,另可见空洞形成。(见图1、图2、图3)。

图1 挤压伤后损伤区GFAP-CS56染色后的情况
讨 论
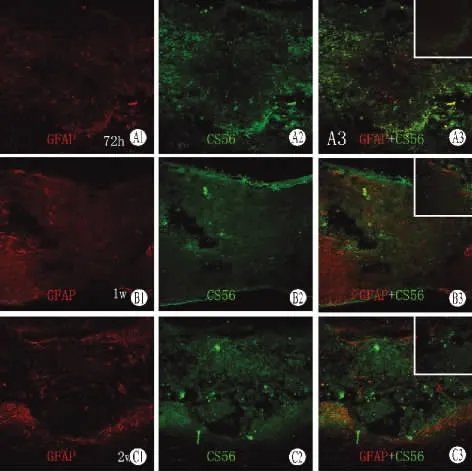
图2 72h后损伤区周围GFAP-CS56表达

图3 损伤2周时GFAP-CS56表达
脊髓损伤(SCI)后再生修复能力有限与受伤时的机械性因素和伤后所产生的化学性因素有关,前者是指伤后局部胶质瘢痕的空间阻碍,机械性损伤因素可认为是脊髓的原发性损伤,对于严重的损伤,这一病理过程是无法控制且不能选择的。而化学性因素所导致的继发性损伤此时就决定着预后情况,但这一过程确实可以通过一系列的治疗措施加以纠正,至少可以阻断病理过程的进一步演进。所以应该把脊髓损伤的治疗重点放在对继发性损伤的控制上来。目前认为,中枢神经系统(CNS)抑制因子对SCI后再生修复有显著的抑制作用,而主要的抑制因子有髓鞘结合分子(Nogo-A)、髓鞘糖蛋白(MAG)和细胞外基质等。硫酸软骨素蛋白多糖(CSPGs)的抑制作用更为明显,故被作为本实验的研究对象。各种CSPGs中,NG2,Versican,Neurocan,Brevican,Phosphacan在SCI后的表达并 不 一 致。Leonard 等[4]认 为,NG2 是 主 要 的CSPGs,其由少突神经胶质细胞前体表达。SCI后CSPGs表现出强大的抑制作用,具体表现为抑制轴突和神经细胞的再生修复[5]。Davies等[6]发现将周围神经系统神经元植入大鼠的脊髓后能够再生,但再生的轴突到达硫酸软骨素蛋白多糖丰富的损伤区后就停滞不前。这表明,硫酸软骨素蛋白多糖对中枢神经系统损伤后的轴突再生有相当的抑制作用。
因此了解脊髓损伤后CSPGs的时空分布变化,有助于理解脊髓损伤后轴突不能再生的机制,根据CSPGs的时程变化可制定针对于CSPGs的治疗,并评估治疗的结果。研究表明神经突起的生长会避开CSPGs,从而CSPGs起到引导突起生长的作用[7-8]。随着星形胶质细胞的反应性增生,胶质瘢痕及损伤区域空洞的形成,损伤区被包裹局限,在损伤中心区域,CSPGs有大量积累,而在离损伤区较远区域表达逐渐降低。
本实验结果显示,NG2在SCI后24h内开始上升,1周达到高峰,后继续维持这种高水平的表达至伤后2周。NG2通常与细胞表面相结合,体外可表达于少突胶质细胞和纤维型星形胶质细胞表面。CSPGs被发现可以抑制层粘连蛋白(Laminin)的促进轴突生长的特性。免疫荧光染色结果显示,CS-56表达于24h内开始升高,3d后CS-56呈环状分布于损伤区周围,GFAP有少量表达。1周时空洞逐渐出现,GFAP的表达集中于损伤的远近端,CS-56的表达逐渐增强,2周时空洞轮廓明显,CS-56充填于空洞腔内,而此时GFAP的表达有所下降。
CS-56的表达反映着NG2的水平,也就是反映着CSPGs的抑制水平。中枢神经系统的细胞基质中,不仅存在着能促进神经元生长、存活和影响可塑性的神经营养因子,还存在着许多抑制神经细胞生存、生长和修复的抑制因子。新近的研究发现细胞外基质中还有对神经元分化、再生过程既有促进作用,又有抑制作用的蛋白多糖,其中CSPGs被认为具有这种作用[7]。而研究CS-56的时间和空间分布对于有针对性脊髓继发性损伤的治疗具有指导作用,比如本实验所显示的在损伤后1周时其表达逐渐开始增强,这就可以确定治疗的时间窗问题。化学性屏障的作用在脊髓损伤的发生机理中占有关键位置,将治疗重点置于此才可能在治疗方法的组合上有新的进展。
[1] Morgenstern DA,Asher RA,Fawcett JW,et al.Chondroitin sulphate proteoglycansm in the CNS injury response[J].Prog Brain Res,2002,137:313-332.
[2] Koppe G,Bruckner G,Hatig W,et al.Characterization of proteoglycan-containing perineuronal nets by enzymatic treatments of rat brain section[J].J Histochem,1997,29(1):11-20.
[3] 祖 波,尹宗生.机械性脊髓损伤模型的建立及其评价[J].中国临床康复,2006,10(12):151-153.
[4] Leonard LJ,Yu Y,William BS,et al.NG2is a major chondroitin sulphate proteoglycan produced after spinal cord injury and is expressed by macrophages and oligodendrocyte progenitors[J].The Journal of Neuroscience,2002,22(7):2792.
[5] Yick LW,Cheng PT,So K,et al.Axonal regeneration of Clarke,s neurons beyond the spinal cord injury scar after treatment with chondroitinase ABC[J].Exp Neurol,2003,182(1):160-168.
[6] Davies SJ,Goucher Dr,Doller C,et al.Robust regeneration of adult sensory axons in degeneration while matter of the adult rat spinal cord[J].J Neurosci,1999,19(4):5810-5822.
[7] Minor K,Tang X,Kahrilas G,et al.Decorin promotes robust axon growth on inhibitory CSPGs and myelin via a direct effect on neurons[J].Neurobiol Dis,2008,32(1):88-95.
[8] Willerth SM,Sakiyama-Elbert SE.Cell therapy for spinal cord regeneration[J].Adv Drug Deliv Rev,2008,60(2):263-276.

