直肠癌凋亡相关蛋白与肿瘤细胞体外化疗药物敏感性的关系
张海峰,李金海,戴华卫,周瑞耀
(温州医学院附属第三医院 普通外科,浙江 温州 325200)
多重耐药性的存在,常导致直肠癌术后化疗失败[1]。通过研究不同细胞株已经证实,多药耐药(MDR)的重要机制之一就是肿瘤细胞对化疗药物产生凋亡抵抗[2-3]。因此,克服肿瘤细胞耐药性,提高抗癌药物疗效已成为肿瘤治疗中亟待解决的关键性问题。本研究旨在检测直肠癌组织Survivin、bcl-2及bax的表达,并探讨其与体外肿瘤细胞化疗药物敏感性的关系。
1 资料和方法
1.1 一般资料 2008年1月至2012年1月间在温州医学院附属第三医院手术且经病理证实的48例直肠癌患者新鲜肿瘤组织标本。其中男27例,女21例,年龄(63.12±13.11)岁。术前均未接受任何治疗。术中分别取新鲜肿瘤组织1.5 cm×1.0 cm×1.0 cm置入双抗培养液行噻唑蓝(MTT)法体外肿瘤细胞化疗药物敏感实验。另每例肿瘤标本经中性甲醛溶液固定,常规石蜡包埋、切片,行免疫组织化学染色。
1.2 免疫组织化学染色测定凋亡相关蛋白Survivin、bcl-2、bax蛋白表达 鼠抗人Survivin、bcl-2、bax多克隆抗体、免疫组织化学试剂盒购自美国eBioscience公司,链霉卵白素-生物素-辣根过氧化物酶复合物(SP)法对肿瘤组织进行上述指标染色,并严格按试剂盒说明书进行。磷酸盐缓冲液(PBS)代替一抗做阴性对照,已知阳性切片作阳性对照。由两位高年资病理医师分别双盲阅片进行结果判读。每张切片随机取5个高倍(×400)视野,每视野计数100个细胞,Survivin、bcl-2、bax以细胞膜及(或)细胞质呈黄色为染色阳性,按着色强度和阳性细胞率分别进行记分。着色强度记分:无着色0分,淡黄色1分,黄色2分,棕黄色3分。阳性细胞率记分标准:阳性细胞≤5%为0分,6%~25%为1分,26%~50%为2分,51%~75%为3分,≥76%为4分;两种记分标准所得分值的乘积为0~1分阴性(-),2~3分弱阳性(+),4~7分阳性(++),≥8分强阳性(+++)。表达强度标准:记分≤3分为弱表达,≥4分为强表达。
1.3 体外药物敏感实验 MTT(Bio Vision公司),DMEM培养基及胰蛋白酶(Pepro Tech公司)。酶标仪DNM-9602A(北京普朗公司),直肠癌组织研磨分散,用细胞分离器调整浓度为5×108/L。使用前将肿瘤药敏检测板和培养基预温至37.0 ℃。9种受试药物分别为:氟尿嘧啶(5-Fu)、长春新碱(VCR)、足叶乙甙(VP-16)、紫杉醇(PTX)、表阿霉素(eADM)、羟基喜树碱(HCPT)、奥沙利铂(L-OHP)、顺铂(DDP)、甲氨蝶呤(MTX),药物终治疗浓度为血浆峰值药物浓度。接种细胞悬液200μL/孔,微量振荡器振荡混匀,置于37.0 ℃、5% CO2饱和湿度的培养箱培养48 h,加MTT(5 g/L)20μL/孔,继续培养24 h,当显微镜下观察到MTT还原形成蓝色针状结晶时终止培养。细胞培养板以1000 r/min离心10 min,弃上清,加入二甲基亚砜(DMSO)100μL/孔,振荡混匀,酶标仪570 nm测各孔吸光度(A)值。肿瘤细胞平均抑制率(IR,%)=(1-给药孔平均A值/对照孔平均A值)×100%。
1.4 统计学处理方法 应用SPPS13.0统计软件分析。凋亡相关蛋白之间的相关分析采用秩相关检验,并计算Spearman相关系数,药物抑制率以±s表示,采用t检验。以P<0.05为差异有统计学意义。
2 结果
2.1 直肠癌Survivin、bcl-2、bax表达 48例直肠癌Survivin、bcl-2、bax强阳性表达率分别为72.9%(35/48)、35.4%(17/48)、47.9%(23/48),详见表1。3种蛋白表达之间的关系:Survivin与bax间表达强度呈负相关(r=-0.37112,P<0.01),bcl-2与bax间表达强度亦呈负相关(r=-0.37112,P<0.01)。
2.2 直肠癌Survivin、bcl-2、bax表达与化疗药物敏感性之间的关系 Survivin强表达时,eADM、DDP对肿瘤细胞的抑制率分别明显降低(t=2.464,P<0.05;t=2.118,P<0.05),但L-OHP对肿瘤细胞的抑制率则明显增加(t=-2.079,P<0.05);bcl-2强表达组的5-Fu、PTX、eADM对肿瘤细胞的抑制率明显低于弱表达组(t=2.588,P<0.05;t=2.316,P<0.05;t=2.139,P<0.05);bax强表达组中,5-Fu、eADM、L-OHP和MTX对肿瘤细胞的抑制率明显高于弱表达组(t=-3.289,P<0.01;t=-2.365,P<0.05;t=-2.112,P<0.05),见表1。
3 讨论
早期直肠癌治疗效果好,但晚期直肠癌缺乏特别有效的治疗方法,目前主要以全身化疗为主[4]。由于对化疗药物MDR的存在,直肠癌在施行根治性手术和辅助化疗后,发生转移率仍较高[5]。研究[6-8]证实,5-Fu、VCR、VP-16等多种临床常用化疗药物均可通过干扰核酸的合成或(和)诱导细胞凋亡而发挥抑制肿瘤的作用。最近研究表明,凋亡是化疗药物发挥化疗药物毒性的最初作用形式,而抑制凋亡信号途径是化疗药物发生耐药的机制之一[9]。在当今研究的凋亡蛋白中,Survivin与bcl-2与直肠癌细胞凋亡关系较为密切,通过对半胱氨酸天冬氨酸特异性蛋白酶(caspase)的抑制,Survivin可阻止细胞的凋亡,致使MDR发生[6]。另外,bcl-2蛋白家族可以调节线粒体外膜的稳定性,抑制线粒体途径诱导的细胞凋亡,从而导致MDR。本研究所选的9种受试化疗药物中,直肠癌细胞对5-Fu、PTX、eADM、L-OHP及DDP的耐药与Survivin、bcl-2过表达相关:Survivin高表达时肿瘤与eADM、L-OHP、DDP耐药相关;bcl-2高表达时与5-FU、PTX、eADM耐药相关。本研究证实了Survivin、bcl-2表达与部分化疗药物敏感性相关,也证实Survivin、bcl-2可能通过作用于凋亡通路的不同靶点,从而抑制药物引起的细胞凋亡。
表1 直肠癌组织Survivin、bcl-2、bax表达与化疗药物抑制率之间的关系(±s,%)
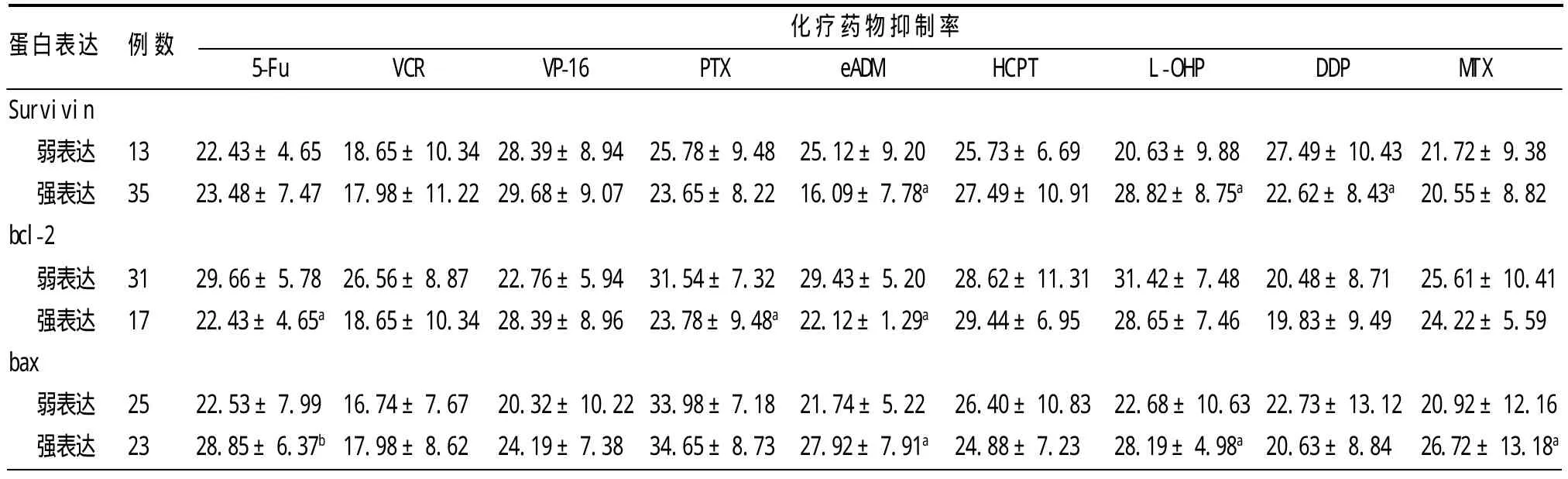
表1 直肠癌组织Survivin、bcl-2、bax表达与化疗药物抑制率之间的关系(±s,%)
与各自的弱表达组比:aP<0.05,bP<0.01
蛋白表达例数化疗药物抑制率HCPT L-OHP DDP MTX 5-Fu VCR VP-16 PTX eADM Survivin弱表达 13 22.43±4.6518.65±10.3428.39±8.9425.78±9.4825.12±9.20强表达 35 23.48±7.4717.98±11.2229.68±9.0723.65±8.2216.09±7.78a bcl-2弱表达 31 29.66±5.7826.56±8.8722.76±5.9431.54±7.3229.43±5.20强表达 17 22.43±4.65a18.65±10.3428.39±8.9623.78±9.48a22.12±1.29a bax弱表达 25 22.53±7.9916.74±7.6720.32±10.2233.98±7.1821.74±5.22强表达 23 28.85±6.37b17.98±8.6224.19±7.3834.65±8.7327.92±7.91a 25.73±6.6920.63±9.8827.49±10.4321.72±9.38 27.49±10.9128.82±8.75a22.62±8.43a20.55±8.82 28.62±11.3131.42±7.4820.48±8.7125.61±10.41 29.44±6.9528.65±7.4619.83±9.4924.22±5.59 26.40±10.8322.68±10.6322.73±13.1220.92±12.16 24.88±7.2328.19±4.98a20.63±8.8426.72±13.18a
bcl-2和bax基因是与细胞凋亡关系最为密切的凋亡基因,二者具有同源性,bcl-2是凋亡抑制基因,bax是促凋亡基因[10]。本研究结果显示,直肠癌组织中bax与Survivin表达呈负相关,可能与二者有着共同的作用通路,有拮抗作用有关[11]。本研究还证实了,bax强表达时5-Fu、eADM、L-OHP、MTX 4种药物对直肠癌的抑制率增强,其中eADM对肿瘤的抑制与Survivin、bcl-2、bax这3种蛋白均无关,说明这3种蛋白可能通过共同的作用机制致使肿瘤对eADM耐药。本研究通过检测直肠癌组织中Survivin、bcl-2、bax表达情况并分析与化疗药物抑制率之间的关系,阐明了某些化疗药物的耐药性可能与相关凋亡蛋白的过表达有关,这为以后阐明抗癌药物的耐药具体机制奠定了基础,也为以后提高抗癌药物的疗效并制定合理的抗癌对策提供了新的方向与思路。
[1] Tomita M, Kuboi K, Kameyama N, et al. Effective cetuximab monotherapy for a case of recurrence rectal cancer after multiple previous chemotherapy treatment(FOLFOX,FOLFIRI)[J]. Gan To Kagaku Ryoho, 2011, 38(1):121-124.
[2] Sun Y, Dai M, Hao H, et al. The role of RamA on the development of ciprofloxacin resistance in Salmonella enterica serovar Typhimurium[J]. PLoS One, 2011, 6(8):e23471.
[3] Narchi H, Al-Hamdani M. Uropathogen resistance to antibiotic prophylaxis in urinary tract infections[J]. Microb Drug Resist, 2010, 16(2):151-154.
[4] 周璇, 卢敏, 吴瀛达. 奥沙利铂联合希罗达治疗晚期结直肠癌的临床观察[J]. 温州医学院学报, 2010, 40(3):282-283.
[5] Comerford KM, Wallaee TJ, Karhausen J, et al. Hypoxiainducible factor 1 dependent regulation of the multidrug resistance(MDRI)gene[J]. Cancer Res, 2002, 62(5):3387-3394.
[6] Hayashi R, Ishii Y, Ochiai H, et al. Suppression of heat shock protein 27 expression promotes 5-fluorouracil sensitivity in colon cancer cells in a xenograft model[J]. Oncol Rep, 2012, 25(10):1935-1941.
[7] Alimoradi H, Pourmohammadi N, Mehr SE, et al. Effects of lithium on peripheral neuropathy induced by vincristine in rats[J]. Acta Med Iran, 2012, 50(6):373-379.
[8] Martin ST, Heneghan HM, et al. Systematic review and meta-analysis of outcomes following pathological complete response to neoadjuvant chemoradiotherapy for rectal cancer[J]. Br J Surg, 2012, 99(7):918-928.
[9] Nair RG, Bensadoun RJ, Oberholzer T, et al. An unusual case of foreskin phimosis after radiotherapy for rectal carcinoma[J]. Cancer Radiother, 2012, 19(7):474-452.
[10]Ye QF, Zhang YC, Peng XQ, et al. Silencing Notch-1 induces apoptosis and increases the chemosensitivity of prostate cancer cells to docetaxel through Bcl-2 and Bax[J].Oncol Lett, 2012, 3(4):879-884.
[11]Huerta S, Hrom J, Gao X, et al. Tissue microarray constructs to predict a response to chemoradiation in rectal cancer[J].Dig Liver Dis, 2010, 42(10):679-684.

