腹腔镜十二指肠乳头肿瘤局部切除术(附2例报告)*
许 军 赵 磊 关英辉 刘春富
(哈尔滨医科大学附属第四医院普外科,哈尔滨 150001)
十二指肠乳头肿瘤以往多采用胰十二指肠切除术治疗,但手术创伤大,并发症发生率较高[1,2]。对于十二指肠乳头良性、良恶交界性及早期的恶性肿瘤,学者们认为局部切除是可行的[3,4]。随着腹腔镜技术的发展和其在复杂手术中应用经验的不断积累[5,6],腹腔镜十二指肠乳头部肿瘤局部切除已成为可能。目前,国外此方面报道少见[7]。我院2010年9月和2012年6月完成2例完全腹腔镜下十二指肠乳头肿瘤局部切除术,报道如下。
1 临床资料与方法
1.1 一般资料
病例1,女,61岁,间断腹痛、呕吐、发热伴寒战2个月入院。腹部彩超示:肝内外胆管扩张、胆囊增大、胰管轻度扩张。CT、MRCP证实十二指肠乳头肿瘤,直径2.5cm(图1);胆总管无增宽。内镜活检诊断为十二指肠乳头绒毛状腺瘤。CA19925 U/ml(我院正常值:0~27 U/ml),CEA 3.4 ng/ml(我院正常值:0~3.5 ng/ml)。
病例2,男,60岁,皮肤巩膜黄染7 d入院。总胆红素230μmol/L。CT、MRCP证实:肝内外胆管及胰管扩张,十二指肠乳头肿瘤,直径3.0cm。内镜活检诊断轻~中度不典型增生。内镜超声(endoscopic ultrasound,EUS)示:肿物内部透声均匀,肠壁浆膜完整,再次活检诊断为重度不典型增生(图2)。CA199273 U/ml。
病例选择标准与开腹手术相同:肿瘤直径>2.0cm的十二指肠乳头良性、良恶交界性肿瘤;早期恶性肿瘤(Tis和T1期)以及行胰十二指肠切除术风险较高需要姑息治疗的病例。
1.2 方法
全麻。平卧分腿位,术者位于患者两腿之间。trocar位置见图3。建立 CO2气腹,腹压11~13mm Hg(1mm Hg=0.133 kPa)。首先,应用超声刀做Kocher切口,游离十二指肠降段、球部及水平部,并游离部分胰头部,用纱布将十二指肠托起。于十二指肠前壁略偏下用超声刀纵行切开约1.0cm切口,探查肠腔,依据肿物位置(图4)向上或向下延伸切口至3.0~4.0cm,使整个切口呈似“∫”形并偏向肿瘤下方。距肿瘤上下边缘约1.0cm肠壁各缝1针用于牵引,超声刀自下而上切除肿物及其周围1.0cm十二指肠黏膜及黏膜下层组织。胰胆管内分别插管确定(图5,6),边切除边行胆胰管与十二指肠黏膜缝合。重建胆肠和胰肠通道均用可吸收线缝合。肿瘤标本(图7)送术中冰冻病理检查。胰管内放置支撑管并用可吸收线固定(图8),双层缝合十二指肠壁切口。
2 结果
病例1手术时间195 min,出血量220 ml,术中未输血。术后48 h排气、72 h进食。术后13 d复查MRCP胰管中引流管通畅(图9),无并发症发生。术后病理:十二指肠乳头绒毛管状腺瘤,伴重度不典型增生,基底部切缘阴性。随访30个月,未见复发。病例2手术时间300 min,出血量400 ml。术中冰冻病理为腺癌,患者家属拒绝扩大切除。术后72 h排气。术后病理:十二指肠乳头腺癌伴黏液细胞癌,基底部切缘阴性(图10)。术后随访6个月出现肝转移。
3 讨论
近年来,十二指肠乳头肿瘤局部切除术已应用于直径适宜的十二指肠乳头良性、良恶交界性和早期恶性肿瘤(Tis和T1期)以及胰十二指肠切除术风险较高或患者全身状态较差时的姑息治疗[8~10]。切除方式有3种:开腹经十二指肠乳头切除术(transduodenal papillectomy,TDP)、内镜十二指肠乳头切除术(endoscopic papillectomy,ESP)和腹腔镜下经十二指肠乳头切除术(laparoscopic transduodenal papillectomy,LTDP)。TDP可切除直径最大 3.0~4.0cm 肿瘤[11,12];ESP 仅可用于直径 <2cm良性肿物[3,13];LTDP 目前仅见 3 例报道[7,14],切除肿物直径2.0~3.0cm。本组2 例肿物直径均>2.0cm,选择LTDP较为合适。病例2术前2次内镜活检结果与术中及术后病理的腺癌诊断不符,可能是由于活检取材限于肿瘤边缘未取到癌灶所致。Posner等[15]报道术前活检假阴性率可达25%~60%,这也提示我们术前内镜活检存在一定偏差,应行术中冰冻病理检查确定肿瘤性质。病例2术后6个月出现转移可能由于手术刺激促进肿瘤转移,也可能术前即存在微小转移灶并未在影像检查中显影等原因所致。由于病例2术中冰冻病理为腺癌,我们在局部切除中适当增加了切除范围,因此,手术时间较病例1延长、出血量也较多。
本组2例术中体会如下。①将主操作孔置于剑突与脐部连线中点略偏右位置,副操作孔与主操作孔平行,位于右锁骨中线上,这样形成一定的操作角度同时兼顾范围也较大。②不同于胰十二指肠切除术等切除范围较大的术式,可选择多种重建方式,局部切除只能进行类似于肠壁修补的重建方式。首先,十二指肠壁切口位置的选择,既要考虑接下来的吻合是否方便又要兼顾吻合口漏和吻合口狭窄等问题。因此,先在肿瘤偏下肠壁做一纵行小切口,便于腹腔镜视角由下至上确定肿瘤具体位置。再延伸此切口为一长约3.0~4.0cm似“∫”形纵行切口,使肿瘤位于切口的上1/3,同样便于腹腔镜由下而上的视角及操作。其次,纵行切口较横行切口显露范围大,而且似“∫”形切口使肠壁愈合瘢痕分散在不同轴面,不易造成肠腔环形狭窄。只要保证肿瘤定位和切除不受限制,肠壁切口可以尽量缩小。另外,术中应用超声刀切开肠壁,避免电钩较大的热辐射范围导致肠壁血运不佳而增加肠漏的发生。③切除肿瘤时提拉肠壁并保持一定张力,便于切开后调整切除的深度。④确定胰管和胆总管后,将肠壁与管道壁间断缝合2~3针。这样既可作为重要管道的标记,又可使切除层次把握更佳,重建确切。腹腔镜下缝合时应注意调整针距,因为其放大作用很可能将本来细小的针距放大数倍,若不注意调整会使缝合过于紧密,影响肠壁血运。⑤本组2例胆总管均轻度扩张,术中未留置支撑管;胰管内均应用可吸收线固定支撑管并将胰液引流入十二指肠腔内。为避免术后胰胆管流出道不畅并发胰腺炎及胆道狭窄,文献[13]报道采用放置鼻胆管引流、胆胰管支架等多种方式。我们认为这些处理方法均可以应用在LTDP手术中并达到相同的效果。
腹腔镜十二指肠乳头肿瘤局部切除术较其他方式的优势在于,当术中切破肠道全层时,LTDP可根据情况进行缝合,这是ESP做不到的。当术中冰冻病理结果为恶性肿瘤时,LTDP可随时扩大切除范围或中转为根治性的开腹或腹腔镜胰十二指肠切除术,使外科治疗更加游刃有余。相对于开腹手术,LTDP具有腹腔镜手术恢复快、创伤小等诸多优点,更加符合局部切除的微创理念。虽然目前LTDP手术时间较长,但这是腹腔镜手术开展的必经阶段。相信随着经验的积累和技术的进步,LTDP也会和其他腹腔镜手术一样取得更好的效果。因此,我们认为对于已熟练掌握腹腔镜技术的外科医生,LTDP是可以尝试的,腹腔镜十二指肠乳头肿瘤局部切除 术是安全、可行的。
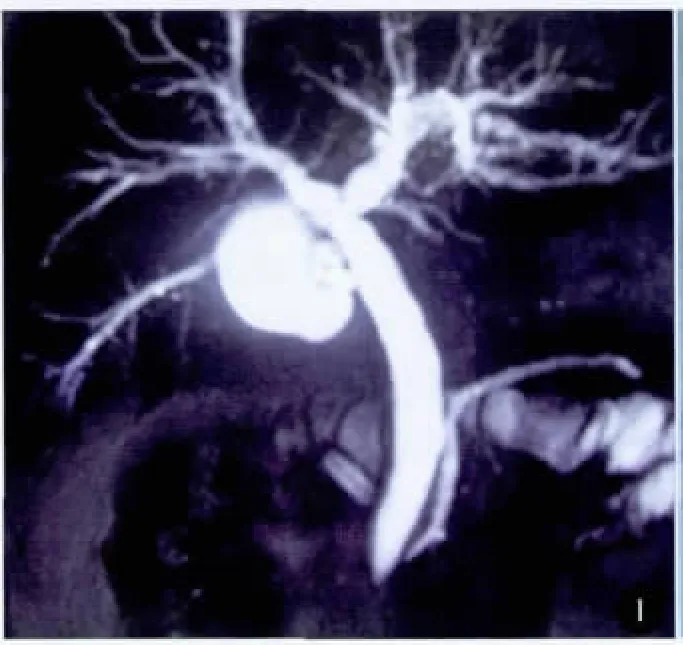
图1 术前MRCP示十二指肠乳头部占位
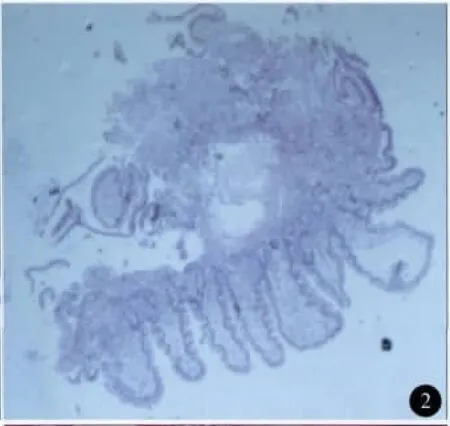
图2 术前活检病理:(十二指肠乳头区)黏膜慢性炎症伴局灶性病变,少量腺上皮轻~中度不典型增生 HE染色 ×40
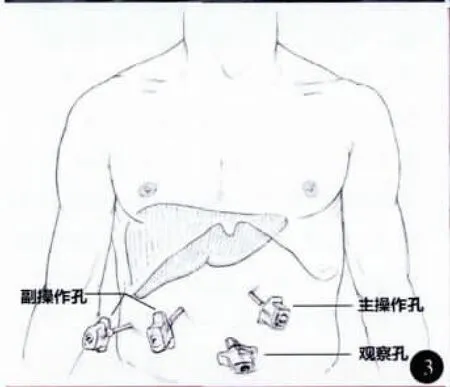
图3 术中trocar位置
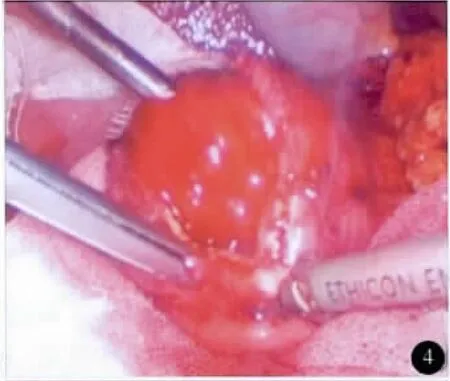
图4 切开十二指肠侧壁并确定肿瘤位置
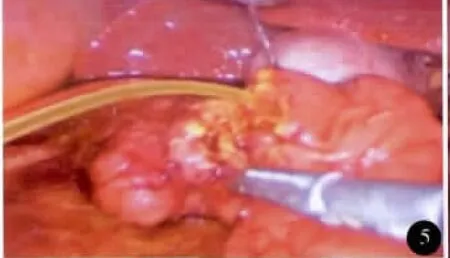
图5 确定胆总管见引流管内胆汁流出
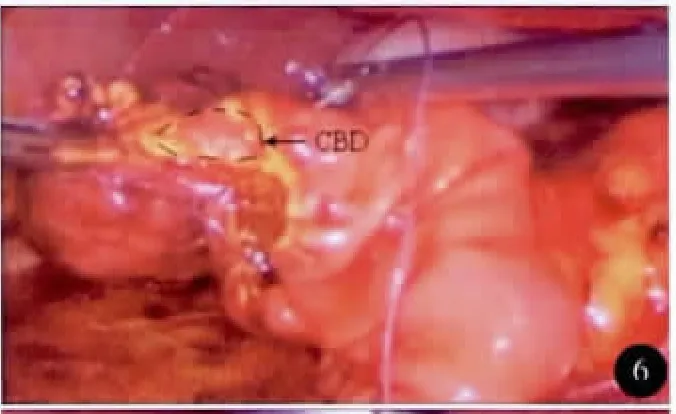
图6 缝合胆总管及周围肠黏膜
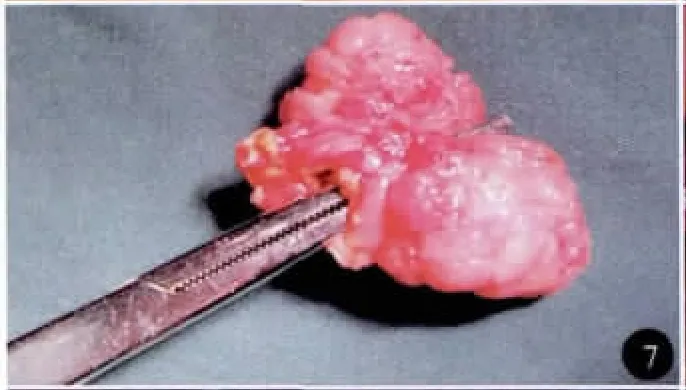
图7 术后标本
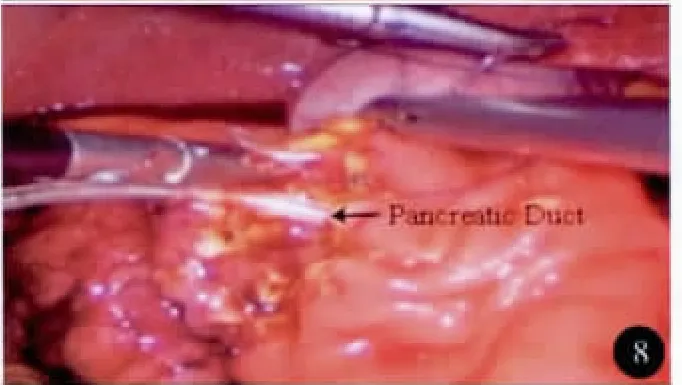
图8 胰管内放置支架管并见胰液流出
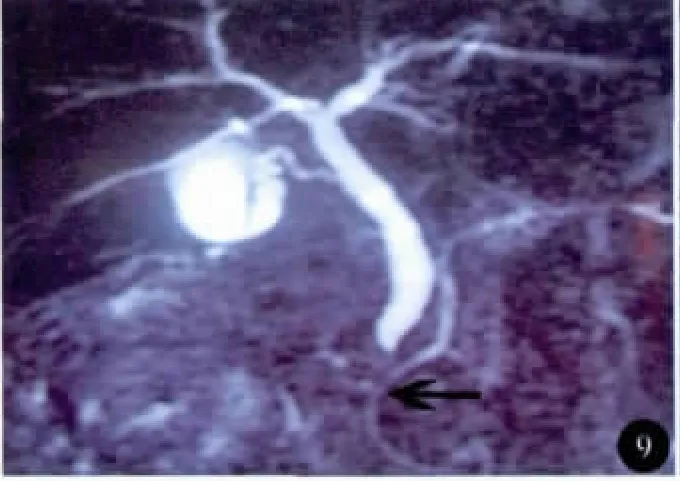
图9 术后13 d复查MRCP见胰管内支架管通畅
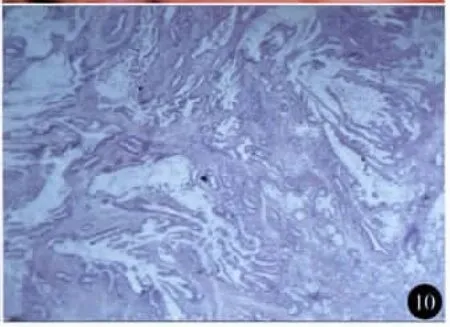
图10 术后病 理:(十二指肠)中分化腺癌伴黏液细胞癌,浸透肌层达浆膜 HE染色×40
1 Crist DW,Cameron JL.The current status of theWhipple operation for periampullary carcinoma.Adv Surg,1992,25:21-49.
2 Wagle PK,Joshi RM,Mathur SK.Pancreaticoduodenectomy for periampullary carcinoma.Indian JGastroenterol,2001,20:53-55.
3 Ogawa T,Ito K,Fujita N,et al.Endoscopic papillectomy as a method of total biopsy for possible early ampullary cancer.Dig Endosc,2012,24:291.
4 Irani S,Arai A,Ayub K,et al.Papillectomy for ampullary neoplasm:results of a single referral center over a 10-year period.Gastrointest Endosc,2009,70:923-932.
5 许 军,王知非,刘 昶,等.腹腔镜在肝门部胆管癌切除术中的应用.中华腔镜外科杂志(电子版),2010,3:23-25.
6 许 军,关英辉,殷和良,等.完全腹腔镜腹主动脉瘤切除术1例报告.中国微创外科杂志,2011,11:1025-1026.
7 Ahn KS,Han HS,Yoon YS,et al.Laparoscopic transduodenal ampullectomy for benign ampullary tumors.J Laparoendosc Adv Surg Tech A,2010,20:59-63.
8 Yoon YS,Kim SW,Park SJ,et al.Clinicopathologic analysis of early ampullary cancers with a focus on the feasibility of ampullectomy.Ann Surg,2005,242:92-100.
9 Sperti C,Pasquali C,Piccoli A,et al.Radical resection for ampullary carcinoma:long-term results.Br JSurg,1994,81:668-671.
10 Asbun HJ,Rossi RL,Munson JL.Local resection for ampullary tumors.Is there a place for it?Arch Surg,1993,128:515-520.
11 Rattner DW,Fernandez-del Castillo C,BruggeWR,et al.Defining the criteria for local resection of ampullary neoplasms.Arch Surg,1996,131:366-371.
12 Beger HG,Staib L,Schoenberg MH.Ampullectomy for adenoma of the papilla and ampulla of Vater.Langenbecks Arch Surg,1998,383:190-193.
13 Yamao T, Isomoto H, Kohno S, et al. Endoscopic snare papillectomy with biliary and pancreatic stent placement for tumors of themajor duodenal papilla.Surg Endosc,2010,24:119-124.
14 Rosen M,Zuccaro G,Brody F.Laparoscopic resection of a periampullary villous adenoma.Surg Endosc,2003,17:1322-1323.
15 Posner S,Collentti L,Knol J,et al.Safety and long-term efficacy of transduodenal excision for tumor of the ampulla of Vater.Surgery,2000,128(40):694-701.

