最新国际肺腺癌分类方法回顾性分析具有细支气管肺泡癌特征的肺腺癌209例
田 璇 孙蕾娜 王 静 董元焕 战忠利
细支气管肺泡癌是一种少见的恶性肿瘤,有其独特的临床、影像学和形态学特征,预后较好且较少发生转移[1]。近年研究资料表明其发病率有逐年升高的趋势[2]。2004年WHO肺和胸膜肿瘤组织学分类中,BAC是指肿瘤细胞沿肺泡壁呈附壁式生长,癌细胞密集排列形态多样,可呈立方柱状、钉状、圆顶状,但无间质、脉管或胸膜的侵犯。但实际的病理诊断中,不同病理科医生对是否侵犯依据的标准有差异,使得以前诊断为BAC的肺腺癌包括了多种不同的病变[3],有孤立性小的非浸润性腺癌、微小浸润性腺癌、以鳞屑样生长方式为主的浸润性腺癌、混合性亚型浸润性腺癌和广泛播散性黏液腺癌。2011年2月国际肺癌研究学会(international association for the study of lung cancer,IASLC)、美国胸科协会(American tho⁃racic society,ATS)和欧洲呼吸协会(European respira⁃tory society,ER)联合发表了关于肺腺癌国际多学科分类[4](以下简称新分类)。新分类推荐不再使用BAC的名称,首次提出AIS和MIA的命名。然而,仍然存在一些问题,如浸润性病灶的测量误差较大[5]、肺癌中浸润的定义及肿瘤总体大小的重要性。本研究将通过对大量病例的回顾性研究解决这些问题。
1 材料与方法
1.1 病例资料
收集天津医科大学附属肿瘤医院2000年1月至2005年12月间经手术切除、病理诊断为细支气管肺泡癌或伴细支气管肺泡癌成分的腺癌209例,其中男性84例,女性125例,男女之比为1∶1.5;发病年龄26~80岁,中位年龄60岁。
1.2 方法
1.2.1 组织病理学 活检和手术切除标本固定于10%的中性福尔马林液中,石蜡包埋切片,HE染色。描述手术标本的大体表现及显微镜下的组织学特点。按照2011年肺癌新分类中的病理分类对所有组织学切片进行复习和亚型分型。所有病例均由两名副高级及以上职称的病理医师阅片,经光镜明确诊断,当诊断结果不同时,则两名医师在多头显微镜下共同讨论决定。
1.2.2 随访 随访采用病历记载、门诊、电话及信件随访等方式。生存时间:手术当天算起至末次随访日期或死亡时间,以月为单位计算。
1.3 统计学分析
采用SPSS19.0统计软件,各参数间的比较采用χ2检验,生存分析采用Kaplan-Meier法,P<0.001为差异有统计学意义。
2 结果
2.1 相关临床病理参数
年龄、性别、吸烟史以及肿瘤直径对患者5年生存率的影响,差异均无统计学意义(P>0.001),而患者的TNM分期、淋巴结转移率对患者5年生存率的影响,差异有统计学意义(P<0.001,表1)。在AIS和MIA未发现淋巴结转移,而在LPA、腺泡+乳头为主型、实性型+微乳头为主型,淋巴结的转移率分别为50.0%、45.5%、64.1%(表2)。
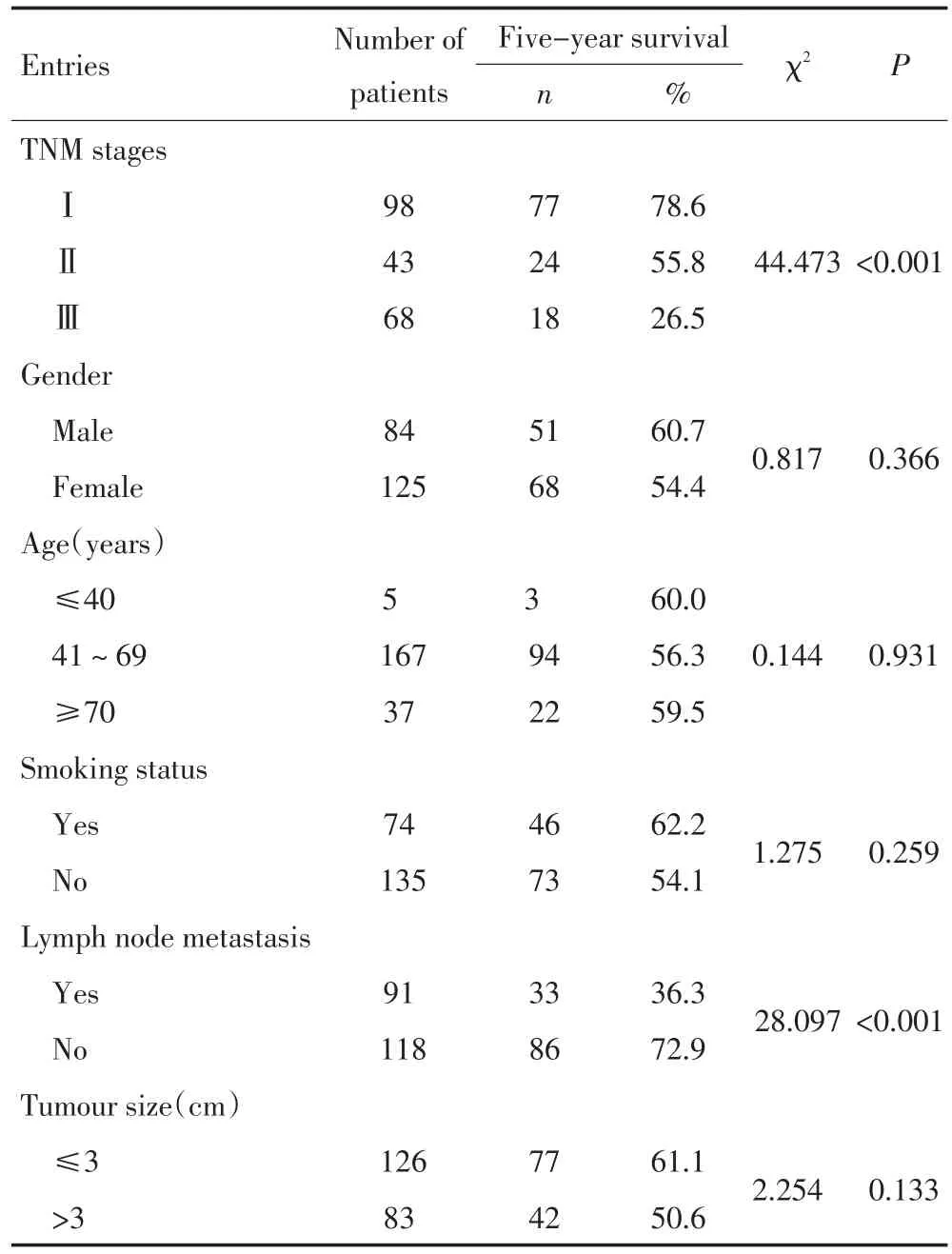
表1 相关临床病理参数对肺癌患者5年生存率的影响Table 1 Effects of the clinicopathologic parameters on the 5-year surviv⁃al rate of lung cancer patients

表2 肺腺癌各组织学亚型5年生存率的比较Table 2 Comparison of the 5-year survival rates of lung adenocarcinoma patients with various histologic subtypes
2.2 组织病理学
采用严格的新分类病理诊断标准复阅切片后,原诊断BAC的209例病例中包括AIS 20例、MIA 13例、鳞屑样生长方式为主型腺癌82例、乳头状和腺泡状为主型55例、实性型和微乳头为主型39例。AIS中17例为非黏液型,3例为黏液型。黏液型AIS瘤体切面呈胶样半透明状,光镜下观察癌细胞胞浆透明,胞核位于基底部,大小形态较一致;非黏液型AIS即原来的非黏液型BAC,肿瘤大体表现一般呈灰白色、实性,癌细胞为立方状或柱状,细胞质淡红染,核大、染色偏深,核仁明显。浸润性腺癌5种亚型的混合存在较常见[6],如乳头状和鳞屑样生长方式、腺泡状和微乳头,其他2种甚至3种以上的组合也较常见(图1)。

图1 肺腺癌亚型组织学特点Figure 1 Histologic classification of lung adenocarcinoma
2.3 随访情况
随访过程中死亡81例,占38.8%,死亡原因包括肺转移、骨转移、脑转移、肝转移、恶病质、感染及其他部位的转移。AIS和MIA 5年生存率为100%,而在LPA、腺泡+乳头为主型、实性型+微乳头型,5年生存率分别为56.1%、54.5%、25.6%(表2)。随访中LPA中有部分病例达到了8年甚至更长的无瘤生存期(图2)。
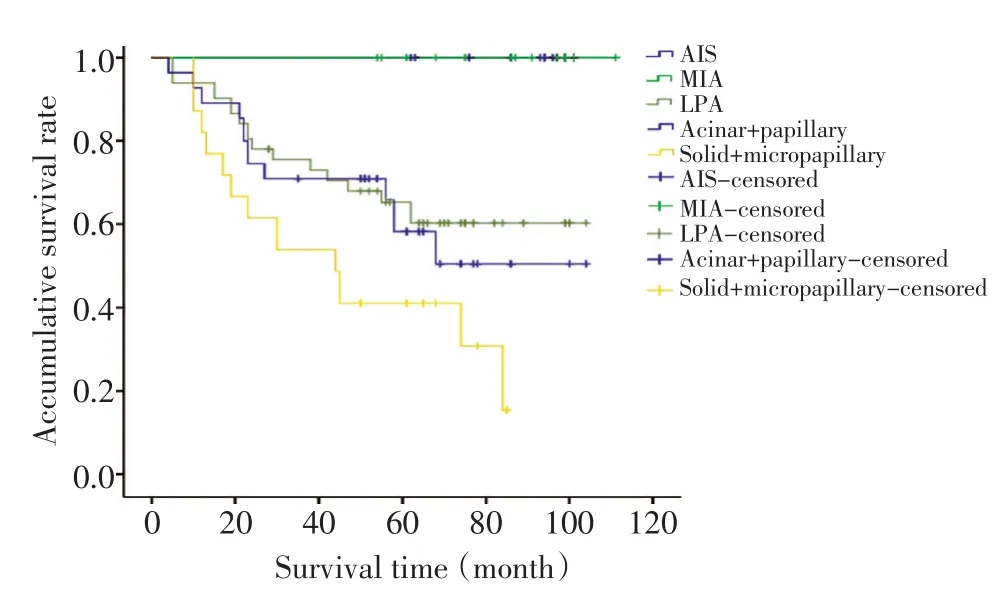
图2 肺腺癌各亚型的无瘤生存时间比较Figure 2 Comparison of the tumor-free survival with the predominant histologic subtype
3 讨论
肺癌是世界上发病率和死亡率最高的恶性肿瘤之一[7],在许多国家包括我国,肺腺癌已成为最常见的病理类型。依据2004年WHO肺和胸膜肿瘤组织学分类,大部分肿瘤被诊断为混合型腺癌,许多研究者提出这种诊断结果不能为临床提供比较有价值预后的信息,有些研究者发表了更有临床意义的分类方法。随着对肺腺癌研究的深入,特别是分子生物学及靶向治疗[8]的应用,肺腺癌分类已无法适应目前的发展需要。因此,2011年2月国际肺癌研究协会、美国胸科协会、欧洲呼吸协会联合发表了肺腺癌国际分类法。根据新分类中的病理分类,肺腺癌手术切除标本分为浸润前病变、微小浸润性腺癌、浸润性腺癌和浸润性腺癌的变异型4种基本类型。推荐不再使用BAC的名称,首次提出AIS和MIA的命名。将非典型腺瘤样增生(atypical adenomatous hyperplasia,AAH)和AIS一起归入肺腺癌的浸润前病变。
本研究进行回顾性分析的关键是AIS和MIA的诊断标准的把握。新分类中AIS是指病变直径≤3 cm,肿瘤细胞完全沿肺泡壁生长,无间质、血管或胸膜浸润的小腺癌,是旧分类中≤3 cm的BAC。MIA的诊断需谨慎,这是由于需要仔细寻找并测量浸润病灶。本研究所依据的侵袭的标准如下[9]:1)间质、脉管、胸膜、气道的浸润;2)肺泡结构消失,间质结缔组织增生;3)腺体的形状呈角或单细胞浸润;4)实性或乳头状生长。在阅片过程中发现纤维化的瘢痕组织,这些为肿瘤性瘢痕组织。
在本研究结果中,年龄、性别、吸烟史[10]以及肿瘤直径对患者5年生存率影响的差异均无统计学意义(P>0.001)。Borczuk等[11]对178例原发性肺腺癌进行回顾性研究,结果显示侵袭的程度与淋巴结转移和死亡风险相关,而肿瘤直径与死亡风险不相关。肿瘤直径大小与预后不符,这是因为将原位腺癌的成分也计算在测量范围内,即肿瘤的大部分假设为侵袭性成分。虽然这种假设对大部分鳞癌和大细胞癌比较准确[12],但不太适用于成分丰富的肺腺癌,因为有研究[13]显示鳞屑样生长方式的成分是非侵袭性的,而且许多肺腺癌都含有这种非侵袭性的鳞屑样生长方式的成分。
本研究共选取具有BAC特征的肺腺癌209例,全组患者5年生存率为56.9%(119/209),在AIS和MIA 5年生存率为 100%(20/20)和 100%(13/13),而在LPA、腺泡+乳头为主型、实性型+微乳头为主型,5年生存率分别为56.1%(46/82)、54.5%(30/55)、25.6%(10/39)。1995年Noguchi等[14]复习了236例外科切除的直径≤2 cm的外周型腺癌并分为A型:纯鳞屑样生长;B型:鳞屑样生长伴有灶性“结构塌陷”;C型:鳞屑样生长伴有“灶性纤维母细胞增生”;D型:分化差的腺癌;E型:管状腺癌;F型:乳头状腺癌6个亚型。在该研究中,A和B型无淋巴结的转移而且5年生存率是100%;C型的5年生存率是74.8%,淋巴结的转移率为28%。因此结论是A和B型被认为是原位腺癌,预后较好;C型由A和B型进一步发展而来;D、E和F型为进展期肺癌,预后较差。目前,Sakurai等[15]回顾性分析了380例肿瘤直径≤2 cm的腺癌,肿瘤直径<0.6 cm的91例患者中,仅3.3%的患者肿瘤复发,更重要的是全部生存了7年。
综上所述,肺腺癌中AIS和MIA有较好的预后。因此,对具有细支气管肺泡癌特征的肺腺癌严格按照新分类标准进行亚型分型,对指导临床治疗及预测预后有重要意义。
1 Russell PA,Wainer Z,Wright GM,et a1.Does lung adenocarcino⁃ma subtype predict patient survival?:A clinicopathologic study based on the new international association for the study of lung can⁃cer/American thoracic society/European respiratory society interna⁃tional multidisciplinary lung adenocarcinoma classification[J].J Tho⁃rac Oncol,2011,6(9):1496-1504.
2 Kim HK,Choi YS,Kim J,et al.Management of multiple pure ground-glass opacity lesions in patients with bronchioloalveolar carcinoma[J].J Thorac Oncol,2010,5(2):206-210.
3 Lin DM,Ma Y,Zheng S,et a1.Prognostic value of bronchioloalve⁃olar carcinoma component in lung adenocarcinoma[J].Histol Histo⁃pathol,2006,21(6):627-632.
4 Travis WD,Brambilla E,Noguchi M,et al.International associa⁃tion for the study of lung cancer/American thoracic society/Europe⁃an respiratory society international multidisciplinary classification of lung adenocarcinoma[J].J Thorac Oncol,2011,6(2):244—285.
5 Maeshima AM,Tochigi N,Yoshida A,et a1.Histological scoring for small lung adenocarcinomas 2 cm or Less in diameter:a reliable prognostic indicator[J].J Thorac Oncol,2010,5(3):333-339.
6 Xu,L,Tavora F,Battafarano R,et a1.Adenocarcinomas with prominent lepidic spread:retrospective review applying new classifi⁃cation of the American thoracic society[J].Am J Surg Pathol,2012,36(2):273-282.
7 Hamaji M,Allen MS,Cassivi SD,et a1.Surgical treatment of meta⁃chronous second primary lung cancer after complete resection of non-small cell lung cancer[J]. J Thorac Cardiovasc Surg,2013,145(3):683-690.
8 Casali C,Rossi G,Marchioni A,et al.A single institution-based retrospective study of surgically treated bronchioloalveolar adeno⁃carcinoma of the lung:clinicopathologic analysis,molecular fea⁃tures,and possible pitfalls in routine practice[J].J Thorac Oncol,2010,5(6):830-836.
9 Fukui T,Sakakura N,Mori S,et al.Controversy about small pe⁃ripheral lung adenocarcinomas:how should we manage them[J].J Thorac Oncol,2007,2(6):546-552.
10 Rusch VW,Asamura H,Watanabe H,et al.The IASLC lung can⁃cer staging project:a proposal for a new international lymph node map in the forthcoming seventh edition of the TNM classification for lung cancer[J].J Thorac Oncol,2009,4(5):568-577.
11 Borczuk AC,Qian F,Kazeros A,et a1.Invasive size is an indepen⁃dent predictor of survival in pulmonary adenocarcinoma[J].Am J Surg Pathol,2009,33(3):462-469.
12 Yoshizawa A,Motoi N,Riely GJ,et al.Impact of proposed IASLC/ATS/ERS classification of lung adenocarcinoma:prognostic sub⁃groups and implications for further revision of staging based on analysis of 514 stage I cases[J].Mod Pathol,2011,24(5):653-664.
13 Haruki T,Shomori K,Shiomi T,et al.The morphological diversity of small lung adenocarcinoma with mixed subtypes is associated with local invasiveness and prognosis[J].Eur J Cardiothorac Surg,2011,39(5):763-768.
14 Noguchi M,Morikawa A,Kawasaki M,et a1.Small adenocarcino⁃ma of the lung:histologic characteristics and prognosis[J].Cancer,1995,75(12):2844-2852.
15 Sakurai H,Maeshima A,Watanabe S,et al.Grade of stromal inva⁃sion in small adenocarcinoma of the lung:histopathological mini⁃mal invasion and prognosis[J].Am J Surg Pathol,2004,28(2):198-206.

