联合检测血清HMGB1 PSA在局限性前列腺癌冷冻术后复发中的应用价值*
胡 萍 司同国 于海鹏 王海涛 郭 志
前列腺癌(prostate cancer,Pca)是老年男性常见的泌尿系恶性肿瘤,近年发病率直线上升且呈年轻化趋势[1]。经皮冷冻消融治疗前列腺癌具备操作简单、微创、疗效确切等优点,已由根治术或放疗后复发的补救治疗手段发展成为局限性前列腺癌的一线治疗手段[2]。残存肿瘤复发或转移是影响冷冻消融治疗远期疗效的重要因素,早期发现予以干预可提高生存率[3-4],目前,尚无有效手段早期发现复发患者。近年来血清分子标志物的发展,逐渐发现了一些对前列腺癌诊断和预后预测有价值的标志物[5]。多项研究发现高迁移率族蛋白B1(high-mobility group box 1 protein,HMGB1)在前列腺癌中高表达,并且和肿瘤形成、进展和转移相关。本文通过检测患者术后血清HMGB1和前列腺特异抗原(prostate-spe⁃cific antigen,PSA),结合临床检测疾病复发的金标准,旨在探讨两者在前列腺癌患者血清中的表达水平对经前列腺氩氦冷冻治疗后复发患者的预测价值。
1 材料与方法
1.1 临床资料
2010年6月至2011年6月天津医科大学附属肿瘤医院介入科诊治的80例临床局限性前列腺癌患者(Pca组),年龄50~91岁,中位年龄73岁;均未接受内分泌及其它抗癌治疗;血清PSA、前列腺穿刺活检确诊。前列腺癌临床分期参照第7版国际抗癌联盟(UICC)制定的TNM分期方法,Ⅰ期9例,Ⅱ期15例,Ⅲ期56例。选择同期门诊就诊的前列腺良性增生者(BPH组),年龄53~75岁,中位年龄69岁;20例健康献血者,年龄45~54岁,中位年龄52岁,肝肾功能均正常,排除其它合并肿瘤,取血48h内不做直肠指检(DRE)。所有入组个体血清样本的取得,均在术前获得患者知情同意,签署知情同意书,符合伦理学要求。
1.2 方法
1.2.1 前列腺癌冷冻治疗 低位硬膜外麻醉或全身麻醉下采取Endocare(美国)公司氩氦冷冻治疗设备,膀胱截石位,留置三腔气囊导尿管,38~39℃生理盐水常压下循环保护尿道。BK1101型超声双平面直肠探头,轴面、矢状面导引下定位穿刺,根据肿瘤大小,选择2~6个2 mm的冷冻器。冷冻消融治疗始于腹侧,依次向背侧进行。根据冰球扩展速度及范围,调整输出功率,控制温度在-45℃~-80℃,持续18~20 min后氦气迅速复温,完成2循环的冷冻-复温治疗。操作均在超声、心电监护下进行。术后局部压迫穿刺点5~6 min;维持尿道循环灌注大于30 min,持续膀胱冲洗大于24 h,留置导尿管14 d,常规抗感染治疗3~7 d。
1.2.2 采血 所有研究对象取晨起空腹静脉血5 mL,1 h内离心分离取上清后置-80℃超低温冰箱保存待检;BPH组样本来自同期门诊患者,健康对照组样本来自本院血库;Pca组患者冷冻治疗术后第1个月采血。
1.2.3 血清HMGB1的ELISA检测 采用双抗体夹心ELISA试剂盒检测血清HMGB1表达(血清HMGB1酶联免疫吸附(ELISA)试剂盒购自R&D公司),操作方法严格按照试剂盒使用说明进行操作,重复3次取均值。
1.2.4 PSA随访 Pca组患者术后每月定期复查PSA,采用Phoenix生化复发定义:术后PSA水平超过谷值+2。对于生化复发患者,1W内行MRI检查及超声引导下病理穿刺活检;所有患者术后常规1、3、6个月行前列腺MRI检查,影像学异常者即行病理穿刺活检;对于PSA、MRI均无异常的患者于术后12个月在超声引导下穿刺活检病理检查。术后病理活检证实肿瘤细胞存活者,定义为术后局部复发。
1.3 统计学处理
2 结果
2.1 HMGB1、PSA正常值范围和各组结果
BPH组和健康组HMGB1分别为(33.2±7.4)ng/mL和(24.7±7.3)ng/mL,Pca组术前HMGB1为(94.0±77.4)ng/mL,三组血清HMGB1水平差异有统计学意义(P<0.001),BPH组与健康组无显著性差异(P=0.589)。BPH组和健康组PSA水平分别为(14.16±8.7)μg/L和(1.6±1.5)μg/L,Pca组患者术前PSA为(37.0±21.9)μg/L,Pca组与BPH、健康组术前血清PSA水平差异显著(P<0.001),BPH组与健康组差异有统计学意义(P=0.029,表1)。
2.2 Pca组冷冻术后HMGB1和PSA联合检测
80例Pca患者前列腺氩氦冷冻治疗术后血清HMGB1水平平均值(55.0±11.0)ng/mL,与术前水平差异显著(t=2.94,P=0.005);其中,金标准证实12例患者出现复发或远处转移,9例病理活检证实为局部复发,3例MRI及全身骨显像提示盆腔淋巴结及远处转移(无原位复发)。68例无复发(stable disease,SD)患者术后血清HMGB1平均值为(55.0±10.8)ng/mL,与12例复发患者术后HMGB1平均值(70.8±2.7)ng/mL相比,差异有统计学意义(t=3.53,P=0.001)。9例局部复发者血清HMGB1平均值(73.1±7.9)ng/mL,3例远处转移者HMGB1平均值(94.3±17.9)ng/mL,组间差异有统计学意义(P<0.01)。
表1 血清HMGB1和PSA的表达 ()Table 1 The expression of HMGB1 and PSA among the groups

表1 血清HMGB1和PSA的表达 ()Table 1 The expression of HMGB1 and PSA among the groups
*:F=16.1,Pca group vs BPH、control:P<0.001,BPH vs control:P=0.589;**:F=25.56,Pca group vs BPH、control:P<0.001,BPH vs con⁃trol:P=0.029
参照文献[6],由统计软件确定前列腺癌氩氦冷冻术后血清HMGB1预测复发的临界值为60.03 ng/mL,由界值得,Pca患者术后血清HMGB1预测复发的灵敏度为83%(10/12),PSA灵敏度为67%(8/12),两者联合灵敏度92%(11/12)。其中,HMGB1假阳性率11.76%(8/68);PSA假阳性率10.3%(7/68),两者联合检测的假阳性率为10.3%(7/68)。30例良性增生病变HMGB1假阳性率6.7%(2/30)。20例健康对照者,HMGB1高于界值者1例,假阳性率5.0%(1/20,表2)。
表2 血清HMGB1、PSA预测复发性Pca ()Table 2 Serum HMGB1 and PSA in predicting recurrence of Pca
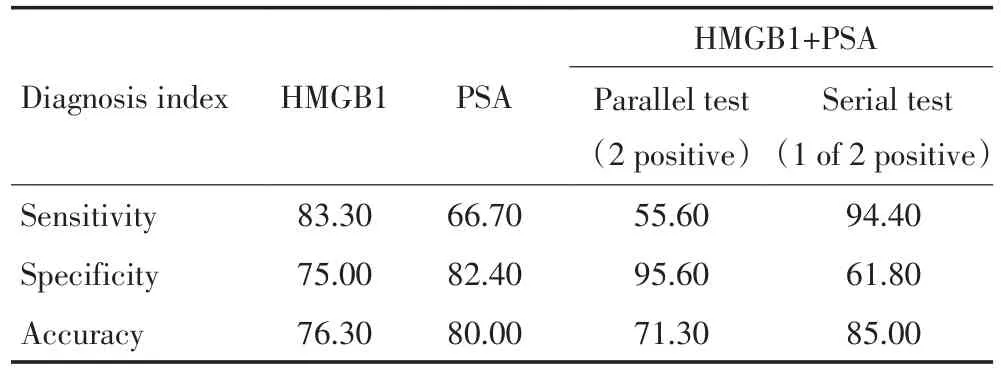
表2 血清HMGB1、PSA预测复发性Pca ()Table 2 Serum HMGB1 and PSA in predicting recurrence of Pca
2.3 Pca组冷冻术后HMGB1与临床病理特征相关性
Pca组,根据患者术后血清HMGB1的界值得,Gleason评分6分以下者阳性率21.4%(3/14),大于6分者为22.7%(15/66),差异无统计学意义(P>0.05);临床分期中的阳性率分别为:Ⅰ期33.3%(3/9),Ⅱ期46.7%(7/15),Ⅲ期14.3%(8/56),差异有统计学意义(P=0.002);局部复发和远处转移Pca患者HMGB1阳性率明显高于无复发患者(77.8%、100%和11.8%),组间差异具有统计学意义(P<0.001,表3)。
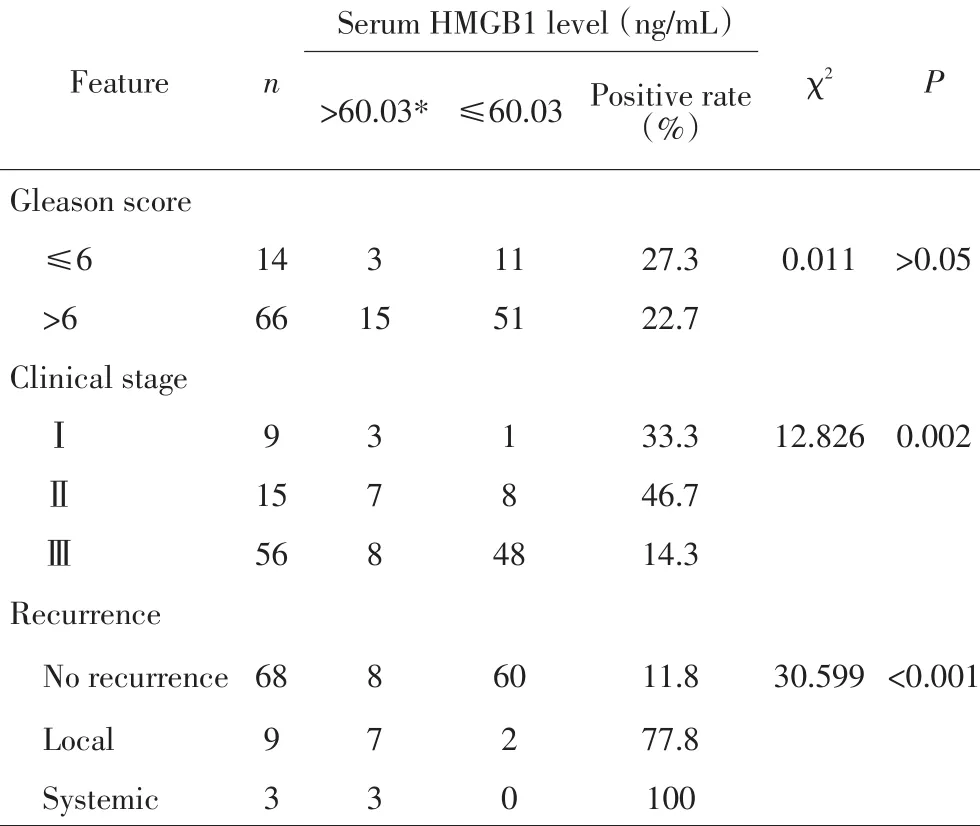
表3 Pca组患者术后血清HMGB1与临床病理特征Table 3 Clinicopathologic features of Pca patients based on post-opera⁃tive serum HMGB1 levels
3 讨论
2010年,美国男性中新诊断217 730例前列腺癌,32 050例死于前列腺癌。随着人口老龄化、生活水平及肿瘤诊断技术的提高,我国Pca的发病率直线上升。前列腺癌氩氦冷冻治疗后,局部复发或远处转移是影响患者生存的主要原因,复发患者早期诊断可进行二次冷冻治疗及其它补救治疗,降低疾病死亡率。目前常用的术后随访手段有:血清PSA、MRI等影像学检查和超声引导的病理穿刺活检。PSA作为血清学标志物应用广泛,但对于局部治疗后复发性Pca的诊断,敏感性及特异性均低。尤其对于冷冻治疗后的患者,很多PSA正常却已发生远处转移,较低的诊断精确度致患者接受了不必要的穿刺活检,不仅造成了的经济损失,而且增加了患者心理压力。
血清学标志物相对方便、经济,作为筛查手段易于接受。HMGB1是一种分布广泛、进化高度保守的非组蛋白核蛋白,因在琼脂糖凝胶电泳中高迁移率而得名。越来越多的临床证据显示HMGB1与肿瘤的转移和不良预后相关,令HMGB1有望成为一种新的、有吸引力的肿瘤标志物。HMGB1在多种人类恶性肿瘤和动物模型中过表达,有报道称坏死肿瘤细胞分泌至细胞外的HMGB1可能有助于癌症细胞的存活、增殖和侵袭[7]。尽管其与肿瘤相互作用的具体机制尚不清楚,但其作为预测肿瘤侵袭性和预后的标志物已在多种肿瘤的免疫组织化学和免疫测定过程中被很好的研究,包括:胃癌、结肠癌、乳腺癌、宫颈癌等[8-13]在诊断、预测预后和复发等方面具一定价值。有研究报道雄激素剥脱可导致前列腺癌细胞分泌 HMGB1[5]。HMGB1 对肿瘤具多种功能,包括:抗凋亡、促细胞增殖、浸润、转移。Li等[14]报道HMGB1过表达预示前列腺癌根治术后预后差,是独立的根治术后生化无复发存活的预测因子,该研究证实前列腺癌细胞系中HMGB1高表达。本文首次报道前列腺癌患者血清高表达HMGB1,与BPH和健康者具有显著差异,与之前的报道具一致性。同时,Pca组冷冻术后HMGB1水平与临床分期、复发和转移相关,提示其作为预测复发的指标具有可行性。虽然本研究分析发现术后HMGB1表达与Gleason评分无显著相关性,但是,考虑到本研究中Ⅰ期相比Ⅱ、Ⅲ期患者数量较少(9例Vs.81例),可能造成结论有偏移。因此,需要后续多中心、大样本研究来进一步证实。
多种肿瘤患者血清中可检测到HMGB1,HMGB1在胃癌和宫颈癌中诊断的敏感性和特异性分别为:71%和67%,71.6%和78%[8]。本研究结果显示,HMGB1诊断前列腺癌复发的灵敏度为83%,发生远处转移进展迅速的患者血清HMGB1明显升高,提示HMGB1在局部治疗后的复发、转移性前列腺癌中发挥作用。血清HMGB1来源广泛,肿瘤细胞核炎症细胞都可分泌HMGB1,为提高HMGB1的诊断准确度,大型的包括炎症疾病的研究应该后续进行。
美国肿瘤放疗协会(ASTRO)建议前列腺癌放疗后前2年每3~4月检测1次,以后每6个月1次,PSA降至最低点,连续检测3次逐渐升高,将复发时间定为最低点至第一次升高的中点,一般认为0.5ng/mL为合适指标;而新的Phoenix对于PSA生化复发定义为术后PSA水平超过谷值+2。Kuban等报道[15],对于PSA生化复发标准定义为PSA谷值+2,其敏感度和特异度分别为70%和89%。本研究中,HMGB1单一敏感性和特异性为83%和75%,而PSA为67%和82%,两者联合时敏感性达94.4%(串联)、特异性61.8%,准确度可达85%,证明联合两指标可提高诊断效能。
综上,局限性前列腺癌氩氦冷冻治疗后定期监测术后血清HMGB1和PSA的变化,对预测复发、转移有一定的价值,随访期间若两种血清学标志物升高,可指导穿刺活检、MRI等进一步检查,对患者是一项方便和经济的复发监测措施,提高患者依从性。本研究为单机构、小样本资料,对于HMGB1的界值定义存在局限性,需要后续的大样本、多机构、随机对照研究进一步论证。
1 Tanaka N,Fujimoto K,Hirayama,et al.Trends of the primary therapy for patients with prostate cancer in Nara uro-oncological research group(NUORG):a comparison between the CaPSURE data and the NUORG data[J].Jpn J Clin Onco,2010,40(6):588-592.
2 Cohen JK,Miller RJ Jr,Ahmed S,et al.Ten-year biochemical dis⁃ease control for patients with prostate cancer treated with cryosur⁃gery as primary therapy[J].Urology,2008;71(3):515-518.
3 郭 志.关注冷冻消融治疗前列腺癌的若干问题[J].中华医学杂志,2010,90(42):2959-2961.
4 郭 志,王海涛,邢文阁,等.冷冻消融治疗T3N0M0期前列腺癌的初步临床观察[J].中华医学杂志,2010,90(40):2815-2819.
5 Ishiguro H,Nakaigawa N,Miyoshi Y,et al.Receptor for advanced glycation end products(RAGE)and its ligand,amphoterin are over⁃expressed and associated with prostate cancer development[J].Pros⁃tate,2005,64:92-100.
6 Delong ER,DeLong DM,Clarke-Pearson DL.Comparing the ar⁃eas under two or more correlated receiver operating characteristic curves:a nonparametric approach[J].Biometrics,1988,44(3):837-845.
7 Kuniyasu H,Chihara Y,Kondo H,et al.Amphoterin induction in prostatic stromal cells by androgen deprivation is associated with metastatic prostate cancer[J].Oncol Rep,2003,10(6):1863-1868.
8 Akaike H,Kono K,Sugai H,et al.Expression of high mobility group box chromosomal protein-1(HMGB-1)in gastric cancer[J].Anticancer Res,2007,27:449-457.
9 Chung HW,Lee SG,Kim H,et al.Serum high mobility group box-1(HMGB1)is closely associated with the clinical and patholog⁃ic features of gastric cancer[J].Transl Med,2009,7:38.
10 Lee H,Song M,Shin N,et al.Diagnostic significance of serum HMGB1 in colorectal carcinomas[J].PLoS One,2012,7(4):e34318.
11 Brezniceanu ML,Völp K,Bösser S,et al.HMGB1 inhibits cell death in yeast and mammalian cells and is abundantly expressed in human breast carcinoma[J].FASEB J,2003,17(10):1295-1297.
12 Sheng X,Du X,Zhang X,et al.Clinical value of serum HMGB1 levels in early detection of recurrent squamous cell carcinoma of uterine cervix:comparison with serum SCCA,CYFRA21-1,and CEA levels[J].Croat Med J,2009,50(5):455-464.
13 Chen J,Liu X,Zhang J,et al.Targeting HMGB1 inhibits ovarian cancer growth and metastasis by lentivirus-mediated RNA interfer⁃ence[J].J Cell Physio,2012,227(11):3629-3638.
14 Li T,Gui Y,Yuan T,et al.Overexpression of high mobility group box 1 with poor prognosis in patients after radical prostatectomy[J].BJU Int,2012,110(11 Pt C):E1125-E1130.
15 Kuban DA,Levy LB,Potters L,et al.Comparison of biochemical failure definitions for permanent prostate brachytherapy[J].Int J Ra⁃diat Oncol Biol Phys,2006,65(5):1487-1493.

