E-cadherin和COX-2蛋白在胃癌组织中的表达及临床意义
鲁海珍 刘尚梅
胃癌是最常见的恶性肿瘤之一,预后较差,是全球癌症第二死因[1]。肿瘤的发生发展是多基因参于的多步骤过程,其中包括控制细胞增殖的抑癌基因失活和促进细胞增殖的癌基因激活。E-钙粘附素(E-cadherin)是钙离子介导的跨膜糖蛋白家族中一员,其结构和功能异常可导致细胞间粘附能力减弱,在肿瘤形成及进展中发挥重要作用。环氧合酶(cy⁃clooxygenase:COX)-2是一种诱导型前列腺素合成过程中的限速酶,它将花生四烯酸代谢成各种前列腺素产物,参与维持机体的各种生理和病理功能[2]。本研究通过对胃癌及癌旁组织上述蛋白表达情况的检测,对比肿瘤与癌旁组织及临床病理指标的关系,探讨二者在胃癌诊断及进展预后等方面的作用。
1 材料与方法
1.1 一般资料
选取2005年2月至2006年10月中国医学科学院肿瘤医院外科行胃癌根治术手术患者病例121例,术前均未行放化疗。基本资料:男96例(79.3%),女25例(20.7%);≥50岁101例(83.5%),<50岁20例(16.5%);贲门45例(37.2%),胃体28例(23.1%),胃窦42例(34.7%),全胃6例(5.0%);肿瘤体积≥6 cm 75例(62.0%)。对所有病例进行病理切片复阅,选取肿瘤及癌旁黏膜位点进行组织微阵列制作。由于脱片,最终对121例胃癌及113例癌旁黏膜行E-cad⁃herin,对118例胃癌及111例癌旁行COX-2免疫组织化学检测。
1.2 组织芯片制作
结合原HE切片,选取有代表性的肿瘤、瘤旁、远端黏膜等位点在供体蜡块做出标记,对应取材,打入受体蜡块相应孔中,取材钢针内径为0.6 mm,深度3.0 mm。受体蜡块制作完成后,4 μm厚度切片,70℃烤片1 h,室温保存,以备免疫组织化学检测。
1.3 免疫组织化学染色
所选抗体均购自福州迈新生物技术公司,均为工作液。E-cadherin为鼠抗人单克隆抗体,克隆号为A42C7;COX-2为兔抗人单克隆抗体,克隆号为SP21。实验步骤采用S-P法,石蜡切片经脱蜡、梯度酒精水化后进行抗原修复,具体为pH6.0枸橼酸盐缓冲液抗原修复,微波炉加热。抗原修复盒内液体温度保持在95℃并持续20 min,试剂A阻断内源性过氧化物酶活性,试剂B封闭血清,一抗4℃过夜,试剂C信号放大,DAB染色及封片。
1.4 结果判读
免疫组化结果根据阳性细胞数目比例及着色强度判断,<5%为0分,5%~25%为1分,26%~50%为2分,>50%为3分。未着色为0分,淡黄色为1分,棕黄色为2分,棕褐色为3分。以二者得分相乘,0分记为阴性(-),1~3分为弱阳性(1+),4分为中度阳性(2+),6分和9分为强阳性(3+)。
1.5 统计学方法
统计学分析应用SPSS 16.0 for windows软件包,采用Pearson卡方检验和Fisher精确检验,以P<0.05为差异具有统计学意义。
2 结果
对121例肿瘤组织进行E-cadherin免疫组织化学染色(图1),表达阳性为93例(76.9%),阴性28例(23.1%),弱阳、中阳和强阳性的表达率分别为33.9%、42.1%和0.9%,对比临床病理指标,显示该蛋白表达与肿瘤大体分型(P=0.014)、Lauren分型(P=0.001)、肿瘤分化(P=0.004)及pTNM分期(P=0.024)等显著相关(表1)。结果显示浸润型、Lauren分型为弥漫型、肿瘤分化差及pTNM分期高的肿瘤组织E-cad⁃herin缺失或弱表达要显著高于局限型分化好及分期早的肿瘤。E-cadherin蛋白表达与患者性别、年龄、肿瘤大小、浸润深度及淋巴结转移无明显相关性。113例癌旁黏膜组织E-cadherin均呈阳性表达,E-cadherin在肿瘤及癌旁黏膜组织表达之间无显著相关性(P=0.673)。
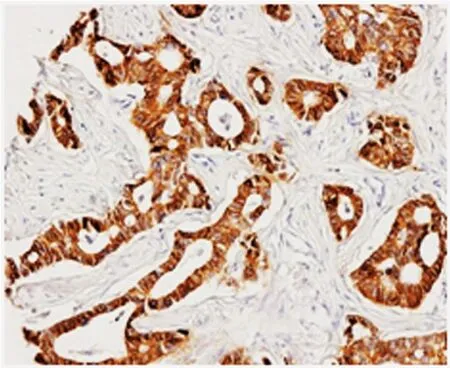
图1 E-cadherin蛋白免疫组化强阳性表达(S-P法×100)Figure 1 E-cadherin expression determined by immunohistochemistry(SP method× 100)

表1 E-cadherin蛋白表达与临床病理参数相关性 (例%)Table 1 Association of E-cadherin protein expression with clinicopathologic characteristics
检测118例胃癌肿瘤组织COX-2蛋白表达(图2),阳性率为38.1%(45/118),主要为弱阳-中等强度表达,无强阳性表达。对比COX-2蛋白表达与临床病理指标相关性发现,其过表达仅与肿瘤的淋巴结转移数目显著相关(P=0.048,表2),胃癌无淋巴结转移COX-2阴性率为82.6%(19/23),阳性率为17.4%(4/23),伴有淋巴结转移胃癌组织COX-2阴性率为56.8%(54/95),阳性率为43.2%(41/95),显著高于淋巴结无转移者。结果还显示COX-2阴性淋巴结转移率为74.0%(54/73),弱阳表达淋巴结转移率为89.2%(33/37),中阳转移率为100%(8/8),随着COX-2蛋白表达由阴性至阳性,由弱至强的表达,淋巴结转移比率也显著增高。COX-2蛋白表达与肿瘤大小、大体分型、浸润深度、肿瘤分化、病理分期等无明显相关性。对111例相应癌旁组织检测COX-2蛋白表达,癌旁黏膜组织COX-2阴性、弱阳及中阳比率分别为22.5%(25/111)、62.2%(69/111)和15.3(17/111),与肿瘤组织COX-2蛋白表达比率对比无显著相关性(P=0.274)。
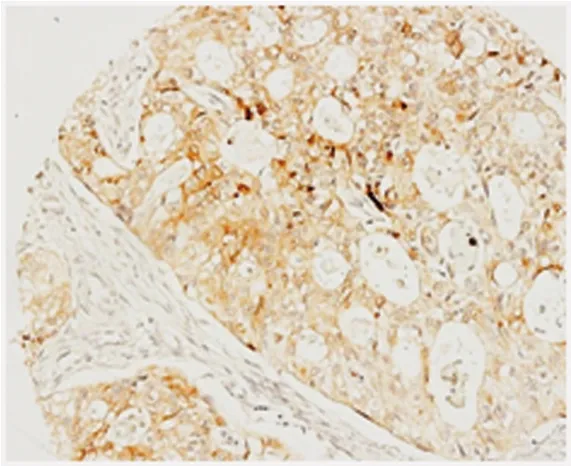
图2 COX-2蛋白免疫组化阳性表达(S-P法×100)Figure 2 COX-2 expression determined by immunohistochemistry(SP method× 100)
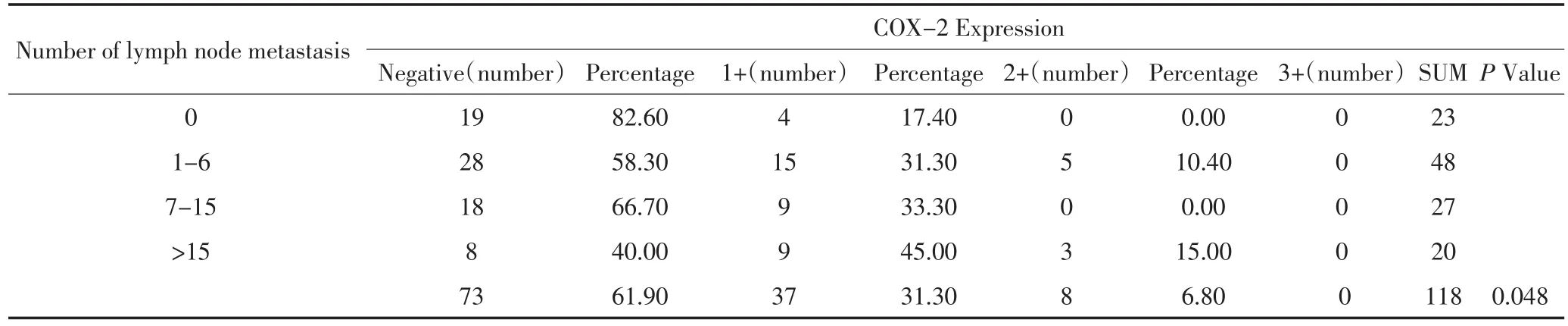
表2 COX-2蛋白表达与淋巴结转移相关性 (例%)Table 2 Association of COX-2 protein expression with lymph node metastasis
3 讨论
E-cadherin作为细胞粘附分子家族中与肿瘤关系最密切成员而倍受关注,多数与胃癌相关性研究的报道均显示其表达降低与肿瘤的浸润和转移相关,E-cadherin蛋白表达阳性的胃癌患者3年和5年生存率较阴性患者明显延长[3,4]。一项对4 383例胃癌患者E-cadherin蛋白表达的meta分析显示,其表达下调与TNM分期、肿瘤浸润深度、淋巴结转移、肿瘤分化、血管浸润、组织学分型及远处转移等显著相关[5]。本研究显示E-cadherin低表达或阴性与肿瘤分化差、病理分期高有关,这一结果提示肿瘤的分化与细胞粘附性相关,而缺乏粘附性的肿瘤易发生区域淋巴结或远处转移,预后相对较差。本研究结果未提示E-cadherin与胃癌淋巴结转移相关,但多数文献报道二者具有相关性[6,7],这一结果可能需要我们扩大样本量继续观察。在预测胃癌患者预后方面,血浆可溶性E-cadherin也许是一项备选的标记物,有研究显示在胃癌患者可溶性E-cadherin水平越高,患者预后越差,尤其是高于10 000 ng/mL的90%胃癌患者生存率不超过3年[8]。
本研究同时检测了癌旁粘膜组织E-cadherin蛋白表达,显示肿瘤旁粘膜均呈阳性表达,进一步提示其在肿瘤发生中具有重要意义。
COX-2是一种诱导型前列腺素合成过程中的限速酶,其辅助产生的各种前列腺素产物在维持肿瘤生长、促进肿瘤进展中发挥重要作用。本研究结果显示COX-2蛋白在肿瘤中的表达与淋巴结转移相关。COX-2蛋白表达越强,淋巴结转移率越高,对胃癌淋巴结转移的判断具有一定临床意义,尤其对于活检或早期胃癌病例,是否可以作为预测有无淋巴结转移的标志物之一值得探讨,类似结果国内外均有报道[9,10]。关于 COX-2高表达胃癌患者淋巴结转移率高的机制尚需进一步探讨及研究,有学者同时检测胃癌标本中COX-2、VEGF-C蛋白表达及淋巴血管密度,比较之间关系,试图解释这一科学问题,结果发现COX-2的表达与VEGF-C上调后促进淋巴血管密度增生之间无显著相关性[11]。本研究未显示COX-2与肿瘤大小、浸润深度、分化程度及临床病理分期相关。但有研究显示COX-2与胃癌上述指标显著相关,为独立预后因子[12-14],肿瘤直径>6 cm的胃癌COX-2蛋白表达水平显著高于<6 cm,T4病变COX-2表达水平显著高于T3、T2和T1病变。提示较大的肿瘤可能产生较多COX-2及前列腺素,维持肿瘤生长。
E-cadherin及COX-2均为胞膜着色,前者表达降低和后者的高表达均提示肿瘤进展趋势,二者分别从不同方面如肿瘤分化、分期及淋巴结转移显示出上述特性,因此二者联合检测可达到互补目的,对胃癌患者预后具有一定提示意义。
1 Parkin DM,Bray F,Ferlay J,et al.Global cancer statistics 2002[J].CA Cancer J Clin,2005,55(2):74-108.
2 Cao Y,Prescott SM.Many actions of cyclooxygenase-2 in cellular dynamics and in cancer[J].J Cell Physiol,2002,190(3):279-286.
3 Graziano F,Arduini F,Ruzzo A,et al.Prognostic analysis of E-cad⁃herin gene promoter hypermethylation in patients with surgically re⁃sected,nodepositive,diffuse gastric cancer[J].Clin Cancer Res,2004,10(8):2784-2789.
4 Uchikado Y,Okumura H,Ishigami S,et al.Increased Slug and de⁃creased E-cadherin expression is related to poor prognosis in pa⁃tients with gastric cancer[J].Gastric Cancer,2011,14(1):41-49.
5 Xing X,Tang YB,Yuan G,et al.The prognostic value of E-cad⁃herin in gastric cancer:A meta-analysis[J].Int J Cancer,2012,Pub⁃lished online.
6 Zhou Y,Li G,Wu J,et al.Clinicopathological significance of E-cadherin,VEGF,and MMPs in gastric cancer[J].Tumour Biol,2010,31(6):549-558.
7 Tang B,Peng ZH,Yu PW,et al.Expression and significance of Cx43 and E-cadherin in gastric cancer and metastatic lymph nodes[J].Med Oncol,2011,28(2):502-508.
8 Chan AO,Chu KM,Lam SK,et al.Soluble E-cadherin is an inde⁃pendent pretherapeutic factor for long-term survival in gastric can⁃cer[J].J Clin Oncol,2003,21(12):2288-2293.
9 姬社青,花亚伟,庄 兢,等.COX-2、p53、PCNA和nm23异常表达与胃癌生物学行为的关系[J].癌症,2002,21(6):619-624.
10 Uefuji K,Ichikura T,Mochizuki H.CycIooxygenase-2 expression is related to prostaglandin biosynthesis and angiogenesis in human gastric cancer[J].CIin Cancer Res,2000,6(1):135-138.
11 Gou HF,Chen XC,Zhu J,et al.Expressions of COX-2 and VEGF-C in gastric cancer:correlations with lymphangiogenesis and prognostic implications[J].J Exp Clin Cancer Res,2011,30:14.
12 Han SL,Tang HJ,Hua YW,et al.Expression of COX-2 in stom⁃ach cancers and its relation to their biological features[J].Dig Surg,2003,20(2):107-114.
13 Fujita T,Matsui M,Takaku K,et al.Size-and invasiondependent increase in cyclooxygenase 2 levels in human colorectal carcinomas[J].Cancer Res,1998,58(21):4823-4826.
14 Mrena J,Wiksten JP,Kokkola A,et al.COX-2 is associated with proliferation and apoptosis markers and serves as an independent prognostic factor in gastric cancer[J].Tumour Biol,2010,31(1):1-7.

