EHD2负向调控前列腺癌细胞的增殖与转化能力*
李 盼 龚玉爱 许世磊 陈永孜 田 刚 姚 欣 应国光
前列腺癌全球每年新发病例约90万例,发病率居男性恶性肿瘤第二位;尤其在发展中国家前列腺癌死亡率高达47%[1]。近十年,我国前列腺癌发病率的增长极为迅速,成为严重威胁男性生命健康的恶性肿瘤之一。
EHD2(C-Terminal EH Domain Containing Protein 2,EHD2)是最近发现的一种新型的膜转运调控蛋白,是EH蛋白家族中EHD亚类4个成员(EHD1、EHD2、EHD3、EHD4)之一,其C端含有一蛋白相互作用EH域。目前认为EHD2参与多种受体的转运调控,如类胰岛素生长因子受体[2]、胰岛素调节的葡萄糖转运蛋白[3]和神经生长因子受体[4]等。EHD2蛋白在乳腺肿瘤和食管鳞癌中低表达[5-7],EHD2表达降低可能影响了上皮细胞的极性[8],但在其它肿瘤中是否具有普遍意义尚不明确,而且EHD2对细胞增殖与转化特性的影响也未见报道。
本研究使用免疫组织化学方法检测EHD2蛋白在前列腺癌组织中的表达,同时通过小RNA干扰技术沉默或过表达EHD2后,检测EHD2蛋白对前列腺癌DU145细胞生长与转化特性的影响,为阐明前列腺癌发生机制和寻找治疗前列腺癌的新途径、新靶点提供依据。
1 材料与方法
1.1 材料
1.1.1 组织标本 14例前列腺癌组织标本和7例前列腺增生组织标本都来自天津医科大学第二附属医院手术切除或穿刺的前列腺癌男性患者,病理分级以Gleanson分级为依据。
1.1.2 细胞培养与主要试剂 293T细胞由本实验室保存,前列腺癌DU145细胞系由天津市南开大学分子生物学研究室赠送,由本实验室保存。293T细胞和DU145细胞分别生长于含10%胎牛血清、100 U/mL青霉素和100μg/mL链霉素的DMEM培养液和RPMI 1640培养液,置于5%CO2、饱和湿度、37℃细胞培养箱中培养。
DMEM培养基、RPMI 1640培养基、胎牛血清(Hyclone公司),青/链霉素(Amersco公司),0.25%胰蛋白酶(GIBCO公司),二甲基亚砜DMSO、PMSF(Sig⁃ma公司),β-巯基乙醇(Boehinger公司),ECL化学发光、PVDF膜(Millipore公司),BCA蛋白定量试剂盒(Pierce公司),质粒小提试剂盒(天根公司),EHD2抗体(本实验室制备),GAPDH抗体(Santa Cruz公司),二抗(中衫公司)。
1.2 方法
1.2.1 免疫组织化学 所有标本为首先用10%甲醛溶液固定,常规石蜡包埋,连续切片进行免疫组织化学染色检测。结果判定:EHD2表达以细胞质或细胞核中出现棕黄或棕褐色颗粒为阳性判断标准。每例镜下随机观察5个高倍视野(×400)。EHD2在胞质和胞核表达情况采用免疫反应评分进行半定量分析。根据阳性细胞数的百分率分为4个等级:0%为0分,1%~25%为1分,26%~50%为2分,51%~100%为3分;细胞染色强度分4个等级:无着色为0分,浅黄色为1分,棕黄色为2分,棕褐色为3分。将每张切片染色程度与染色细胞百分率得分相乘的积为最后得分,0~1分为(-),2~3分为弱阳性(+),4~6分为中等阳性(++),>6分为强阳性(+++),认定前1个等级为阴性表达,后3个等级为阳性表达。
1.2.2 EHD2干扰表达和过表达细胞系的建立 慢病毒表达质粒和包装质粒经磷酸钙法共转染293T细胞,48h后收集含有病毒的上清,用全培养液稀释后感染处于对数生长期的DU145细胞,并用500ng/mL的嘌呤霉素(Puromycin)进行筛选建系。
1.2.3 Western blot检测 SDS裂解液提取细胞总蛋白后,用BCA蛋白测定试剂盒测定蛋白浓度,等量蛋白进行SDS-PAGE聚丙烯酰胺凝胶电泳。采用增强化学发光试剂检测蛋白条带信号,Kodak胶片曝光。用ImageJ 1.43软件对条带进行定量。
1.2.4 细胞计数法检测细胞增殖 将相同细胞数(2.0×104个细胞)的各组细胞分别种入12孔盘中,37℃,5%CO2培养箱中正常培养,记为第0d,从第2d开始,每24 h分别将每组细胞的一个孔中细胞消化收集,细胞计数,连续计数4d,实验重复3次,绘制细胞增殖曲线。
1.2.5 检测细胞二维克隆形成能力 将相同细胞数(4.0×103个细胞)的各组细胞分别种入6 cm dish(每组3个重复孔),37℃,5%CO2培养箱中正常培养。长出明显克隆时,弃培养液,PBS清洗2遍。甲醇固定,PBS清洗,结晶紫染色。用倒置显微镜,×100光镜下分别计数>50个细胞的克隆数、10~50个细胞的克隆数、2~10个细胞的克隆数,5个视野/培养皿,实验重复3次,统计数据。
1.2.6 Soft Agar检测细胞悬浮克隆形成能力 配制0.7%和1.2%的琼脂糖上层胶和下层胶,高压灭菌后于室温降至50~60℃时放入42℃水浴。配制2倍RPMI 1640培养基(含200 U/mL青霉素、200 μg/mL链霉素及20%FBS)。取等体积的2×RPMI 1640和1.2%的Agarose,充分混匀,向35 mm dish中加入1.5 mL,并倾斜盘子使其均匀铺于孔底,室温固化。细胞消化计数后,取等体积的2×RPMI 1640和0.7%的琼脂糖,加入所需细胞数,充分混匀,加入已经固化的下层胶,1 mL/35 mm dish。37℃孵箱培养10~14d后,待长出明显克隆后,每盘加入0.5 mL的0.005%的结晶紫1 h以上染色。×20光镜下计>0.05 mm的克隆数,共计10个视野。
1.3 统计学分析
2 结果
2.1 免疫组化结果
采用免疫组织化学的方法检测EHD2在14例前列腺癌组织和7例前列腺增生组织中的表达水平,结果发现与前列腺增生组织相比,EHD2在前列腺癌组织中的表达普遍降低(图1)。7例前列腺增生组织中只有1例(14.0%)EHD2阴性,其余均为阳性,而14例前列腺癌组织中9例(64.5%)EHD2呈阴性(表1)。
2.2 DU145细胞EHD2干扰和过表达细胞系的建立
采用慢病毒质粒构建EHD2干扰和过表达体系,感染前列腺癌细胞DU145后用500ng/mL嘌呤霉素(Puromycin)筛选并建立稳定细胞系,免疫印迹检测EHD2的干扰沉默和过表达情况。结果显示EHD2的干扰和过表达效果明显(图2)。
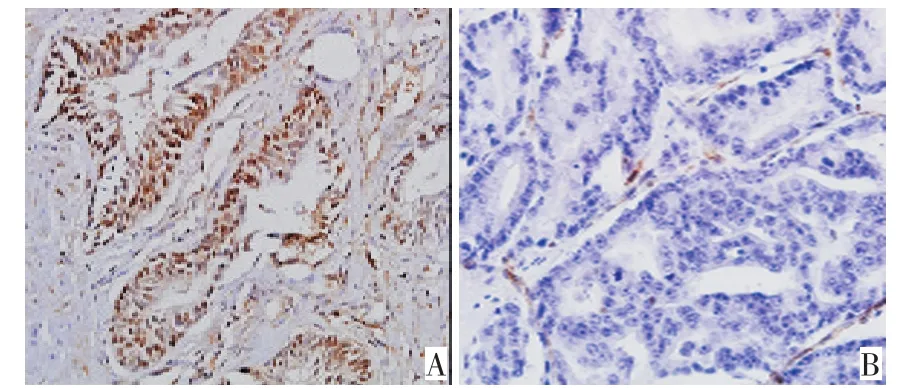
图1 EHD2在前列腺癌组织和前列腺增生组织中的IHC染色典型表现(DAB×400)Figure 1 Representative immunohistochemistry images of EHD2 stain⁃ing in prostate cancer tissue and benign prostatic hyperplasia DAB×400

表1 EHD2在前列腺癌组织和前列腺增生组织中的表达情况 例(%)Table 1 EHD2 expression level in prostate cancer tissue and benign prostatic hyperplasia Case(%)

图2 免疫印迹检测在DU145细胞中EHD2干扰和过表达效果Figure 2 Western blot analysis of the silencing and overexpression ef⁃fects of EHD2 in DU145 cells
2.3 细胞计数检测细胞增殖能力
采用细胞计数的方法连续观察EHD2干扰和过表达细胞的增殖能力。结果显示,EHD2干扰后DU145细胞增殖加快,EHD2过表达后DU145细胞生长减慢(图3),差异有统计学意义(P<0.01)。
2.4 EHD2干扰后细胞二维克隆形成能力检测
采用细胞二维克隆培养的方法,研究EHD2沉默对DU145细胞克隆形成能力的影响。结果显示EHD2干扰后DU145细胞克隆形成数量和克隆大小明显大于对照细胞(图4),差异有统计学意义(P<0.01)。
2.5 细胞转化特性检测
采用Soft Agar实验,研究EHD2沉默或过表达对DU145细胞悬浮生长能力的影响。结果显示,EHD2干扰后,DU145悬浮克隆形成能力增强(图5A),两组差异有统计学意义(P<0.01);EHD2过表达后克隆形成能力减弱(图5B),差异有统计学意义(P<0.05)。
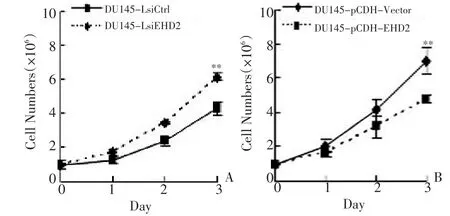
图3 EHD2的表达水平对DU145细胞增殖能力的影响Figure 3 Effects of EHD2 expression on DU145 proliferation
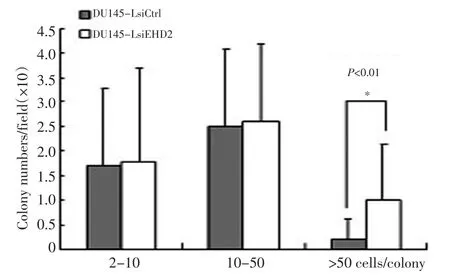
图4 EHD2干扰对DU145细胞二维克隆形成能力的影响Figure 4 Effects of EHD2 silencing on DU145 colony formation
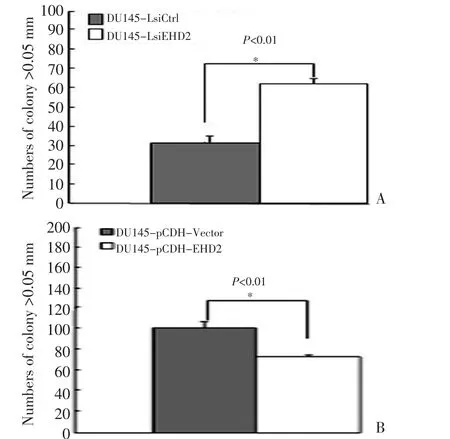
图5 EHD2表达水平对DU145细胞三维克隆形成能力的影响Figure 5 Effects of EHD2 expression on DU145 colony formation in soft agar
3 讨论
本研究前期通过肿瘤基因组转录数据挖掘分析发现EHD2在乳腺肿瘤中表达缺失,而且其表达水平和病理分级呈负相关性[5],免疫印迹结果显示EHD2在侵润性乳腺癌中表达水平明显低于乳腺正常组织[6],从而首次在蛋白水平验证了EHD2与肿瘤的关系。近期有报道在食管鳞癌组织中EHD2的表达水平和病理分级呈负相关,EHD2在转移性食管鳞癌中低表达,并且在干扰表达后细胞对顺铂引起的凋亡产生抵抗[7]。另外在基因转录水平,与正常卵巢上皮样本相比,也发现EHD2在恶性浆液性卵巢癌中呈低表达[9]。EHD2并可能是神经胶质瘤缺失染色体1.6Mb 19q区一个可能的抑癌基因[10]。本研究应用免疫组织化学的方法发现EHD2在前列腺癌组织中的表达量明显低于前列腺增生组织,说明EHD2的低表达同样可能与前列腺癌的形成有关。
细胞无限增殖是恶性肿瘤形成的重要标志之一。本文采用细胞计数法对EHD2干扰和过表达的DU145细胞进行增殖能力检测,结果显示EHD2沉默后DU145细胞生长明显加快,而过表达EHD2后DU145细胞生长则受到抑制,表明EHD2的表达水平影响DU145细胞的增殖,并且在二维克隆实验中得到一致的结果,表明EHD2的表达缺失促进了细胞的增殖能力。
EHD2是一个新型膜转运调控蛋白,Benjamin等[11]研究发现EHD2与Nek3相互作用,并与Vav1形成复合物,共同调节Rac1的活性。Rac1是细胞内重要的信号转导与极性调控分子,它通过GTPase酶的活性调控及细胞骨架重排参与调节细胞的极性保持与细胞迁移等重要细胞生物学功能。本文前期研究发现EHD2沉默后上皮细胞呈现极性的丧失[8],这可能反映了EHD2对Rac1的活性调控,并可能影响上皮细胞极性并向间质表型转化。
上皮-间质转化(epithelial-mesenchynal transi⁃tion,EMT)过程以上皮细胞失去E-cadherin及细胞连接为主要特征,并且与肿瘤细胞的原位侵袭和远处转移有着密切关系[12]。本文在二维克隆实验中,发现EHD2降表达细胞克隆中细胞间的连接与对照相比明显呈现松散趋势,与EMT表型类似。Soft Agar实验发现EHD2沉默后DU145细胞的悬浮克隆数明显增加,而过表达EHD2后的结果则相反,表明EHD2表达水平可以影响肿瘤细胞的转化特性,并且提示在前列腺癌中EHD2表达缺失很可能是促进前列腺癌细胞EMT和恶性转化的重要因素,这与食管鳞癌中EHD2低表达组织中E-cadherin表达同时降低相吻合[7]。因此,EHD2可能通过调控细胞的E-cadherin和EMT来影响肿瘤的发生以及侵袭和转移。
膜转运蛋白参与调控多种膜蛋白与受体的内吞转运以及下游信号通路,它们的功能异变涉及肿瘤发生与进展的多个层面[13-15]。
EHD2在多种肿瘤中的低表达预示其可能是一个新的抑癌基因。在食管鳞癌中EHD2低表达和肿瘤淋巴结转移密切相关,EHD2表达水平越低,淋巴结转移越强,提示EHD2低表达是肿瘤高恶性度的分子指标,而且EHD2低表达患者的生存情况明显差于EHD2高表达患者,表明肿瘤组织EHD2表达水平的检测对帮助患者预后判断可能具有重要的临床意义。EHD2不仅可能是帮助进行肿瘤恶性度以及临床预后判断的一个新的分子指标,还可能是肿瘤研究和治疗的重要靶点。
1 Jemal A,Bray F,Center MM,et al.Global cancer statistics[J].CA Cancer J Clin,2011,61(2):69-90.
2 Rotem-Yehudar R,Galperin E,Horowitz M.Association of insu⁃lin-like growth factor 1 receptor with EHD1 and SNA29[J].J Biol Chem,2001,276(35):33054-33060.
3 Guilherme A,Soriano NA,Bose S,et al.EHD2 and the novel EH domain binding protein EHBP1 couple endocytosis to the actin cy⁃toskeleton[J].J Biol Chem,2004,279(11):10593-10605.
4 Shao Y,Akmentin W,Toledo-Aral JJ,et al.Pincher,a pinocytic chaperone for nerve growth factor/TrkA signaling endosomes[J].J Cell Biol,2002,157(4):679-691.
5 王 洪玉,郭立莎,应国光,等.EHD2干扰影响永生化乳腺癌上皮细胞的增殖和迁移[J].中国肿瘤临床,2011,38(11):601-604.
6 田 刚,王学涵,应国光,等.EHD2下调促进乳腺上皮细胞转化的研究[J].现代检验医学杂志,2012,27(1):49-51.
7 Li M,Yang X,Zhang J,et al.Effects of EHD2 interference on mi⁃gration of esophageal squamous cell carcinoma[J].Med Oncol,2013,30(1):396.
8 郭立莎,王洪玉,应国光,等.EHD2调节乳腺上皮细胞极性的实验研究[J].中国肿瘤临床,2011,38(11):608-611.
9 Bignotti E,Tassi RA,Santin AD,et al.Differential gene expression pro fi les between tumor biopsies and short-term primary cultures of ovarian serous carcinomas:identi fi cation of novel molecular bio⁃markers for early diagnosis and therapy[J].Gynecol Oncol,2006,103(2):405-416.
10 Smith JS,Tachibana I,Jenkins RB,et al.A transcript map of the chromosome 19q-arm glioma tumor suppressor region[J].Genom⁃ics,2000,64(1):44-50.
11 Benjamin S,Weidberg H,Horowitz M,et al.EHD2 mediates traf⁃ficking from the plasma membrane by modulating Rac1 activity[J].Biochem J.2011,439(3):433-42.
12 Thiery,JP.Epithelial-mesenchymal transitions in tumour progres⁃sion[J].Curr Op in Cell Biol,2003,15(6):740-746.
13 Kavanagh E,Vlachos P,Emourgeon V,et al.p57(KIP2)control of actin cytoskeleton dynamics is responsible for its mitochondrial pro-apoptotic effect[J].Cell Death Dis,2012,3:e311.
14 Tcatchoff L,Andersson S,Utskarpen A,et al.Annexin A1 and A2:roles in retrograde trafficking of Shiga toxin[J].PloS One,2012,7(7):e40429.
15 Pyrzynska B,Pilecka I,Miaczynska M.Endocytic proteins in the regulation of nuclear signaling,transcription and tumorigenesis[J].Mol Oncol,2009,3(4):321-38.

