基于MRI影像组学鉴别浸润性与非浸润性乳腺癌
邵 颖,邢 滔,万 强,张爱娟,陈基明,赵文英
(皖南医学院弋矶山医院影像中心,安徽 芜湖 241001)
乳腺癌是女性最常见的恶性肿瘤之一,患病率逐年上升,发病年龄趋于年轻化[1],肿瘤是否具有浸润性对判断病变范围、制定诊疗计划、评估疗效和预测预后具有指导作用。目前临床确定乳腺癌浸润性的金标准是术后病理检查,术前判断具有一定难度。影像学检查对诊断乳腺癌具有重要价值[2],动态对比增强MRI(dynamic contrast enhancement MRI, DCE-MRI)及DWI已广泛用于乳腺癌[3],但判断肿瘤是否具有浸润性的价值有限。纹理分析通过对医学影像进行后处理及提取纹理特征参数,能定量发现肉眼无法观察到的微观信息,可对肿瘤进行定性、分级,评价疗效和预测预后等[4-7]。本研究探讨基于MRI影像组学鉴别浸润性与非浸润性乳腺癌的价值。
1 资料与方法
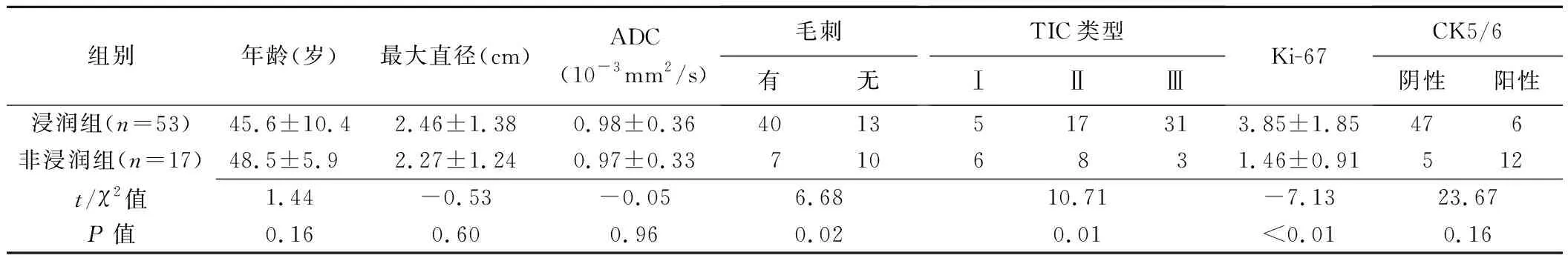
1.1 一般资料 回顾性分析2014年12月—2019年3月100例于皖南医学院弋矶山医院经手术病理证实的乳腺癌患者,年龄26~77岁,平均(47.0±9.2)岁;浸润性75例(导管癌68例,小叶癌5例,小管癌1例,乳头状癌1例),非浸润性25例(导管内癌25例);按照7∶3比例随机分为训练组(浸润性53例,非浸润性17例)和验证组(浸润性22例,非浸润性8例)。纳入标准:①与手术间隔≤2周接受乳腺MR检查;②肿块型单病灶,无淋巴结转移;③无放射治疗、化学药物等治疗史;④无乳腺手术史。排除图像质量不佳者。
1.2 仪器与方法 采用GE Signa HDxt 3.0T超导MR仪,8通道乳腺专用相控阵线圈,嘱患者俯卧,使双侧乳腺自然悬垂于线圈孔内,扫描范围为腋窝至乳腺下缘,采集轴位和矢状位图像。LAVA T1WI:TR 5.68 ms,TE 2.10 ms,TI 16 ms,层厚2.0 mm,层间距0 mm,FOV 340 mm×340 mm,矩阵348×348;STIR T2WI:TR 11 000 ms,TI 240 ms,TE 60 ms,层厚4.0 mm,层间距0.4 mm,FOV 340 mm×340 mm,矩阵320×192;DWI:采用单次激发SE-EPI序列,b=800 s/mm2,TR 6 600 ms,TE 60 ms,层厚4.0 mm,FOV 340 mm×349 mm,矩阵130×96。之后采用双筒高压注射器以流率2.5 ml/s静脉注射对比剂Gd-DTPA 0.1 mmol/kg体质量,采集轴位DCE-MRI,每期扫描时间为60 s,共8期,480 s。
1.3 特征提取及建立影像组学标签 由2名分别具有5年(医师1)和10年(医师2)MRI诊断经验的主治医师观察DCE-MRI表现,于DCE-MRI(第3期)所有层面上手动勾画病灶边缘,融合成三维ROI;之后参考DCE-MRI,观察STIR T2WI及DWI表现,并勾画病灶ROI及融合(图1),最后导入GE Analysis-Kinetics软件(3.2.0版)提取病灶纹理特征。由医师2再次勾画病灶ROI。以Spearman相关性分析剔除相关性高的影像学特征参数,以最小绝对缩减和变量选择算子(least absolute shrinkage and selection operator, LASSO)算法对训练组纹理特征进行降维,筛选价值较高的特征构建影像组学标签,按照权重计算2组浸润性与非浸润性乳腺癌放射组学得分(radiology score, rad-score)。

图1 勾画乳腺癌病灶ROI示意图 A~C.分别于轴位STIR T2WI(A)、DWI(B)和DCE-MRI(C)勾画病灶边缘ROI; D.将DCE-MRI所有层面病灶ROI融合为三维ROI
1.4 统计学分析 采用SPSS 20.0软件和R软件(版本3.5.2,http://www.Rproject.org)。以Kolmogorov-Smirnov检验进行正态性检验,以±s
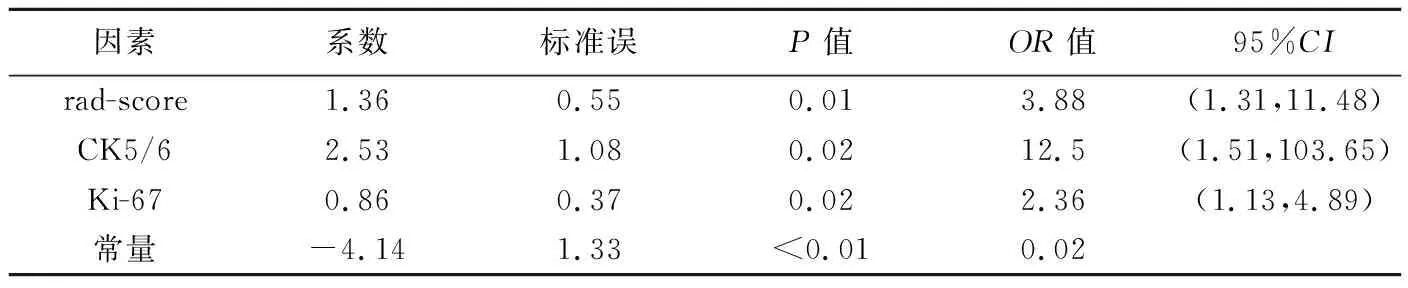
表示符合正态分布的计量资料,采用独立样本t检验进行比较;采用频数表示计数资料,以χ2检验或Fisher检验进行比较。以组内和组间相关系数(interclass correlation coefficient, ICC)评价医师1、2之间及同一医师提取纹理特征的一致性,ICC≤0.4为一致性较差,0.4 2.1 训练组和验证组临床、病理学及影像学特征 训练组与验证组中,浸润性与非浸润性乳腺癌患者年龄、最大直径、表观弥散系数(apparent diffusion coefficient, ADC)值差异均无统计学意义(P均>0.05);训练组浸润性与非浸润性乳腺癌之间毛刺、瘤细胞增殖因子(Ki-67)和基底细胞角蛋白(CK5/6),时间-强度曲线(time-intensity curve, TIC)类型(Ⅰ型为流入型,Ⅱ型为平台型,Ⅲ型为流出型)差异均有统计学意义(P均<0.05),见表1;验证组毛刺、Ki-67和CK5/6差异均有统计学意义(P均<0.05),TIC类型差异无统计学意义(P>0.05),见表2。 表1 训练组浸润性与非浸润性乳腺癌比较 表2 验证组浸润性与非浸润性乳腺癌比较 2.2 构建影像组学标签及其鉴别效能 2名医师(ICC=0.81)及同名医生(ICC=0.89)提取病灶纹理特征的一致性均较好(P均<0.05)。共提取3 132个影像学特征、826个特征参数,经降维最终获得19个价值较高特征(表3),其中8个基于DWI、6个基于DCE-MRI、5个基于STIR T2WI,用于构建影像组学标签(图2)。训练组和验证组浸润性与非浸润性乳腺癌 rad-score[分别为(1.69±0.77)分、(1.27±1.45)分与(0.26±0.72)分、(-2.05±6.08)分]差异均有统计学意义(t=9.99、2.48,P均<0.05)。 图2 LASSO回归分析选择鉴别浸润性与非浸润性乳腺癌的特征 A.以最小化标准10倍交叉验证选择调整参数λ特征集变化图; B.调整参数λ与LASSO筛选特征的变化图 表3 训练组诊断价值较高特征 2.3 影像组学模型及其诊断效能 多因素Logistic回归分析结果显示,CK5/6、Ki-67和影像组学标签为浸润性乳腺癌的独立危险因素(表4),据以构建模型。经Hosmer-Lemeshow检验,模型拟合效果较好(χ2=0.93,P=0.32),鉴别训练组和验证组浸润性与非浸润性乳腺癌的AUC分别为0.97和0.85,均高于CK5/6、Ki-67和影像组学标签单一变量,见表5~6及图3。 表4 训练组浸润性乳腺癌的多因素Logistic回归分析 表5 训练组独立危险因素及影像组学模型鉴别浸润性乳腺癌的ROC曲线分析结果 表6 验证组独立危险因素及影像组学模型鉴别癌浸润性乳腺的ROC曲线分析结果 图3 影像组学模型鉴别浸润性乳腺癌的ROC曲线 A.训练组; B.验证组 术前准确诊断乳腺癌浸润性具有重要意义。目前鉴别浸润性乳腺癌主要依靠病理检查,但术前穿刺组织病理活检难以全面反映肿瘤信息,且存在一定假阴性率;对活检组织进行免疫组织化学检查能显示与肿瘤细胞增殖、侵袭密切相关的CK5/6、Ki-67、雌激素受体等生物学因子表达[8-10],有助于诊断浸润性乳腺癌,但可重复性较低[11]。MRI软组织分辨率高,能多方面综合分析乳腺癌,评价浸润性乳腺癌较超声和钼靶检查更敏感[12],是术前判断乳腺癌浸润性的主要方法;但浸润性与非浸润性乳腺癌MRI表现存在一定重叠,且结果存在一定主观性。影像组学通过深度挖掘影像学数据而定量分析肿瘤异质性,已受到广泛关注[13-14],对鉴别良恶性乳腺肿瘤及评价乳腺癌分子分型具有一定价值[15-16]。BALAJI等[17]基于钼靶纹理分析的研究结果显示,X线纹理分析能用于区分乳腺浸润性癌和导管内癌。 多种临床及影像学特征有助于判断乳腺癌的侵袭性,包括病变大小、内部特征、边缘强化、扩散特征及生物学因子等,但单一变量难以全面反映肿瘤的复杂性。本研究纳入多个侵袭性乳腺癌相关临床及影像学变量,发现训练组中CK5/6、Ki-67和rad-score是鉴别浸润性和非浸润性乳腺癌的独立危险因素,而验证组中浸润性和非浸润性乳腺癌TIC类型差异无统计学意义,可能为选择偏倚或验证组样本量较少导致;联合CK5/6、Ki-67和rad-score影像组学模型鉴别浸润性乳腺癌优于单一变量。 本研究的主要局限性:①为单中心回顾性研究,存在选择偏倚;②样本量较小,可能导致结果偏差;③未经多中心研究验证。 综上,基于MRI影像组学模型鉴别浸润性与非浸润性乳腺癌效果较好。2 结果






3 讨论

