CDX2基因高表达对胃癌细胞生物学行为的影响
秦 蓉 储 婧 陈宗科 陈晓双 王娜娜
(安徽医科大学基础医学院病理教研室,合肥230032)
胃癌是源于胃黏膜上皮的恶性肿瘤,发病率居我国恶性肿瘤首位,近年来,大量研究已证实胃癌的发生、发展和预后是多基因改变的结果。尾侧型同源转录因子-2(caudal type homeobox transcription factor-2,CDX2)是人体中肠道特异性表达的核转录因子,在肠黏膜上皮细胞的发育及保持其形态、结构特征中起着重要作用[1]。CDX2蛋白在正常胃黏膜中无表达,在绝大多数胃黏膜肠化生中呈阳性表达[2,3],提示 CDX2蛋白在胃黏膜细胞中的异常表达是发生胃黏膜肠化生的重要起始事件。CDX2在从肠化生到胃癌的发展过程中发挥着重要的作用[4],被认为是与肠型胃癌发生密切相关的关键调节因子。本课题的前期研究表明CDX2的表达与胃癌分化程度、淋巴结转移、临床分期及患者预后密切相关[5]。为了进一步明确CDX2基因在胃癌中的作用,本研究通过建立稳定过表达CDX2基因的胃癌细胞株,应用分子克隆、RT-PCR、Western blot、MTT、流式细胞等分子生物学技术,在体外实验中研究CDX2过表达对胃癌细胞生物学行为的影响,试图揭示CDX2基因在胃癌的发生发展中发挥的作用,从而为CDX2的基因治疗提供理论依据。
材料和方法
1.主要试剂
DMEM培养液购自美国Hyclone公司,胎牛血清购自杭州四季青公司,胰酶购自碧云天生物技术公司,质粒小量抽提试剂盒、高保真扩增酶、Trizol RNA抽提试剂购自美国Invitrogen公司,Attractene Transfection Reagent购自德国 QIAGEN 公司,MTT购自Sigma公司,兔抗人CDX2抗体购自Signalway antibody(SAB)公司,S-P免疫组化检测试剂盒、DAB显色试剂盒购自福州迈新生物技术开发有限公司,ECL+plus试剂盒购自Amersham公司,PI染色试剂盒为南京凯基公司产品。
2.细胞株和质粒
人胃癌细胞株BGC-823细胞株为本实验室保存,用10%的小牛血清的DMEM培养液于37℃,5%的CO2饱和湿度孵箱内培养。pcDNA4/TO/Myc-HisA-CDX2载体质粒由日本广岛大学细胞生物学研究部Dr.Shuho Semba馈赠。
3.CDX2重组真核表达质粒的鉴定、扩增和提取
将重组真核表达质粒pEGFP-C1经EcoRI和BamHI双酶切鉴定正确,并经测序与GenBank中的序列完全一致,转化DH5a感受态细菌,涂板,挑选单克隆后扩增。采用Invitrogen公司的质粒小提试剂盒从大肠杆菌中抽提质粒,操作方法详见说明书,用紫外分光光度仪测定OD260/280比值来计算DNA的浓度及纯度,-20℃保存。
4.瞬时转染及鉴定
BGC-823人胃癌细胞株常规培养,按1×106/孔接种在6孔板中,待细胞达到80%融合后,在细胞生长状态良好的情况下进行转染。转染按QIAGEN公司 Attractene Transfection Reagent转染试剂盒说明书进行,实验分组:①阴性对照组:只接种细胞,未转染质粒;②空载体对照组:转染pEGFPC1;③实验组:转染pEGFP-C1-CDX2。荧光倒置显微镜下观察载体中增强型绿色荧光蛋白的表达,判断转染效率。
5.重组质粒转染及筛选
选取生长状态良好的处于对数生长期的BGC-823细胞,胰酶消化,重悬,以2×105/孔的密度接种于6孔板中,等待细胞铺满孔70%-80%时,使用Attractene Transfection Reagent转 染 试 剂 介 导pEGFP-C1-CDX2质粒转染 BGC-823细胞。待转染24h后,按照1∶4的比例传代,接种于24孔板中,细胞贴壁以后加入含有400μg/ml G418的完全培养基,培养8h后,以200μg/ml G418的完全培养基培养,直至筛选出克隆(大约20-25d)。挑选出克隆继续扩大培养,筛选出稳定细胞株,将其命名为BGC-823/CDX2。以转染空载体pEGFP-C1及未转染组为对照。
6.转基因细胞中目的基因表达鉴定
①半定量RT-PCR:从转基因细胞中提取总RNA,经 M-MLV逆转录合成cDNA。取3μl cDNA进行PCR扩增,按常规操作进行。②Western blot检测:收集转基因细胞,经蛋白裂解液提取蛋白,BCA法进行定量。分别取30μg蛋白经SDSPAGE,电转移至硝酸纤维膜上,以50g/l脱脂奶粉室温封闭2h。TBST漂洗3次(5-10min/次),加入兔抗CDX2抗体(1∶200稀释)室温孵育2h。TBST漂洗同前,辣根过氧化酶标记的羊抗兔IgG(1∶400稀释)室温孵育1h,TBST漂洗同前,DAB显色,分析条带灰度值及蛋白含量。③免疫细胞化学检测:将转染重组质粒组、空载体组和未转染组BGC-823细胞常规消化,进行细胞爬片,同时以PBS代替一抗作空白对照,3%过氧化氢阻断内源性过氧化物酶活性,PBS冲洗,血清封闭,滴加一抗(兔抗人CDX2多克隆抗体,浓度为1∶100),PBS冲洗后滴加HRP标记的二抗,DAB显色5 min,苏木素复染细胞核,二甲苯透明,中性树胶封片。显微镜下观察并照相。
7.细胞生长曲线测定(MTT法)
分别将1×104BGC-823/CDX2组、空载体组和未转染组细胞置于96孔板中,细胞生长过夜后,取20μl MTT 溶液 (5mg/ml)加入96 孔板中,37℃ 继续培养4h,吸去上清液,加入200μl DMSO充分溶解细胞内结晶,采用酶标仪测定A490nm值,连续7d,绘制生长曲线。
8.流式细胞仪法检测
CDX2基因转染对BGC-823细胞凋亡的影响根据Annexin-FITC/PI双标记试剂盒说明操作。每个样本收集20000个细胞荧光信号。
9.细胞划痕实验
取生长良好的三组细胞,消化至六孔板中,贴壁后对细胞进行划痕,每孔划一次,宽度和长度在lmm×20mm左右,每组设3个复孔,每孔选取5段观测。用无血清DMEM培养基轻轻吹打划痕附近,吸去培养基,反复3次,将刮掉的细胞冲洗干净。拍照,并标记0h的拍照位点。每孔加入适量含10%胎牛血清的DMEM继续培养。分别于24h、48h拍照记录,观察每组细胞的迁移程度。
10.基因芯片技术检测
采用 Affymetrix Human Genome U133Plus 2.0Array基因芯片,及其试剂盒所建议的检测方法。依据检测结果和Affymetrix所建议的方法,iterPlier计算核心基因表达读数计算值(芯片读数计算值)。以上RNA质量和芯片检测委托先进通量(上海)生物技术有限公司(Advanced Throughput Inc.(SH))完成。
11.统计学分析
用SPSS13.0统计软件包进行统计学处理。数据以¯x±s表示,多样本组间比较用方差分析,两两比较采用SNK法,即q检验。检验水准α=0.05,P<0.05,差异有统计学意义。
结 果
1.重组真核表达质粒pEGFP-C1-CDX2双酶切鉴定结果
pEGFP-C1-CDX2质粒经EcoRI和BamHI双酶切后得到约5kb的pEGFP-C1载体条带和1kb的CDX2目的基因条带(图1)。

图1 阳性克隆双酶切鉴定。Fig.1Electrophoresis of EcoRI and BamHI restriction enzymed for positive clone.
2.CDX2基因转染BGC-823细胞鉴定
pEGFP-C1-CDX2载体上带有报告基因增强型绿色荧光蛋白,转染48h后在荧光倒置显微镜下观察,CDX2基因成功瞬时转染人胃癌细胞株BGC-823,转染效率50%左右(图2)。

图3 RT-PCR检测人胃癌BGC-823细胞CDX2mRNA表达。1.BGC-823空白细胞组 2.BGC-823/EV组 3.BGC-823/CDX2转染组图4 Western blot检测人胃癌BGC-823细胞CDX2蛋白表达。1.BGC-823空白细胞组2.BGC-823/EV组3.BGC-823/CDX2转染组Fig.3The expression levels of CDX2mRNA and protein in human gastric carcinoma BGC-823cells transfected with recombinant expression vector pEGFP-C1-CDX2were detected by RT-PCR.1:BGC-823group,BGC-823cells transfected without plasmid;2:BGC/EV group,BGC-823cells transfected with empty vector pEGFP-C1;3:BGC-823/CDX2group,BGC-823cells transfected with recombinant expression vector pEGFP-C1-CDX2.Fig.4The expression levels of CDX2protein in human gastric carcinoma BGC-823cells transfected with recombinant expression vector pEGFP-C1-CDX2were detected by Western blotting.1.BGC-823group,BGC-823cells transfected without plasmid;2.BGC-823/EV group,BGC-823cells transfected with empty vector pEGFP-C1;3.BGC-823/CDX2group,BGC-823cells transfected with recombinant expression vector pEGFP-C1-CDX2.
3.CDX2基因表达的鉴定
①半定量RT-PCR检测:与对照细胞相比,BGC-823/CDX2转染组细胞中CDX2的mRNA水平明显升高。经特异性引物扩增在961bp处出现单一条带,表明CDX2基因已被成功导入细胞,筛选正确(图3)。②Western blot分析:经 Western blot检测,CDX2蛋白在BGC-823/CDX2转染组细胞中出现明显条带,与CDX2蛋白分子质量一致,表明CDX2基因已经转入靶细胞,蛋白呈高表达,而对照细胞呈极微量表达(图4)。③免疫细胞化学检测:用CDX2特异抗体检测BGC-823/CDX2转染组细胞蛋白的表达,结果显示:BGC-823转染组细胞呈棕褐色,说明CDX2蛋白在该细胞中呈高表达,主要表达于细胞核内,胞质中呈散在分布(图5)。
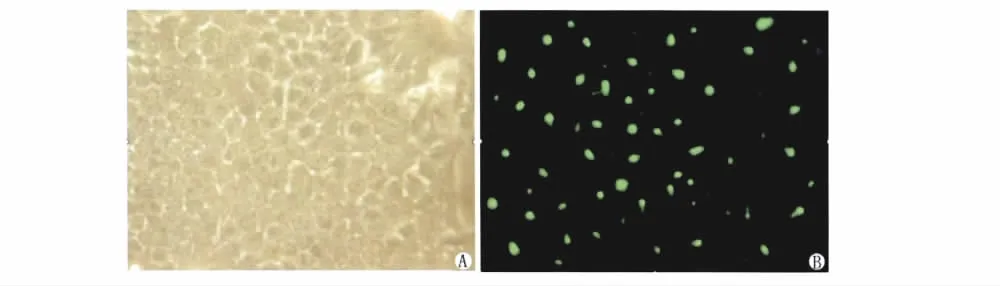
图2 检测pEGFP-C1-CDX2转染人胃癌BGC-823细胞的转染效率。A.倒置显微镜下观察BGC-823/CDX2转染组(×200);B.荧光显微镜下观察BGC-823/CDX转染组(×200)Fig.2Efficiency of transient pEGFP-C1-CDX2transfection into human gastric carcinoma BGC-823cells.A.BGC-823/CDX2group,BGC-823cells transfected with recombinant expression vector pEGFP-C1-CDX2,observed under an inverted-phase contrast microscope,×200.B.BGC-823/CDX2group,BGC-823cells transfected with recombinant expression vector pEGFP-C1-CDX2,observed under an inverted fluorescence microscope,×200.
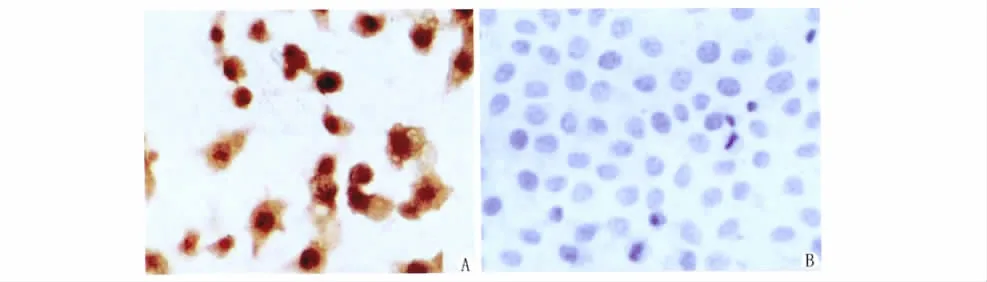
图5 细胞免疫组化检测人胃癌BGC-823细胞CDX2蛋白表达。A.BGC-823/CDX2转染组(×400);B.BGC-823空白细胞组(×400)Fig.5The expression levels of CDX2protein in human gastric carcinoma BGC-823cells transfected with recombinant expression vector pEGFP-C1-CDX2were detected by immunohistochemistry.A.BGC-823/CDX2group,BGC-823cells transfected with recombinant expression vector pEGFP-C1-CDX2(×400);B.BGC-823group,BGC-823cells transfected without plasmid(×400).
4.细胞生长曲线测定(MTT法)结果
应用MTT显色法检测转基因前后BGC-823细胞生长情况,绘制生长曲线(图6),与对照细胞相比,BGC-823/CDX2转染组细胞增殖能力明显降低,第3d差异最明显。

图6 MTT法检测CDX2基因过表达对人胃癌BGC-823细胞体外增殖能力的影响Fig.6The effect of overexpression of CDX2gene on proliferation of human gastric carcinoma BGC-823cells was detected by MTT method.BGC-823/CDX2group:BGC-823 cells transfected with recombinant expression vector pEGFPC1-CDX2;BGC-823/EV group:BGC-823cells transfected with empty vector pEGFP-C1;BGC-823group:BGC-823 cells transfected without plasmid.There was no significant difference in proliferation between BGC-823/EV group and BGC-823group.The proliferation ability of BGC-823/CDX2 group was significantly inhibited.*P<0.05,vs the BGC-823/EV group and BGC-823group(n=3).
5.流式细胞仪检测细胞凋亡(图7)
凋亡标记物Annexin-V和propidium iodide染色显示(包括早期凋亡和晚期凋亡)相比较于BGC-823/EV组,BGC-823/CDX2转染组在凋亡率上差异没有统计学意义(P>0.05),值得注意的是,相比较于空白细胞组,BGC-823/CDX2转染组细胞可见早晚期凋亡增加,亦发现少量细胞死亡,但差异无统计学意义(P>0.05)。?
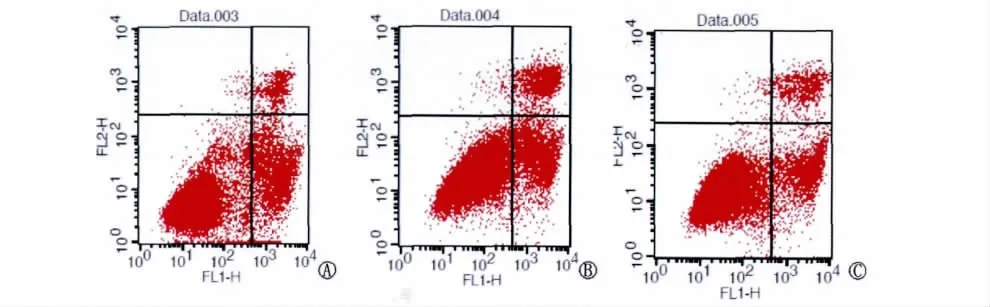
图7 流式细胞术检测CDX2过表达对人胃癌BGC-823细胞凋亡的影响。A.空白细胞组BGC-823;B.BGC-823/EV组;C.BGC-823/CDX2转染组Fig.7The effect of over-expression of CDX2gene on apoptosis of human gastric carcinoma BGC-823cells was detected by flow cytometry.A.BGC-823group,BGC-823cells transfected without plasmid;B.BGC-823/EV group,BGC-823cells transfected with empty vector pEGFP-C1;C.BGC-823/CDX2group,BGC-823cells transfected with recombinant expression vector pEGFP-C1-CDX2.
转染CDX2基因对BGC-823细胞迁移能力的影响细胞划痕实验显示,划痕0h时细胞贴壁良好,划痕完全,划痕处无细胞贴壁或悬浮;划痕24h后,与BGC-823空白细胞组和 BGC-823/EV 组相比,BGC-823/CDX2转染组的愈合速度明显减慢;48h时,BGC-823空白细胞组和 BGC-823/EV 组的细胞已基本愈合,而BGC-823/CDX2转染组仍然存在间隙。3次重复实验均表明BGC-823/CDX2转染组的细胞迁移能力(迁移细胞计数)在划痕48h后明显低于空白细胞组和 BGC-823/EV 组(P<0.05,图8)。说明CDX2高表达抑制了BGC-823细胞运动迁移的能力。

图8 CDX2基因过表达对人胃癌BGC-823细胞体外迁移能力的影响。8A、8D、8G.空白细胞组BGC-823;8B、8E、8H.BGC-823/EV 组;8C、8F、8I.BGC-823/CDX2转染组;8A、8B、8C.0h 倒置显微镜下观察;8D、8E、8F.24h倒置显微镜下观察;8G、8H、8I.48h倒置显微镜下观察Fig.8The effects of CDX2gene over-expression on migration of human gastric cancarcinoma BGC-823cells were detected by scratch wound healing (observed under an inverted-phase contrast microscope,×100)assays.8A,8D,8G.BGC-823 group,BGC-823cells transfected without plasmid;8B,8E,8H.BGC-823/EV group,BGC-823cells transfected with empty vector pEGFP-C1;8C,8F,8I.BGC-823/CDX2group,BGC-823cells transfected with recombinant expression vector pEGFPC1-CDX2;**P<0.05,vs the control group and the blank group(n=3).7A,7B,7C.observed under an inverted-phase contrast microscope at 0hour,×100;8D,8E,8F.observed under an inverted-phase contrast microscope at 24hour,×100;8G,8H,8I.observed under an inverted-phase contrast microscope at 48hour,×100.
7.肿瘤相关基因表达的基因芯片分析
基因芯片分析发现了两组细胞BGC-823/EV和BGC-823/CDX2间的差异表达基因(以表达差异≥2.0或≤0.5倍为限)共478条,其中上调基因215条,如 GATA-6、RUNX-3、CLDN-7、CLDN-1、SPON2、ERBB3等;下调基因263条,如 DKK3、FOXP1、GATA3、SOX7、THY1、TWIST1、CD24等。经过分析,这些差异基因与细胞的增生、分化、侵袭转移和细胞信号转导密切相关。
讨 论
CDX2录属于尾相关性同源盒基因家族,属于肠特异性的转录因子,最早CDX2基因及其相关蛋白在果蝇中分离成功,发现与parahox家族是呈高度同源性[6]。近年来人体染色体的研究表明,CDX2基因的全长22-23kb,位于染色体的13q12-13,是由3个外显子和2个内合子组成,而与之相对应的CDX2蛋白包含有311个单氨基酸,其通过螺旋-环-螺旋的方式结合于DNA的相应区域,以转录因子的形式调节着DNA的表达[7]。CDX2在人体组织细胞中正常只是表达于肠上皮、胰腺导管以及腺泡上皮内,而在食管以及胃上皮中是不表达的[8]。
本研究中克隆并构建了特异性真核表达载体pEGFP-C1-CDX2,经双酶切鉴定和测序证实后,采用脂质体法将其转染至CDX2低表达胃癌细胞株BGC-823,经G418筛选得到抗性细胞克隆,并进一步扩大培养。经RT-PCR检测显示,与对照细胞相比较,BGC-823/CDX2转染组细胞中CDX2基因在mRNA水平上的表达明显上调;Western blot和免疫细胞化学检测均显示,转染组细胞中CDX2蛋白的表达明显增高,表明pEGFP-C1-CDX2重组载体已转入BGC-823细胞,从而成功地建立了CDX2基因的高表达体系。
该课题通过MTT细胞增殖实验的研究,结果发现:相比较于空白细胞组和空载体组的胃癌细胞,将CDX2导入胃癌细胞BGC-823中后,胃癌细胞的生长受到了较为明显的抑制。Mallo GV等[9]研究了人结肠癌细胞HT-29和Caco-2,发现这两种细胞系中的CDX2的高表达导致了细胞生长率相对于对照组相比下降。CDX2抑制HT-29细胞增殖的机制可能是通过诱导细胞周期依赖性蛋白激酶抑制剂CDK1p21/WAFI/CIP的表达[10]。最近也同样有研究报道证实CDX2可以诱导大鼠IEC-6细胞中的肝磷脂结合表皮生长因子样生长因子(heparinbinding EGF-like growth factor)的表达,并且抑制IEC-6细胞的增殖。在胰腺癌中,已有很多研究报告指出Cyclin D1作为一个关键性的基因参与胰腺癌细胞的增殖和分化[11],CDX2通过结合核因子NF-κB的结合位点来抑制Cyclin D1的转录活性,从而抑制胰腺癌细胞的增殖。
该研究中还发现相对于空白细胞组和空载体组细胞,稳定转染组胃癌细胞的迁移能力明显减弱,本课题组在体内研究也曾发现胃癌组织中CDX2的表达与淋巴结转移负相关。同源盒基因的表达改变将导致细胞迁移和转移的变化,这一结论已经在多种肿瘤类型 中 有 相 关 的 报 道[12-14]。Hegde等[15]究 证实CDX2的缺失增加了人结直肠癌细胞的迁移,并引起上皮细胞的上皮间叶转变(epithelial to mesenchymal transition,EMT),从而使癌细胞的运动能力明显增长。有学者证实在结肠癌细胞中导入外源性CDX2基因后,能够明显抑制结肠癌细胞的侵袭能力,这些实验数据都证实了CDX2的表达在肿瘤侵袭转移上扮演一定的角色。
该课题利用流式细胞仪检测CDX2对胃癌细胞凋亡的影响时发现,相比较于空白细胞组和空载体组细胞,稳定转染细胞组BGC-823/CDX2的早、晚期凋亡率都有所增加,但差异无统计学意义。有学者研究CDX2对大肠癌Lovo细胞凋亡率影响时发现,相比较于转染空载体的Lovo细胞,转染CDX2的大肠癌细胞的凋亡率没有出现很明显的区别,但是相比较于空白细胞组,转染空载体组和转染目的基因组的细胞的凋亡率有一个很小范围的增长[16]。其他学者的研究实验结果表明CDX2能够抑制人结肠癌细胞株SW480和HCT-116细胞增殖,诱导其分化成熟,增加细胞凋亡,增强自噬活性[17]。
CDX2基因稳定转染胃癌细胞系BGC-823后引起了许多功能各异的基因的表达上/下调,这些差异表达基因的功能涉及许多个方面,包括与细胞的增生、分化、侵袭转移和细胞信号转导等。这些上/下调基因表与CDX2基因之间的关系还需进一步的研究,本研究为下一步的功能研究提供了一些新的线索。
研究结果表明,CDX2过表达明显抑制胃癌细胞增殖,降低迁移能力,促进细胞凋亡,提示CDX2基因在胃癌发生发展中扮演着抑癌基因的角色。因此,在基因治疗中,CDX2可以被视为一个潜在的治疗靶点,为CDX2参与胃癌的基因治疗提供了有力的依据。
[1]Boudreau F,Rivard N,Gendron FP,et al.CDX2:a transcription factor with mμltiple tasks for epithelial cells of the digestive tract.Med Sci(Paris),2007,23(1):7-8
[2]Paik CH,Han DS,Lee SH,et al.Expression of CDX-2homeobox gene in intestinal metaplasia and gastric adenocarcinoma.Gastric Cancer,2006,9(3):156-166
[3]Mesquita P,Jonckheere N,Almeida R,et al.Human MUC2mucin gene is transcriptionally regμlated by Cdx homeodomain proteins in gastrointestinal carcinoma cell lines.J Biol Chem 2003,278(51):51549-56.
[4]刘贵生,龚均,程鹏等.肠特异性转录因子CDX2在不同亚型肠化生及胃癌组织中的表达.癌症,2006,25(2):185-189
[5]王娜娜,秦蓉,储婧等.CDX2在胃癌及癌前病变组织中的表达及其临床意义.中国组织化学与细胞化学杂志,2010,19(6):597-603
[6]Beck F,Chawengsaksophak K,Luckett J,et al.A study of regional gut endoderm potency by analysis of CDX2null mutant chimaeric mice.Devel Biol,2003,255(2):399-406
[7]方义湖,来茂德.结直肠肿瘤的新标记—CDX2.国际遗传学杂志,2006,29(4):311-316.
[8]Werling RW,Yaziji H.Bacchi CE,et a1.CDX2,a highly sensitiveand specific marker of adenocarcinomas of intestinal origin:an immunohistochemical survey of 476primary and metastatic carcinomas.Am J Surg Pathol,2003,27(3):303-310.
[9]Mallo GV,Soubeyran P,Lissitzky JC,et al.Expression of Cdx1and Cdx2hemeotic genes leads to reduced malignancy in colon cancer-derived cells.J Biol Chem,1998,273(22):14030-14036
[10]Bai YQ,Miyake S,Iwai T,et al.CDX2,a hemmeobox transcription factror,upregulates transcription of the p21/WAF/CIP1gene.Oncogene,2003,22(39):7942-7949
[11]Biliran H Jr,Wang Y,Banerjee S,et al.Overexpression of cyclin D1promotes tumor cell growth and confers resistance to cisplatin-mediated apoptosis in an elastase-myc transgene-expressing pancreatic tumor cell line.Clin Cancer Res,2005,11(16):6075-6086
[12]Bakaris S,Cetinkaya A,Ezberci F,et al.Expression of homeodomain protein CDX2in colorectal adenoma and adenocarcinoma.Histol Histopathol,2008,23(9):1043-1047
[13]Gross I,Duluc I,Benameur T,et al.The intestinespecific homeobox gene Cdx2decreases mobility and antagonizes dissemination of colon cancer cells.Oncogene,2008,27:107-115
[14]Ee HC,Erler T,Bhathal PS,et al.Cdx-2homeodomain protein expression in human and rat colorectal adenoma and carcinoma.Am J Pathol,1995,147(3):586-592
[15]Hegde SR,Dang LH,Dang DY,et al.Loss of CDX2
increases migration and induces changes consistent with epithelial to mesenchymal transition in human colon cancer cells.Gastroenterology,2008,134(4):1-6
[16]Zheng JB,Sun XJ,Qi J.Effects of homeodomain protein CDX2expression on the proliferation and migration of Lovo colon cancer cells.Pathol Oncol Res,2011,17(3):743-751
[17]Tanaka S,Saito K,Ito T,et al.CDX2as a useful marker of colorectal adenocarcinoma metastases to lung in pre-operative biopsy specimens.Oncol Rep,2007,18(1):87-92

