人EGFR显性负性突变体抑制胃癌细胞促血管形成能力
廖 刚 王子卫* 张 能 董浦江 汤为学
(1重庆医科大学附属第一医院胃肠外科,重庆400016;2云南省第一人民医院普通外科,昆明650032;3重庆医科大学附属第一医院实验研究中心;4重庆医科大学基础医学院病理生理学教研室,重庆400016)
人表皮生长因子受体(epidermal growth factor receptor,EGFR)属于酪氨酸蛋白激酶型受体,由三部份构成,分别为胞内区、跨膜区及胞外区,其配体或者其他的酪氨酸激酶受体通过与其结合形成二聚体,激活包含在胞内区内的酪氨酸激酶区,活化一系列信号通路下游基因,在肿瘤发生发展中起着不可替代的作用[1]。人EGFR显性负性突变体(Dominant negative EGFR,DNEGFR)缺 失 EGFR 的胞内区,有阻断EGFR信号通路的功能。血管形成是实体肿瘤生长的基本条件[2],一般的实体肿瘤细胞均具备有促血管形成能力。因而,抑制肿瘤血管形成是近年来肿瘤生物治疗的重要研究方向。胃癌属于实体瘤,当然也不例外。DNEGFR是否能够抑制人胃癌细胞促血管形成能力?以及具体分子机制是什么?目前未见相关报道。
材料和方法
1.材料
1.1细胞及裸鼠
人脐静脉内皮细胞(human umbilical vein endothelial cell,HUVEC),小鼠胚胎成纤维细胞NIH/3T3,人胃癌细胞株SGC-7901及NCI-N87,中国科学院细胞库。pEGFP-N1质粒稳定转染的SGC-7901及NCI-N87细胞,稳定表达增强型绿色荧光 蛋 白 (enhanced green fluorescence protein ,EGFP);pEGFPN1-DNEGFR 质 粒 稳 定 转 染 的SGC-7901及 NCI-N87细胞,稳定表达 DNEGFR;均由本文著者前期实验筛选成功保存[3]。雄性裸鼠在重庆医科大学实验动物中心购买。
1.2主要试剂、耗材及仪器
PV-9000二步法免疫组化检测试剂(即用型),浓缩型DAB试剂盒,北京中杉金桥生物技术公司。苏木素,美国Sigma-Aldrich公司。RPMI-1640培养基粉末,胰酶,G418,美国Invitrogen公司。人血管内皮 生 长 因 子 (vascular endothelial growth factor,VEGF)免疫测定试剂盒(目录号:DVE00),美国R&D Systems公司。兔抗小鼠CD34抗体,北京博奥森生物技术公司。CO2培养箱,美国Thermo Fisher Scientific公司。全自动酶标仪,美国Bio-Rad公司。生物组织全自动脱水机,上海西域机电系统公司。石蜡包埋机及切片机,德国LEICA公司。
2.方法
2.1实验分组
实验设立如下6组:(1)pEGFPN1-DNEGFR质粒稳定转染SGC-7901细胞组(DS组),(2)pEGFPN1-DNEGFR质粒稳定转染 NCI-N87细胞组(DN 组),(3)pEGFP-N1质粒稳定转染 SGC-7901细胞组 (ES 组),(4)pEGFP-N1质粒稳定转染NCI-N87细胞组(EN 组),(5)SGC-7901细胞对照组(即未转染SGC-7901细胞组,US组),(6)NCIN87细胞对照组(即未转染NCI-N87细胞组,UN组)。
2.2细胞培养
US及UN组细胞培养于RPMI1640完全培养基(10%胎牛血清),在5%CO2、37℃条件的CO2孵箱中进行常规培养,每天均定时观察细胞生长情况,使用0.25%的胰酶消化进行传代培养。稳定转染的SGC-7901细胞和NCI-N87细胞分别采用150 μg/ml和250μg/ml G418终浓度的完全培养基进行维持培养。
2.3HUVEC管腔结构形成实验
采用HUVEC管腔结构形成实验检测体外促血管形成能力[4-7]。制备胃癌细胞条件培养基-20℃冰箱冻存备用,取出冻存的 Matrigel Matrix,放置于4℃冰箱待其缓慢融化,用4℃预冷的RPMI 1640稀释 Matrigel Matrix(Matrigel Matrix:RPMI 1640=1∶3)。将24孔板用稀释的 Matrigel Matrix铺板(100μl/孔),胰酶消化收获90-95%汇合的HUVEC细胞后接种至24孔板(1×105个细胞/孔),加入条件培养基(1ml/孔),放入CO2孵箱孵育6h。在倒置显微镜下观察并采集图像(×200)。用Image-Pro Plus 6.0软件测量形成管腔的总长度,计算平均值。
2.4VEGF蛋白检测
采用酶联免疫吸附测定法 (Enzyme-linked immunosorbent assay,ELISA)检 测 培 养 液 中 的VEGF蛋白水平[8]。分别消化收获人胃癌细胞到离心管中,用不含抗生素的完全培养基调到5×104个/ml,加至6孔板中(2ml/孔),放到CO2孵箱内培养48h。收取培养液离心5min(1,000r/min),吸取上清用于ELISA测定,同时对细胞进行消化计数。根据试剂盒说明书进行操作,全自动酶标仪检测570nm波长下的OD值,最后根据OD值和细胞数目计算蛋白含量。
2.5裸鼠皮下移植瘤生长能力测定
分别消化收获每组人胃癌细胞到离心管中,离心后吸弃培养液,加入适量PBS混匀后离心后吸弃,然后用PBS将细胞调至密度5×106个/ml的细胞悬液。采用4周龄雄性裸鼠,用1ml注射器吸取细胞悬液对裸鼠进行皮下注射(200μl/只,6只/组)。4w后处死,剥离出皮下移植瘤测量大小,并且固定包埋切片进行HE染色和PV二步法免疫组织化学染色。皮下移植瘤体积(V)V= (a×b2)/2,a为肿瘤最长径,b为最短径[9,10]。
2.6MVD检测
微血管密度(microvessel density,MVD)采用PV即用型二步法(非生物素)检测,具体操作参照试剂说明书。采用微波热修复,兔抗小鼠CD34抗体稀释比例为1∶200。先在光学显微镜的低倍下(×100)观察并选择3个热点区(血管密集区域),然后切换至高倍下(×200)进行采图并计数血管数,平均血管数即为 MVD[11]。
3.统计学分析
实验数据均为计量资料,均采用单因素方差分析(one-way ANOVA)比较组间差异,如果经过分析有差异再运用LSD-t检验做两两比较,所有的统计学分析均使用SPSS 17.0软件完成,P<0.05有统计学意义。
结 果
1.DNEGFR抑制HUVEC管腔结构形成
对于SGC-7901细胞,DS组平均每个视野管腔结构总长度降低到28.0±0.6μm,与 US组(61.3±0.8μm)及ES组(60.8±1.0μm)比较有统计学差异(P<0.05),US组与ES组之间比较则没有统计学差异[7]。对于NCI-N87细胞,DN组平均每个视野管腔结构总长度降低到50.5±1.9μm,与US组(77.9±2.4μm)和ES组(75.8±2.3μm)相比较有统计学差异(P<0.05);UN组与EN组之间比较则没有统计学差异(图1,图2)。结果揭示DNEGFR具有抑制HUVEC管腔结构形成的作用。
2.DNEGFR抑制VEGF分泌
对于SGC-7901细胞,DS组VEGF浓度降低到487.4±11.2pg/106细胞,与 US组(871.7±13.0 pg/106细胞)和ES组(865.3±8.5pg/106细胞)比较有统计学差异(P<0.05),US组与ES组之间相比较则没有统计学差异[7];对于 NCI-N87细胞,DN组VEGF浓度降低到670.9±16.2pg/106细胞,与 US组(871.7±13.0pg/106细胞)和ES组(865.3±8.5 pg/106细胞)相比较有统计学差异(P<0.05),UN组与EN组之间相比较则没有统计学差异(图3)。

图3 VEGF的ELISA结果。Fig 3ELISA Results of VEGF.Note:*P<0.05,compared with US and ES groups;△P<0.05,compared with UN and EN groups.
3.DNEGFR抑制裸鼠皮下移植瘤生长
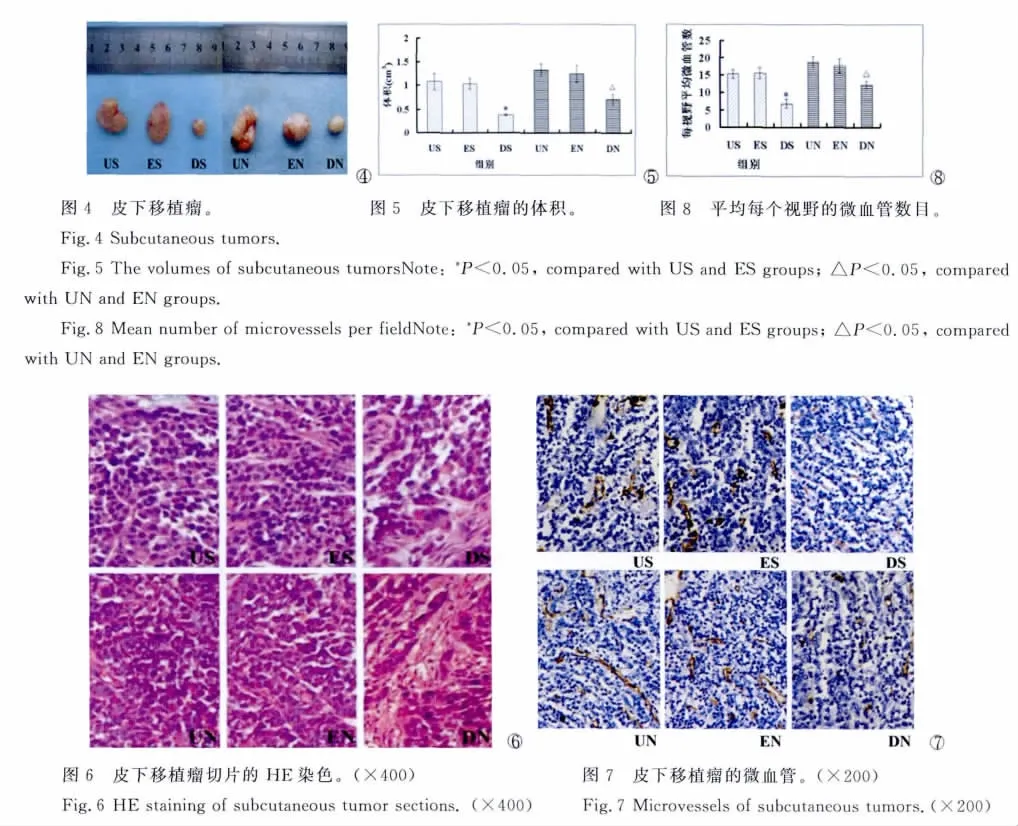
接种人胃癌细胞后,裸鼠皮下成瘤率为100%,死亡率为0。裸鼠饲养4w后处死,剥离出皮下移植瘤(图4,图5)。对于SGC-7901细胞,DS组皮下移植瘤体积降低到0.38±0.22cm3,与US组(1.07±0.17cm3)和 ES组(1.03±0.11cm3)相比较有统计学差异(P<0.05),US组与ES组之间没有统计学差异[7];对于 NCI-N87细胞,DN 组皮下移植瘤体积降低到0.70±0.11cm3,与 UN组(1.32±0.13cm3)和EN组(1.24±0.18cm3)相比较有统计学差异(P<0.05),UN组与EN组之间没有统计学差异(图5)。皮下移植瘤测量后,采用多聚甲醛固定石蜡包埋切片进行HE染色,光学显微镜下均可见核大深染的肿瘤细胞,充分证实为人胃癌细胞在裸鼠皮下成瘤(图6)。
4.DNEGFR抑制皮下移植瘤血管形成
以CD34抗体标记皮下移植瘤的微血管计数结果见图7、图8。对于SGC-7901细胞,DS组平均每个视野微血管数目降低到6.8±1.2,与US组(15.3±1.2)和ES组(15.5±1.6)相比较有统计学差异(P<0.05),US组与ES组之间没有统计学差异。对于NCI-N87细胞,DN组平均每个视野微血管数目降低到12.2±1.0,与 UN组(18.7±1.6)及EN组(17.7±2.0)相比较有统计学差异(P<0.05),UN组与EN组之间没有统计学差异。结果显示DNEGFR能够抑制细胞裸鼠皮下移植瘤血管形成。
讨 论
肿瘤细胞恶性表型主要包括:体外和体内促血管形成能力、粘附能力和运动能力、体外和体内侵袭转移能力、体外和体内生长能力等,其中促血管形成能力在肿瘤细胞的恶性表型中扮演着重要的角色,因此抑制肿瘤细胞促血管形成成为其治疗的一个新的重要途径和手段。转染pEGFPN1-DNEGFR的人胃癌细胞,将会合成融合蛋白DNEGFR-EGFP,其中EGFP仅起对DNEGFR进行定位的作用,不会影响到DNEGFR的功能;通过抑制内源性EGFR Ser 1046位点的磷酸化,DNEGFR能够负调控内源性 EGFR的功能[13]。我们采用pEGFPN1-DNEGFR稳定转染人胃癌细胞,通过表达DNEGFR达到阻断人胃癌细胞EGFR信号通路的目的,研究其对人胃癌细胞促血管形成能力的影响和分子机制。
在我们的前期实验中,我们发现DNEGFR有抑制人胃癌细胞株SGC-7901条件培养基诱导的HUVEC管腔结构形成,由于只采用一株细胞,不能证明该情况适用于其他表达EGFR人胃癌细胞株。人胃癌细胞株SGC-7901及NCI-N87均表达EGFR,因此我们在研究中进一步选用这两种细胞株并进行了裸鼠体内实验。在本实验中,我们运用HUVEC管腔结构形成实验来检测人胃癌细胞的体外促血管形成能力。实验结果揭示,DS组和DN组HUVEC形成管腔结构的总长度减少,表明DNEGFR具有抑制人胃癌细胞促血管生成能力。VEGF是血管形成所需的关键因子[14-16],据此我们推测DNEGFR通过下调人胃癌细胞VEGF的分泌来抑制血管形成。因此为了明确具体分子机制,我们采用ELISA法检测培养液中VEGF的含量。结果提示DS组及DN组培养液中VEGF含量降低,证实了我们对DNEGFR抑制胃癌细胞促血管形成能力分子机制的推测。
然而HUVEC管腔结构形成实验是体外实验,仅是间接评估肿瘤细胞促血管生成能力的标准,不能完全模拟裸鼠体内的环境,肿瘤切片的MVD才是评估的金标准[2]。为了进一步验证HUVEC管腔结构形成实验的结果,我们采用CD34抗体标记计数裸鼠皮下移植瘤的微血管,实验结果提示,DS组和DN组MVD降低,与体外HUVEC管腔结构形成实验结果一致,说明DNEGFR在体外和裸鼠体内均能抑制人胃癌细胞的促血管形成能力。血管形成是实体肿瘤生长的基本条件[2],肿瘤长大到2-3mm3体积时,即需要自身的血供来满足肿瘤细胞新陈代谢的需求[17]。DNEGFR抑制人胃癌细胞促血管形成能力,而血管形成的抑制将导致胃癌血液供应的减少,抑制胃癌的生长;胃癌生长受抑制又会导致其减少VEGF分泌,反过来抑制血管形成。
另外,除了通过旁分泌途径来促进血管形成外,VEGF还能够通过自分泌途径促进表达VEGF受体肿瘤 细 胞 的 生 长[18,19]。 因 此,DNEGFR 还 同 时通过VEGF自分泌途径抑制胃癌细胞的生长,最终导致裸鼠皮下瘤生长受到抑制,我们对裸鼠皮下瘤体积测定的结果证实了这一点。
综上所述,我们发现DNEGFR通过下调VEGF分泌抑制胃癌细胞体外和裸鼠体内促血管形成能力,最终抑制裸鼠皮下移植瘤生长。这一结果将为DNEGFR在胃癌生物治疗中进一步研究打下理论基础。然而,在肿瘤血管形成中起调控作用的细胞因子较多,在本实验中我们只研究了VEGF。是否还有其他细胞因子参与DNEGFR对人胃癌细胞促血管形成能力抑制作用的调控呢?另外,我们仅对培养液中VEGF进行检测,移植瘤中的VEGF水平是否与细胞实验结果一致,以及VEGF受体有无相应变化?这有待我们的进一步研究来明确。
[1]Patel R,Leung HY.Targeting the EGFR-family for therapy:biological challenges and clinical perspective.Curr Pharm Des,2012,18(19):2672-2679
[2]Atkin GK,Chopada A.Tumour angiogenesis:the relevance to surgeons.Ann R Coll Surg Engl,2006,88(6):525-529
[3]廖刚,王子卫,张能等.人表皮生长因子受体显性负性突变体对胃癌细胞体外侵袭转移能力的抑制作用.重庆医科大学学报,2012,37(7):574-578
[4]Lee SH,Kunz J,Lin SH,et al.16-kDa prolactin inhibits endothelial cell migration by down-regulating the Ras-Tiam1-Rac1-Pak1signaling pathway.Cancer Res,2007,67(22):11045-11053
[5]Lee JH,Lee DH,Lee HS,et al.Deguelin inhibits human hepatocellular carcinoma by antiangiogenesis and apoptosis.Oncol Rep,2008,20(1):129-134
[6]Wang Z,Banerjee S,Kong D,et al.Down-regulation of Forkhead Box M1transcription factor leads to the inhibition of invasion and angiogenesis of pancreatic cancer cells.Cancer Res,2007,67(17):8293-8300
[7]Wang Z,Liao G,Zhao L,et al.Inhibitory effects of cytoplasmic-domain substituted epidermal growth factor receptor on growth,invasion and angiogenesis in human gastric cancer cells.Molecular Medicine Reports,2010,3:287-294
[8]Ahmad A,Wang Z,Kong D,et al.FoxM1down-regulation leads to inhibition of proliferation,migration and invasion of breast cancer cells through the modulation of extra-cellular matrix degrading factors.Breast Cancer Res Treat,2010,122(2):337-46
[9]Wang S,Liu H,Ren L,et al.Inhibiting colorectal carcinoma growth and metastasis by blocking the expression of VEGF using RNA interference.Neoplasia,2008,10(4):399-407
[10]Ustach CV,Taube ME,Hurst NJ Jr,et al.A potential oncogenic activity of platelet-derived growth factor d in prostate cancer progression.Cancer Res,2004,64(5):1722-1729
[11]Chaudhary R,Bromley M,Clarke NW,et al.Prognostic relevance of micro-vessel density in cancer of the urinary bladder.Anticancer Res,1999,19(4C):3479-3484
[12]Vermeulen PB,Gasparini G,Fox SB,et al.Second international consensus on the methodology and criteria of evaluation of angiogenesis quantification in solid human tumours.Eur J Cancer,2002,38(12):1564-1579
[13]廖刚,王子卫,赵林等.人EGFR显性负性突变体负调控内源性EGFR功能的机制分析.生命科学研究,2010,14(3):203-207,239
[14]Carmeliet P.VEGF as a key mediator of angiogenesis in cancer.Oncology,2005,69Suppl 3:4-10
[15]Jain RK.Tumor angiogenesis and accessibility:role of vascular endothelial growth factor.Semin Oncol,2002,29(6Suppl 16):3-9
[16]Hicklin DJ,Ellis LM.Role of the vascular endothelial growth factor pathway in tumor growth and angiogenesis.J Clin Oncol,2005,23(5):1011-1027
[17]Folkman J.Tumor angiogenesis:therapeutic implications.N Engl J Med,1971,285(21):1182-1186
[18]Masood R,Cai J,Zheng T,et al.Vascular endothelial growth factor (VEGF)is an autocrine growth factor for VEGF receptor-positive human tumors.Blood,2001,98(6):1904-1913
[19]de Jong JS,van Diest PJ,van der Valk P,et al.Expression of growth factors,growth-inhibiting factors,and their receptors in invasive breast cancer.II:Correlations with proliferation and angiogenesis.J Pathol,1998,184(1):53-57

