微管相关蛋白tau在不同年龄大鼠海马内的定位分布特点
李 青 周金和 纪浩洋 张艳玲 蒋诗韵傅 婷 汪薇曦 张敏海 李宏莲 沈建英*
(1华中科技大学同济医学院附属同济医院第二临床学院,武汉430030; 2武汉市第六医院药剂科,武汉430015; 3华中科技大学同济医学院基础医学院组织胚胎学教研室,武汉430030)
微管系统是神经细胞骨架成分,可参与多种细胞功能。微管由微管蛋白及微管相关蛋白组成,tau蛋白是含量最高的微管相关蛋白。tau蛋白通过与微管蛋白tubulin的相互作用,将tubulin组装成微管[1],并且与形成的微管结合,维持其稳定性,降低微管蛋白分子的解离,并诱导微管成束,维持神经元的细胞形态并参与轴浆运输[2,3]。
tau蛋白为磷蛋白,其生物活性由其磷酸化程度来调控,过度磷酸化的tau蛋白与微管结合的能力降低从而破坏微管的稳定性[2]。已经发现有超过20种神经退行性疾病与tau相关[4],这些疾病中,大都存在tau蛋白异常磷酸化和聚集成为神经纤维缠结[5]。阿尔茨海默病(Alzheimer disease,AD)是最常见的中枢神经退行性疾病,患者脑中tau蛋白总量多于正常人,但正常tau蛋白减少而磷酸化的tau蛋白大量增加,过度磷酸化的tau自身聚集成双螺旋 神 经 原 纤 维 缠 结 (Neurofibrillary tangles,NFTs),微管系统被破坏,正常轴浆转运受损,突触丢失,发生脑神经元退行性病变[6]。因此,tau蛋白的含量和磷酸化水平与神经细胞的生存命运和功能丧失之间必然存在着紧密的联系。
海马位于颞叶,是大脑边缘系统的一部分,由齿状回(颗粒细胞),CA1-CA4(锥体细胞)部位以及脑下脚组成,具有学习记忆及空间定位功能,是多种有痴呆症状的神经退行性疾病重要的受累区域。
tau在神经退行性疾病发病机制中的具体作用及其机制已经有海量的文献报道,但是有许多不一致的观点,而tau在不同年龄正常大鼠脑内的分布报道不多,尤其关于其在海马内的具体分布及发育特点鲜有报道。本实验主要通过免疫组化ABC法,对大鼠正常脑组织海马区中总tau和Ser396/404位点磷酸化的tau蛋白的分布及随大鼠发育的变化趋势进行了初步的研究,并浅析了其与神经细胞分裂增殖和分化间的关系。
材料和方法
1.抗体
一抗:兔来源多克隆抗体R134d1∶30000(识别总tau,由 Drs.Iqbals馈赠,New York State Institute for basic research,Staten Island,NY,USA);单克隆PHF-1抗体1∶500(识别 Ser396/404位点磷酸化的tau,由Dr.P Davies馈赠,Albert Einstein College of Medicine,Bronx,NY,USA)。二抗:生物素化马抗小鼠IgG抗体(1∶200)和生物素化羊抗兔IgG抗体(1∶200),ABC(链霉亲和素-生物素-辣根过氧化物酶复合物,1∶200),DAB显色试剂盒均购自飞奕科技公司。
2.实验动物
SD大鼠来源于华中科技大学同济医学院实验动物中心。以雌雄比2∶1的比例合笼,次日以阴道涂片精子阳性为妊娠第1d,分别取孕18d,生后1d,1w,2w,2m 大鼠3-5只用于实验。
3.免疫组织化学SABC法
孕18d、生后1d、1w大鼠全脑经生理盐水漂洗后置入4%多聚甲醛·0.1mol/L PB浸泡固定过夜,生后2w和2m大鼠经常规心脏灌流固定(4%多聚甲醛·0.1mol/L PB),取脑后经固定液后固定过夜,常规梯度酒精脱水、透明、浸蜡,包埋、石蜡切片机切片,片厚6μm。二甲苯脱蜡,梯度酒精下行到水,自来水 冲 洗,0.01mol/L PBS 漂 洗 后,0.3%Triton破膜,10%H2O2处理30min,3%BSA·PBS封闭30min。加入一抗PHF-1(1∶500)或者R134d(1∶30000),置于湿盒中4℃孵育48-72h,复温2h,用0.01mol/L PBS漂洗10min×3次,加入二抗,生物素化羊抗兔IgG抗体(1∶200)或者生物素化马抗小鼠IgG抗体(1∶200),置于湿盒中常温孵育2h,用0.01mol/L PBS漂洗10min x 3次;滴加SABC复合物(1∶200),置于湿盒中常温孵育2h,用0.01mol/L PBS漂洗10min×3次,DAB试剂盒显色10-15min,自来水冲洗1-2min,0.01mol/L PBS漂洗10min×3次;苏木素复染5s,立即用自来水冲洗5min,置于通风橱中风干,梯度酒精脱水,二甲苯透明,树脂封片。
结 果
1.大鼠大脑皮质和海马的发育演变过程
低倍镜显示从孕18d到出生后2m,大鼠大脑皮质和海马的发育演变过程及海马的外形演变过程。孕18d大鼠大脑皮质锥体细胞带与海马CA区的锥体细胞带相连,大脑两侧半球相互靠拢,脑室尚未闭合,海马的CA分区已经基本形成;出生1d大鼠大脑两侧半球完全并拢,脑室闭合,大脑皮质与海马之间被胼胝体分隔。随着脑的发育,大脑皮质的锥体形神经细胞由密集排列成细胞带到逐渐分散,海马CA区的神经元数量逐渐减少,CA1区细胞带变窄(图1,2),这些结果说明,在胚胎期,大鼠脑内神经细胞数量较多,随着脑的发育,神经细胞数量逐渐减少。
2.总tau(R134d)阳性产物在不同年龄大鼠海马内的分布及变化趋势
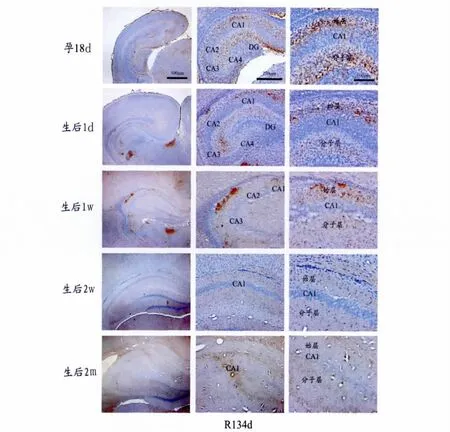
图1 不同发育阶段大鼠海马内R134d阳性产物的表达及分布。Fig.1Expression and distribution of R134dpositive substance in hippocampus of rats with different developmental stages
Fig1为孕18d、生后1d、1w、2w和2m大鼠脑冠状切片,用免疫组织化学ABC法,以抗体R134d显示总tau的表达和分布。左侧低倍镜显示,R134d阳性产物为棕黄色颗粒状,孕18d、生后1d和1w大鼠海马内有丰富的阳性物质表达,而生后2w和2m其表达量明显下降,甚至不易见。高倍镜显示前三个时间段,海马内阳性产物主要表达在海马各区神经细胞周围,在胚胎期各区表达较均匀,在海马始层和分子层均有表达,强度无明显差异。生后1d和1w则显示阳性产物主要分布在海马CA1和CA2区始层,而这部分主要是锥体细胞轴突的分布区域,因此也证实了正常情况下tau主要分布于神经元轴突内,树突甚至胞核内也有少量分布;但是在生后1d的大鼠海马CA3区,其分布于分子层的阳性产物多于始层,可能由于此区内含有较多齿状回(DG区)颗粒细胞的轴突。在生后2w和2m大鼠海马内各区均未见密集的阳性产物表达。此结果说明,胚胎期大鼠海马内tau蛋白高表达,而随着脑的发育进程,tau的表达逐渐下降,此变化与神经元数量的下降相一致。
3.Ser396/404位点磷酸化tau(PHF-1)阳性产物在不同年龄大鼠海马内的分布及变化趋势

图2 不同发育阶段大鼠海马PHF-1阳性产物的表达及分布。Fig.2Expression and distribution of PHF-1positive substance in hippocampus of rats with different developmental stages
Ser396/404位点过度磷酸化在AD脑内与神经元纤维缠结(NFT)形成高度相关[7],因此本课题重点显示了tau蛋白的此位点磷酸化状态。Fig2为孕18d、生后1d、1w、2w和2m大鼠脑冠状切片,用免疫组织化学 ABC法,使用抗体PHF-1显示Ser396/404位点磷酸化tau的表达和分布,阳性产物为棕黄色颗粒状。图中低倍镜显示孕18d、生后1d和1w大鼠海马内有丰富的阳性产物表达,而生后2w和2m其表达量明显下降,这些特征与总tau的分布相一致。高倍镜显示,孕18d大鼠海马内PHF-1阳性物质在各区分布均匀,在始层和分子层分布也相似,生后1d的海马内,阳性产物出现分布变化,在CA1和CA2区,主要分布于始层,分子层表达极少,而在CA3区,主要分布于分子层;生后2w和2m大鼠海马内阳性产物表达很低,且在各区无明显差异,这些分布特征也与总tau相似。
讨 论
以上结果显示,胚胎期到出生后至成熟期大鼠海马CA区神经细胞数量逐渐下降,同时伴随着神经系统的发育,海马神经细胞内tau总量的表达和PHF-1位点磷酸化tau的表达均下降。那么这两者之前可能存在什么样的关系呢?在神经细胞发育过程中是因为神经细胞数量的减少从而导致tau表达和磷酸化tau表达的下降抑或是tau总量和PHF-1位点磷酸化tau蛋白的下降导致神经细胞数量的下降?从图片结果来看,伴随胚胎发育,神经细胞的数量下降非常明显,而同时tau总量和PHF-1位点磷酸化tau的表达量极为显著,到成熟期大鼠海马内几乎难以检测到明显的tau和PHF-1位点磷酸化tau的表达,因此神经细胞数量的下降不是tau和PHF-1tau下降的唯一原因,最有可能是两者相互关联,相互影响。
有研究表明,胚胎脑中tau蛋白的表达水平和磷酸化程度与AD脑中相似[8,9],但从未有人在胚胎期观察到NFTs的形成和神经细胞的退行性变,因此可以推测,在神经细胞发育过程中高表达的tau和磷酸化的tau蛋白与AD脑中的作用不同,但tau蛋白在胚胎期神经细胞发育过程中发生变化的原因及是否对神经细胞的分裂分化起作用目前未见报道。
大脑发育过程中,神经上皮细胞通过有丝分裂大量增殖,随后迁移,形成多层细胞,到达最终的定居区并分化为神经元和神经胶质细胞,此时的神经元并未成熟,但不再分裂,经历树突轴突的生长,建立神经元间突触连接后才发育为成熟的神经元[10,11]。胚胎时期,大鼠海马神经细胞大量分裂增殖,我们在此时期观察到海马神经细胞中有大量的总tau蛋白和大量磷酸化的tau蛋白,因此我们推测,大量tau蛋白的表达和磷酸化可能与神经细胞的分裂增殖存在某种关联。
细胞周期是指一个细胞经生长、分裂而增殖成两个细胞所经历的全过程,包括DNA合成前期(G1期),DNA合成期(S期),DNA合成后期(G2期)和分裂期(M期)。在G1期起主要作用的是周期蛋白cyclinD,调节G1/S的过渡,它存在于核内,细胞通过G1期进入S期,cyclinD通过泛素化途径降解[12,13]。有研究报道,糖原合酶激酶-3β(Glycogen synthase kinase 3β,GSK3β)可通过磷酸化cyclinD的Thr-286位点调控其在细胞内的定位,磷酸化的cyclinD从胞核内转移到胞浆中,使核内cyclinD的表达水平下降[14]。已有报道GSK3β在神经系统发育过程中表达水平极高[15],由此我们考虑,为什么胚胎时期大量GSK-3β的存在并没有因降低神经细胞核内cyclinD的水平而抑制神经细胞分裂?tau蛋白是GSK3β的底物之一[16],在神经细胞的核内和胞浆内均有表达,胚胎期GSK3β以极高水平表达,同时又有高水平的tau,是否高表达的tau可以结合更多的GSK3β,从而阻止cyclinD被磷酸化,维持G1期核内cyclinD的量,使细胞处于活跃的分裂状态?
出生后的幼年大鼠海马神经元不再分裂,经历树突轴突的生长,建立神经元间突触连接后发育为成熟的神经元[10,11]。神经元分化过程中,经历轴、树突的生长,此时神经元突起末端的生长锥感受细胞外生长和导向信息,通过微管和微丝运动使细胞形成树突和轴突,并不断生长、延伸或坍塌。细胞骨架系统不断进行重排是细胞突起生长、确定方向和迁移的关键[17]。tau蛋白和微管相关蛋白1B(MAP1B)都参与微管的这种动态的装配和解聚,同时都是GSK3β的底物[18,19]。我们在前期实验中观察到,胚胎期大鼠海马神经细胞内有大量tau蛋白,且重要的PHF-1位点磷酸化水平也很高,出生后则显著下降,由此我们考虑,当tau蛋白高度磷酸化时,与微管结合力下降,微管稳定性降低,神经元突起的生长被抑制[19];而随着大鼠脑的发育,tau蛋白的含量及磷酸化的tau蛋白含量逐渐下降,此期间总tau蛋白和磷酸化tau蛋白含量下降是否减少与MAP1B竞争GSK3β,使更多的MAP1B被磷酸化,促进神经元突起的生长?
总tau和磷酸化tau在胚胎期和出生后早期的分布及变化规律之间究竟存在着什么联系?是tau的变化调节了细胞的分裂和分化亦或是细胞的分裂和分化引起了tau的表达和磷酸化修饰的改变甚至这两者间仅仅是相伴随的现象?在本文中我们仅对此做了一些分析和推断,明确其中的关系和调节机制还需要进一步深入的研究。
[1]Gu Y,Oyama F,Ihara Y.Tau is widely expressed in rat tissues.J Neurochem,1996,67(3):1235-1244
[2]Michel Goedert.Tau protein and the neurofibrillary pathology of Alzheimer’s disease.Trends Neurosci,1993,16(11):460-465
[3]Yang Y,Yang XF,Wang YP,et al.Inhibition of protein phosphatases induces transport deficits and axonopathy.J Neurochem,2007,102(3):878-886
[4]Manon Bouchard,Oksana Suchowersky.Tauopathies:One Disease or Many?Can J Neurol Sci,2011,38:547-556
[5]Khalid Iqbal,Fei Liu,Cheng-Xin Gong,et al.Tau in Alzheimer Disease and Related Tauopathies. Curr Alzheimer Res,2010,7(8):656-664
[6]Braak H,Giffing K,Braak E.Neuroanatomy of Alzheimer diseae.Alzheimer’s Research,1997,33:235-247
[7]Li HL,Wang HH,Liu SJ,et al.Phosphorylation of tau antagonizes apoptosis by stabilizing β-catenin,a mechanism involved in Alzheimer’s neurodegeneration.Proc Natl Acad Sci USA,2007,104(9):3591-3596
[8]Maho MK,Masato H,Koji Takio,et al.Hyperphosphorylation of tau in PHF.Neurobiology of Aging,1995,16(3):365
[9]Bancher C,Brunner C,Lassmann H,et al.Accumlation of abnoramally phosphorylated precedes the formation of neurofibrillary tangles in Alzheimer’s disease.Brain Research,1989,477(1):90
[10]齐建国,马芳.神经科学扩展.北京:人民卫生出版社,2011,
[11]韩济生,于龙川.《神经科学》.北京:北京大学医学出版社,2009,
[12]Hunter T,Pines J.Cyclin D and CDK inhibition come of age.Cell,1994,79(4):547-550
[13]Jiribartek &Jirilukas.DNA repair:Cyclin D1multi-tasks.Nature,2011,474:171-172
[14]Huang W,Chang HY,Fei T,et al.GSK3beta mediates suppression of cyclin D2expression by tumor suppressor PTEN.Oncogene,2007Apr 12,26(17):2471-2482
[15]Wang Y,Roach PJ.Inactivation of rabbit muscle glycogen synthase by glycogen synthase kinase-3.Dominant role of the phosphorylation of Ser-640(site-3a).J Biol Chem,1993,268(32):23876-23880
[16]Mukai F,Ishiguro K,Sano Y,et al.Alternative splicing isoform of tau protein kinase I/glycogen synthase kinase 3beta.J Neurochem,2002,81(5):1073-1083
[17]Martin L,Magnaudeix A,Esclaire F,et al.Inhibition of glycogen synthase kinase-3beta downregulates total tau proteins in cultured neurons and its reversal by the blockade of protein phosphatase-2A.Brain Res,2009,1252:66-75
[18]Conde C,Caceres A.Microtubule assembly,organization and dynamics in axons and dendrites.Nat Rev Neurosci,2009,10(5):319-332
[19]Utton MA,Vandecandelaere A,Wagner U,et al.Phosphorylation of tau by glycogen synthase kinase 3beta affects the ability of tau to promote microtubule self-assembly.Biochem J,1997,323(Pt 3):741-747
——水芹主要害虫识别与为害症状

