18F标记哒嗪酮类似物的制备及其在小鼠体内的生物分布
彭 程,牟甜甜,赵祚全,马云川,张现忠,3
(1.首都医科大学 宣武医院 PET中心,北京 100053;2.放射性药物教育部重点实验室,北京师范大学 化学学院,北京 100875;3. 分子影像暨转化医学研究中心,厦门大学 公共卫生学院,厦门 361005;4. 首都医科大学附属北京安贞医院 核医学科,北京 100029 )
心肌灌注显像在冠心病的早期诊断和预后评价中起着非常重要的作用。随着正电子发射断层扫描(PET)技术的发展与普及,越来越多的18F标记心肌灌注显像剂被报道,成为放射性药物研究的新热点。
MC-Ⅰ(线粒体复合体Ⅰ)抑制剂类似物在已报道的18F标记的心肌灌注显像剂中生物性能较为突出[1]。尤其是抑制剂哒螨灵的衍生物,如BMS-747158-02(flurpiridaz)[2-9]、18F-FP1OP[10]等,都是以哒嗪酮为药效团,具有较高的心肌摄取和良好的靶与非靶组织放射性摄取比(T/NT),具有进一步临床应用的前景(flurpiridaz已经获得FDA批准进入III期临床试验)。
哒螨灵的结构由“头盔”、连接链以及侧链组成,其化学结构示于图1。Purohit等[11]对它的衍生物进行了IC50的测定,做了较深入的构效关系研究。但是上述研究都是基于哒螨灵结构中的哒嗪酮部分或连接链部分,并未涉及侧链中苯环的结构修饰。本课题组[12]于2011年报道了18F-FPTP2,其生物分布结果表明,哒螨灵的苯环具有一定的可修饰性,在苯环上引入杂原子并改变苯环取代基的位置,并不会影响该类化合物的心肌摄取。这说明哒螨灵侧链中的苯环具有较大的可修饰性。因此,侧链中的苯环是否属于影响哒螨灵心肌摄取的核心结构,去掉苯环是否会影响该类化合物在心肌中的摄取,值得进一步研究。另外,已报道的18F-FP1OP和18F-FP2OP[13]的稳定性较差,不利于临床使用,因此需要设计合成一种更为稳定的化合物。鉴于此,本工作拟尝试对哒螨灵进行进一步修饰,去掉其侧链中的苯环,制备结构更为简单的2-特丁基-4-氯-5-(2-氟[18F]乙氧基)-2H-3-哒嗪酮(18F-FP2),以研究该类标记物的稳定性及苯环的存在对于该类化合物心肌摄取的影响。
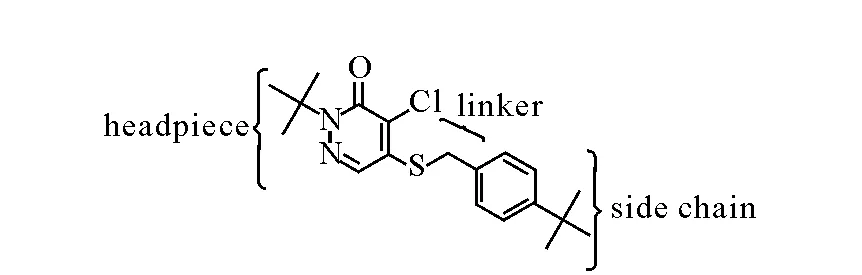
图1 哒螨灵的结构图Fig.1 The structure of pyridaben
1 主要实验材料
1.1 主要仪器与装置
高效液相色谱仪岛津LC-20AT:日本岛津公司产品;AVATAR 360 红外光谱:美国Nicolet公司产品;Avance 500核磁共振谱仪:瑞士Bruker A.G.公司产品;RM-905a放射性活度计:中国计量科学研究院产品;Venusil MP-C18半制备色谱柱,250 mm×10 mm,5 μm:美国Agela Technologies公司产品;DYY-Ⅲ电泳仪:北京科学仪器修配厂产品;WALLAC/WIZARD 1470γ计数仪:美国PerkinElmer公司产品。
1.2 主要试剂
18F-:北京宣武医院提供;乙二醇(99%)、对甲基苯磺酰氯(98%)、正四丁基氟化铵(1 mol/L四氢呋喃溶液)、碳酸铯(99%)、糠醛(98%)、二异丙基乙胺(DIPEA)(99%):Alfa Aesar公司产品;叔丁基肼盐酸盐(98%)、4-二甲氨基吡啶(DMAP)(99%):Acros Organics公司产品;Kryptofix2.2.2.(K2.2.2):Sigma-Aldrich公司产品。
2 实验方法
2.1 19F-FP2的合成
2-特丁基-4-氯-5-(2-氟[19F]乙氧基)-2H-3-哒嗪酮(2-tert-butyl-4-chloro-5-(2-[19F]fluroethoxy)-2H-pyridazin-3-one,19F-FP2)的合成路线示于图 2。其中,2-特丁基-4,5-二氯哒嗪酮(2-tert-butyl-4.5-dichloro-2H-pyridazin-3-one,DCP)的合成参考文献[13]。
将0.515 g(2 mmol)DCP、0.372 g(6 mmol)乙二醇、1.955 g(6 mmol)碳酸铯和10 mL DMF于68 ℃油浴反应12 h。冷却后用100 mL乙酸乙酯稀释,抽滤。滤液经100 mL水洗涤5次后,用无水MgSO4干燥。抽滤后旋蒸滤液,经200~300目的硅胶柱纯化,展开剂为V(石油醚)∶V(乙酸乙酯)=2∶3。得到0.39 g白色固体,即 2-特丁基-4-氯-5-(2-羟基)-2H-3-哒嗪酮(2-tert-butyl-4-chloro-5-(2-hydroxy)-2H-pyridazin-3-one, I-2OH),产率80%。1H NMR (400 MHz, CDCl3)δ: 1.581 (s, 9H, N(CH3)3)、2.142 (s, 1H, CH2OH)、3.946 (t, 2H, CH2OH)、4.268 (t, 2H, CH2CH2OH)、7.707 (s, 1H, N=C-H)。
将0.247 g(1 mmol)I-2OH、0.229 g(1.2 mmol)对甲基苯磺酰氯、0.146 g(1.2 mmol)4-二甲氨基吡啶、0.155 g(1.2 mmol)二异丙基乙胺和50 mL无水二氯甲烷加至100 mL茄形瓶中,室温搅拌2 h。旋蒸除溶剂后,反应液用100 mL乙酸乙酯溶解,分别用100 mL 0.1 mol/L HCl和100 mL水洗涤。有机相用无水Na2SO4干燥,抽滤后旋蒸滤液,用200~300目的硅胶柱纯化,展开剂为V(石油醚)∶V(乙酸乙酯)=3∶1,得到0.25 g白色固体,即2-特丁基-4-氯-5-(2-对甲基苯磺酰基)-2H-3-哒嗪酮(2-tert-butyl-4-chloro-5-(2-tosyl)-2H-pyridazin-3-one, OTs-P2),产率63%。1H NMR (400 MHz, CDCl3)δ: 1.569 (s, 9H, N(CH3)3)、2.383 (s, 3H, phenyl-CH3)、4.312~4.367 (m, 4H, CH2CH2OH)、7.283 (d, 2H, CH3-phenyl)、7.757 (s, 1H, N=C-H)、7.734 (m, 2H, SO3-phenyl);13C NMR (100 MHz,CDCl3)δ: 21.70、 27.84、66.55、67.70、67.82、118.46、124.90、127.95、130.03、132.39、145.39、153.21、158.80;ESI-MS C17H21ClN2O5S: 计算值为400.1,实验值为401.3; 元素分析C17H21ClFN2O5S: 计算值为C50.93%, H5.28%, N6.99%;实验值为C50.82%, H4.65%, N6.61%。IR (CH2Cl2,cm-1) v: 1 634 (C=O), 1 274 (=C—O—C);熔点:104~105 ℃。结构分析结果确定产物为目的化合物。
将1 mL 1 mol/L 四正丁基氟化铵的THF溶液加至25 mL反应瓶中,110 ℃氮气吹干。加入1 mL无水乙腈蒸发至干,重复3次。将0.200 g(0.5 mmol)OTs-P2溶于10 mL无水乙腈,加至反应瓶中,回流40 min。反应液经旋蒸后,用20 mL二氯甲烷溶解,用20 mL水洗涤。有机相用MgSO4干燥,抽滤后旋蒸滤液,经200~300目硅胶柱纯化,展开剂为V(石油醚)∶V(乙酸乙酯)=3∶1,得到112 mg白色固体,即19F-FP2,产率65%。1H NMR (400 MHz, CDCl3)δ: 1.626 (s, 9H, N(CH3)3)、3.141 (dt, 2H, CH2CH2F)、4.597~4.829 (m, 6H, CH2CH2-triazolyl-CH2CH2CH2F)、7.656 (s, 1H, N=C—H)、7.729 (s, 1H, triazolyl)。13C NMR (100 MHz,CDCl3)δ: 27.28 (d, J=22 Hz), 27.83、49.43、66.74、68.66;82.33 (d, J=167 Hz)、118.34、124.36、153.03、158.77;熔点:87~88 ℃。结构分析结果表明,产物为目标化合物。
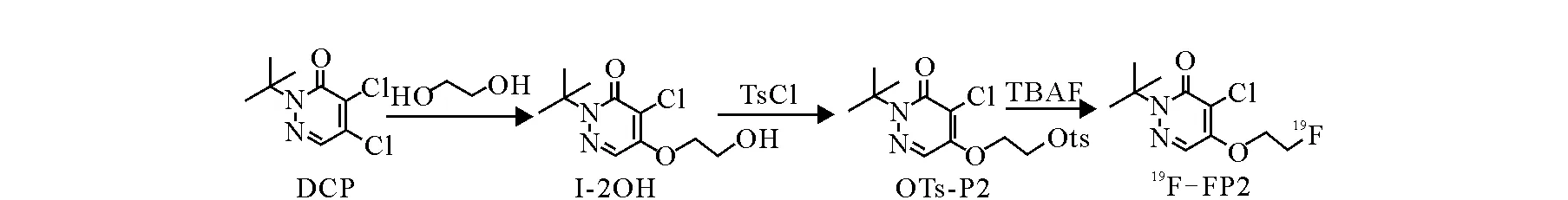
图2 19F-FP2的合成路线Fig.2 The synthesis route of 19F-FP2
2.2 18F-FP2的合成
18F-FP2的合成路线示于图 3。
将0.3 mL含有3 mg K2CO3的水溶液和1 mL含有11 mg K2.2.2的乙腈溶液混合,用上述混合液将18F-从QMA柱淋洗至10 mL反应瓶中,110 ℃氮气吹干。加入0.5 mL无水乙腈蒸发至干,重复3次。将2 mg OTs-P2溶于1 mL 无水乙腈,加至反应瓶中,90 ℃反应30 min。反应结束后冷却至室温,注入C18 反相半制备柱,收集保留时间为16.5~17.5 min的组分,即为18F-FP2。HPLC条件为:A相为水,B相为乙腈;淋洗梯度:0~5 min 95%A,5.01~8 min 95%~60%A,8.01~19 min 60%~30%A。

图3 18F-FP2的合成路线Fig.3 The synthesis route of 18F-FP2
2.3 18F-FP2的稳定性
将1.85 MBq经HPLC纯化后的18F-FP2溶于1 mL水中,在室温下放置3 h,每隔1 h取0.2 mL溶液,采用HPLC检测其放化纯度。
2.4 18F-FP2脂水分配系数的测定
配制0.025 mol/L KH2PO4溶液,加入适量NaOH溶液,调节pH至7.4,得到PBS缓冲溶液,加入与之等体积的正辛醇,充分振荡后室温静置1 d以上。取上层正辛醇0.6 mL,下层PBS液0.58 mL,并取0.02 mL18F-FP2水溶液混合,用涡旋混合器振荡3~5 min,充分混匀。然后离心5 min,在有机相和水相中分别平行取3个样,每个样0.1 mL,用γ计数器测量其放射性活度,每个样品平行测定3次。计算分配系数lgP值。
2.5 18F-FP2在正常小鼠体内的生物分布
由正常昆明小鼠尾静脉注射0.1 mL18F-FP2水溶液(0.185 MBq),注射后2、15、30和 60 min将其断头处死。取心、肝、脾、肺、肉、骨、血、肾等有关组织和器官,擦净后称重,并在γ计数器上测定放射性活度,计算各组织的每克百分注射剂量率(%ID/g)。
3 结果与讨论
3.1 18F-FP2的放化产率及放化纯度
从18F-起,至纯化完毕,制备总时间为70~90 min,衰变校正后的放化产率为53.0%±5.2%。产物的放化纯度>98%,比活度约为20 TBq/g。18F-FP2及19F-FP2的HPLC谱图示于图4。由图4可以看出,18F-FP2的保留时间为16.7 min,和相应的参考物质19F-FP2的保留时间16.5 min一致。说明所得到的标记物为目标产物18F-FP2。
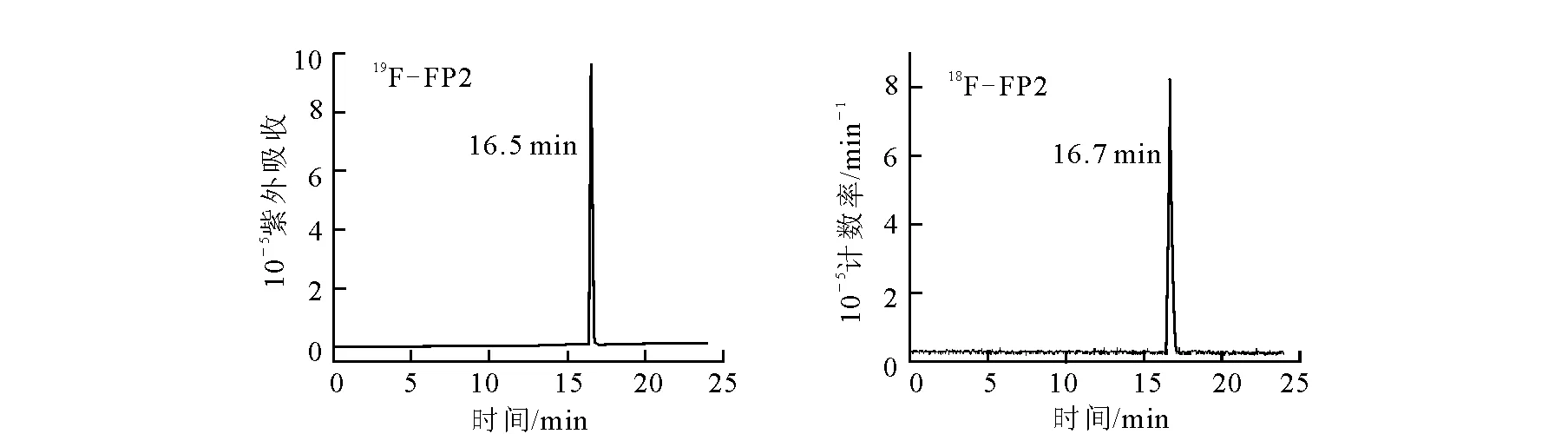
图4 19F-FP2和18F-FP2的HPLC图谱Fig.4 The HPLC chromatograms of 19F-FP2 and 18F-FP2
3.2 18F-FP2的稳定性研究
18F-FP2在水溶液中放置3 h后的HPLC谱图示于图5。由图 5可见,18F-FP2在水溶液中的稳定性较好,室温放置3 h后,放化纯度仍>98%。与先前报道的18F-FP1OP[10]、18F-FP2OP[13]相比,其在水溶液中的稳定性有显著提高。较好的稳定性是药物临床推广使用的前提,也为将来设计稳定的标记化合物提供参考。
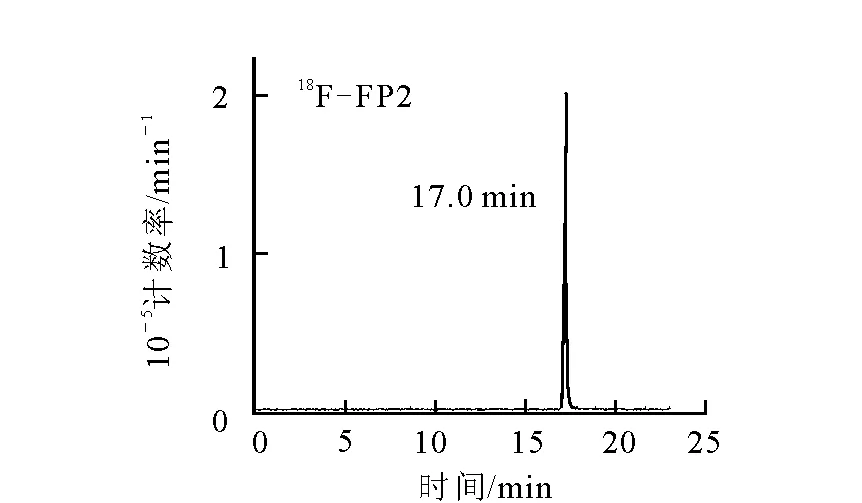
图5 18F-FP2在水溶液中室温放置3 h后的HPLC谱图Fig.5 The HPLC chromatograms of 18F-FP2,incubated in water for 3 h
3.3 18F-FP2脂水分配系数的测定
实验测得18F-FP2的lgP为0.42±0.02,表明其为脂溶性物质。但是其亲脂性明显低于先前报道的化合物(18F-FP1OP[10]和18F-FP2OP[13]),这与标记化合物结构中侧链苯环的去除有直接关系。
3.4 18F-FP2在正常小鼠体内的生物分布
18F-FP2在正常小鼠体内的生物分布结果列于表1。由表1数据可见,18F-FP2在小鼠肝、肺等器官具有很高的初始摄取,但是清除也很快。在心肌中的初始摄取较低,仅为(4.09±0.53)%ID/g,且清除较快。心肌的低摄取使T/NT较不理想,不符合心肌灌注显像剂的基本要求。这说明去除哒螨灵结构中的芳环,会严重影响化合物在心肌中的摄取。侧链中的芳环为哒螨灵衍生物保持心肌高摄取的必需基团。
4 结 论
本工作设计并制备了一种18F标记的哒嗪酮类似物18F-FP2,其校正后的放化产率为53.0%±5.2%,放化纯度>98%,比活度约为20 TBq/g。18F-FP2为脂溶性化合物,且在水溶液中的稳定性较好,室温放置3 h放化纯度仍>98%。小鼠生物分布结果显示,该标记物在心肌中的初始摄取较低且清除较快,不适于心肌显像。

表1 18F-FP2在正常小鼠体内的生物分布
综上所述,本研究虽然获得了稳定性更好的标记化合物,但是由于标记侧链上的苯环去除后大幅降低了心肌摄取,使其不适合用于心肌显像。鉴于此,建议今后在该类标记物的设计中应保留哒嗪酮侧链的芳环结构。
参考文献:
[1] Yu M, Guaraldi M, Kagan M, et al. Assessment of18F-labeled mitochondrial complex I inhibitors as PET myocardial perfusion imaging agents in rats, rabbits, and primates [J]. European Journal of Nuclear Medicine and Molecular Imaging, 2009, 36: 63-72.
[2] Yalamanchili P, Wexler E, Hayes M, et al. Me-chanism of uptake and retention of F-18 BMS-747 158-02 in cardiomyocytes: a novel PET myocardial imaging agent [J]. Journal of Nuclear Cardiology, 2007, 14: 782-788.
[3] Huisman MC, Higuchi T, Reder S, et al. Initial Characterization of an18F-Labeled Myocardial Perfusion Tracer [J]. Journal of Nuclear Medicine, 2008, 49: 630-636.
[4] Yu M, Guaraldi MT, Bozek J, et al. Effects of food intake and anesthetic on cardiac imaging and uptake of BMS747158-02 in comparison with FDG [J]. Journal of Nuclear Cardiology, 2009, 16: 763-768.
[5] Sherif HM, Saraste A, Weidl E, et al. Evaluation of a Novel18F-Labeled Positron-Emission Tomography Perfusion Tracer for the Assessment of Myocardial Infarct Size in Rats / CLINICAL PERSPECTIVE [J]. Circulation: Cardiovascular Imaging, 2009, 2: 77-84.
[6] Yu M, Bozek J, Guaraldi M, et al. Cardiac imaging and safety evaluation of BMS747158, a novel PET myocardial perfusion imaging agent, in chronic myocardial compromised rabbits [J]. Journal of Nuclear Cardiology, 2010, 17: 631-636.
[7] Maddahi J, Czernin J, Lazewatsky J, et al. Phase I, First-in-Human Study of BMS747158, a Novel18F-Labeled Tracer for Myocardial Perfusion PET: Dosimetry, Biodistribution, Safety, and Imaging Characteristics After a Single Injection at Rest [J]. Journal of Nuclear Medicine, 2011, 52: 1 490-1 498.
[8] Maddahi J, Bengel F, Huang SC, et al. Phase 1 rest-stress study of F-18 labeled BMS747158 myocardial perfusion PET tracer: Human safety, dosimetry, biodistribution, and myocardial imaging characteristics [J]. Journal of Nuclear Medicine, 2009, 50: 184-184.
[9] Sherif HM, Nekolla SG, Saraste A, et al. Simplified Quantification of Myocardial Flow Reserve with flurpiridaz F 18: Validation with Microspheres in a Pig Model [J]. Journal of Nuclear Medicine, 2011, 52: 617-624.
[10] Mou T, Zhao Z, Fang W, et al. Synthesis and Preliminary Evaluation of18F-labeled Pyridaben Analogues for Myocardial Perfusion Imaging with Positron Emission Tomography [J]. Journal of Nuclear Medicine, 2012, 53: 472-479.
[11] Purohit A, Radeke H, Azure M, et al. Synthesis and Biological Evaluation of Pyridazinone Analogues as Potential Cardiac Positron Emission Tomography Tracers [J]. Journal of Medicinal Chemistry, 2008, 51: 2 954-2 970.
[12] Mou T, Zhao Z, Yang W, et al. Radiosynthesis and biodistribution of [18F]FPTP2 as potential myocardial perfusion imaging agent [J]. Journal of Labelled Compounds and Radiopharmaceuticals, 2011, 54: S446.
[13] Mou T, Jing H, Yang W, et al. Preparation and biodistribution of [18F]FP2OP as myocardial perfusion imaging agent for positron emission tomography [J]. Bioorganic & Medicinal Chemistry, 2010, 18: 1 312-1 320.

