11C-Carfentanil的质量控制
张晓军, 向晓辉, 张锦明 , 田嘉禾
(1.中国人民解放军总医院 核医学科, 北京 100853;2.北京大学 神经科学研究所, 北京 100191)
11C-Carfentani是一种μ-Opiate受体(阿片受体)显像剂,主要与涉及疼痛感觉的中枢神经Mm型μ-Opiate受体结合,描绘该受体在大脑内的分布[1],研究该受体的药理机制,探讨针炙止痛的机理,也用于一系列中枢神经系统紊乱疾病如癫痫、肺腺癌等疾病的诊断,药物成瘾和烟酒戒断治疗等的监测[2-5]。卡芬太尼(Carfentanl)是目前最强有效的阿片类镇痛药物,药物相对作用效价约为吗啡的10 000倍,是芬太尼的100倍,在人体起效药物剂量是10 μg[6-7]。
正电子放射性药物,特别是短半衰期正电子核素标记的PET药物,需要专门的安全评价和质量控制措施。短半衰期放射性药物也必须在严格的时间内就地生产并就近使用,而且在生产和应用之间没有足够长的时间进行所有常规质量控制和检测实验。短半衰期放射性药物的另一个特点是微量,11C-Carfentanil合成的前体去甲基卡芬太尼使用量是1 mg,产品中所含的11C-Carfentanil仅有几十微克,这使得用于质量控制的分析方法必须具有较低的检测下限,其中高效液相色谱法是最常用的一种分析手段,其与放射性探测器结合使用,可以测量产品的化学纯度及放化纯度,与标准品同时进样可进行化合物的鉴定。
本研究利用高效液相色谱系统测量11C-Carfentanil注射液的化学纯度和放化纯度;液质联用方法测量比活度;应用快速内毒素检测器PTS检测产品中内毒素含量,对制备的11C-Carfentanil注射液的质量控制方法进行了研究[8]。
1 实验材料
液质联用仪(LC-MS): API 2000,美国Applied Biosystems公司;Pump Agilent 1200 G1310,Agilent Eclipse XDB-C18分析柱(4.6 mm×150 mm×5 μm):Agilent Technologies公司;PTS(内毒素快速检测仪):美国charles river公司;Plus C18柱和 HPLC分析系统 (紫外检测器和放射性探测器):Waters公司;前体去甲基卡芬太尼,标准品12C-Carfentanil:德国ABX公司;KM小鼠:北京华阜康生物科技股份有限公司(许可证编号:SKK京2009-0007)。
2 实验方法
2.1 理化性质分析
2.1.1外观鉴别11C-Carfentanil为本中心自行制备[9-10],在制备完成后,11C-Carfentanil注射液在灯光下,在铅玻璃后观察。
2.1.2放射性核素鉴定 取1 mL制备的11C-Carfentanil注射液,用活度计测定60 min内不同时间的活度值,以时间为横坐标,测量的浓度为纵坐标,在半对数坐标纸上作图,用半对数法计算半衰期。
2.1.3酸碱度 使用精密pH试纸测定11C-Carfentanil注射液的pH。
2.1.4浓度测量 用HPLC系统测定11C-Carfentanil注射液的浓度,分析柱为Grace Alltima C18, 5 μL,10 mm×250 mm,流动相为500 mL含50 mmol乙酸铵的30%乙腈溶液,另加1 mL冰乙酸,pH 为6.4,流速1.0 mL·min-1。以紫外检测器检测,进样量10 μL,检测波长254 nm。使用面积归一法测定11C-Carfentanil注射液的浓度。
2.1.5放化纯度测量 测量HPLC条件与浓度测量相同。将11C-Carfentanil注射液与标准品(12C-Carfentanil)溶液(10 mg/L)在HPLC系统同时进样,测量标准品和11C-Carfentanil注射液的保留时间;采用HPLC系统与在线放射性探测器结合测量,使用面积归一法测定11C-Carfentanil注射液的放化纯度。
2.2 比活度测量
11C-Carfentanil的比活度关系到研究与应用能否安全进行,需要严格控制。测量比活度需要先测量产品中11C-Carfentanil的浓度,浓度测量可采用紫外测量法和质谱测量法。
紫外测量方法为:精确配置5.0、7.5、10、15、20 mg/L标准品溶液,在上述色谱条件下,依次取10 μL进样,对各浓度色谱峰面积积分,以峰面积为纵坐标、浓度为横坐标进行线性回归,得到定量线性方程。再取10 μL产品溶液进样,将峰面积代入线性方程即可得到产品中卡芬太尼浓度。
质谱测量方法为:采用API2000质谱仪测量11C-Carfentanil注射液浓度,并计算其比活度。质谱参数设定:采用Q1 Full Scan模式,Syring Pump 进300 μg/L的标准溶液10 μL/min,根据Carfentanil的极性及其热不稳定性,选用ESI离子源正离子扫描,可得395.3 amu为基峰,也是母离子(M+H)+,并Edit Ramp优化Declustering Potential(DP)为40 V、Focusing Potential(FP)为350 V、Entrance Potential(EP)为8 V。采用Product Ion Scan模式,扫描并选择113.0 amu、246.3 amu、335.1 amu做子离子。进行MRM优化,设置离子对为395.3/113.0、395.3/246.3、395.3/335.1,同时Edit Ramp优化Collision Energy(CE)为50 V,Curtain Gas(CUR)为17 psig,Collision Gas为6 psig,IonSpray Voltage(IS)为5 500 V,Ion Source Gas 1(GS1)为55 psig,Ion Source Gas 2 (GS2)为55 psig,Temperature(TEM)为350 ℃,保存MRM方法。
质谱测量前液相色谱分离条件:HPLC采用Agilent Eclipse XDB-C18分析柱(4.6 mm×150 mm×5 μm),流动相为600 mL 50 mmol/L乙酸铵水溶液与400 mL乙腈混合,再加入2.2 mL冰乙酸调节pH至6.4,流速为500 μL/min。手动进样20 μL,这种条件下,样品中Carfentanil的保留时间为7.2 min。
精确制备浓度为100、200、300、400、500 μg/L的Carfentanil标准品溶液。应用设定好的质谱MRM方法,依次进样25 μL,以峰面积为纵坐标,浓度为横坐标拟合线性回归方程,再用25 μL产品进样,经MS测量后依标准曲线即可计算出产品浓度,从而可计算出11C-Carfentanil的比活度。
2.3 生物学性质
2.3.1细菌内毒素含量 美国药典26版规定,11C-Carfentanil注射液中细菌内毒素不高于175/V,内毒素单位(EU)(175/VIU),V定义为最大总用药剂量,以mL计。利用Charles river公司产品PTS检测,取10 μL产品,加入注射用水稀释到1 mL,即稀释100倍,用专用微量进样器取100 μL稀释液加入PTS,即可测量稀释100倍后产品中内毒素含量,求得产品内毒素含量。测量过程中所用器具和加入的试剂均为无菌无热源。
2.3.2无菌检查 根据中国药典附录[11],取0.2 mL11C-Carfentanil注射液分别接种于7.5 mL硫乙醇酸盐流体培养基和真菌培养基中,在隔离系统中30~35 ℃ 培养14 d,并按规定进行观察。
2.3.3异常毒性检查 根据中国药典附录方法[12],用5只KM小鼠对生产的11C-Carfentanil注射液进行异常毒性检查,每只小鼠尾静脉注射0.2 mL 18.5 MBq产品溶液,载体为每只0.278 nmol。于注射后称重,正常饲养一周后再次称重,同时全部处死,取主要器官,肉眼观察有无变化。
3 结果与讨论
3.1 理化性质
11C-Carfentanil外观为无色透明澄清溶液;精确pH试纸测量溶液的pH为5.5~6.0(n=3);通过活度计测量产品衰变速度,用半对数法计算11C-Carfentanil注射液的半衰期,结果为20.3 min,符合11C放射性核素的半衰期要求。
经HPLC系统分析,11C-Carfentanil的紫外保留时间为5.3 min(图1),放射性峰的保留时间为5.8 min(图2),其时间差值是由于紫外探测器与放射性探测器之间的连接管路产生的。标准品与产品同时进样,二者紫外保留时间一致,均为5.3 min,可以证实产品为目标化合物。采用放射流量检测器测定产品放化纯度,使用面积归一法测定11C-Carfentanil注射液的放化纯度>98%。
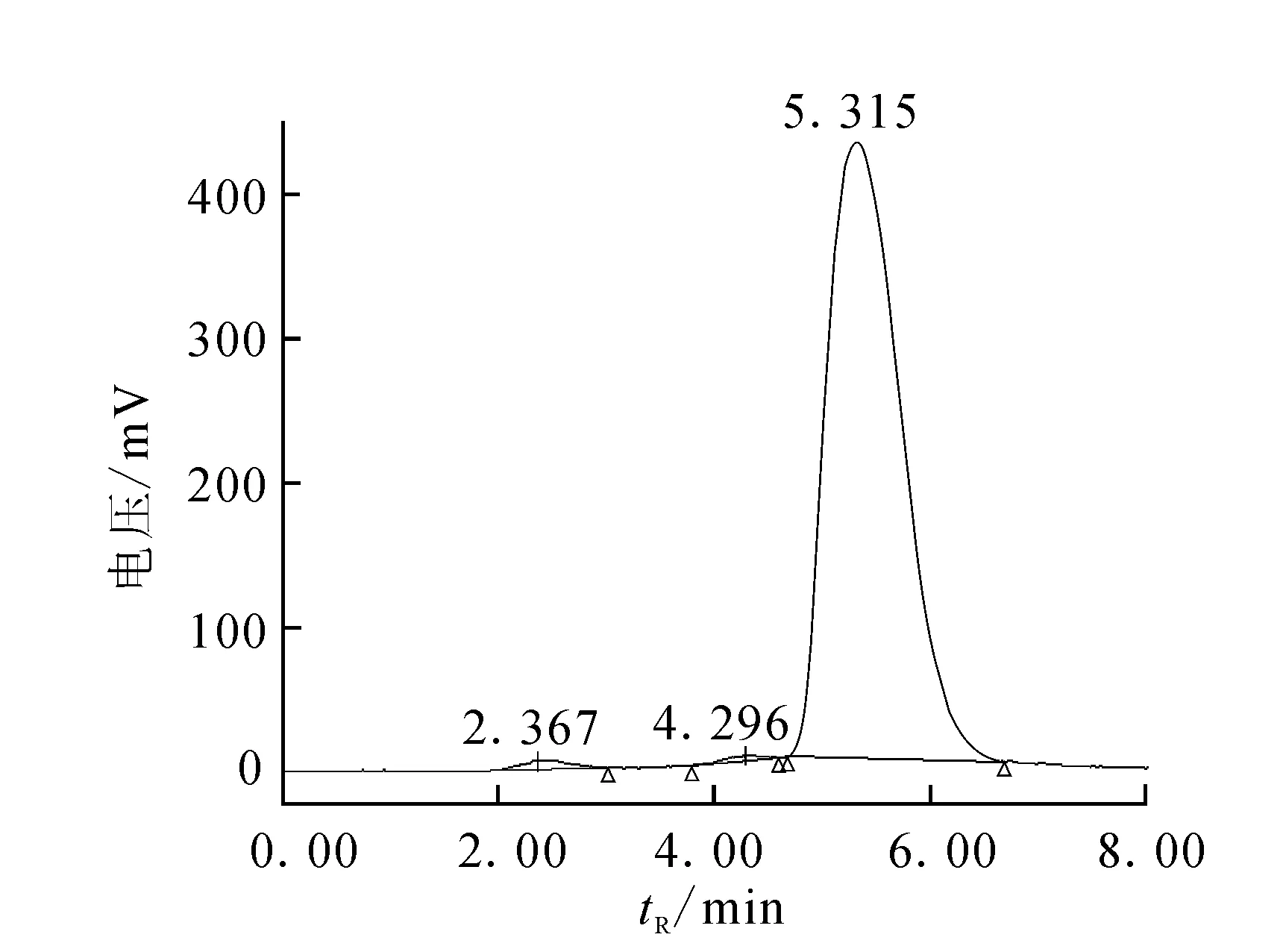
图1 HPLC分析放射性峰

图2 HPLC分析紫外峰
11C-Carfentanil溶液中主要化学杂质是去甲基卡芬太尼前体,合成结束时的反应溶液用10 mL 1%氨水稀释后过C2柱,11C-Carfentanil被吸附在C2柱上,用10 mL水淋洗C2柱后,去甲基卡芬太尼前体即被除去,但仍有少量的前体与11C-Carfentanil随乙醇淋洗到最终产品溶液中。去甲基卡芬太尼,在血液中无法进入血脑屏障(BBB),动物实验证实,尽管卡芬太尼的毒性很大,但其前体去甲基卡芬太尼则毒性很低,小鼠体内注射50 mg/kg的前体,没有观察到中毒征状。因此微量前体对产品质量没有很大影响[10]。
实验中发现,在11C-Carfentanil的制备中,使用两种不同的氢化锂铝对最终比活度的影响很大。使用高本底的氢化锂铝,由于其中12C甲醇盐含量高,在与氢碘酸反应后生成12C-CH3I,转换成12C-CH3-Triflate后与前体去甲基卡芬太尼反应生成12C-Carfentanil,因此使产品比活度大大下降。使用低本底与高本底的氢化锂铝进行反应,所得产品的比活度分别为1.69×1014Bq/g与3.48×1013Bq/g,可见,低本底的氢化锂铝化学纯高,可以提高产品的比活度。
3.2 比活度测量
浓度为5~20 mg/L的Carfentanil标准品经HPLC检测,定量标准曲线为y=516.81x-164.88,r=0.975 9,可见Carfentanil标准品浓度与HPLC紫外峰面积之间有良好的线性相关性。但产品溶液进样后发现产品峰处杂峰较多,影响对11C-Carfentanil峰的峰面积进行积分,而导致无法对11C-Carfentanil准确定量。
质谱有灵敏、快速、特异、化学定量的特点,是目前定量化合物最灵敏最有效的方法。通过质谱定量分析11C-Carfentanil产品,记录质谱图示于图3和图4,经线性回归,得到线性方程y=533x+5 370,r= 0.999 9,线性范围为100~500 μg/L。在相同的质谱分析条件下,稀释产品溶液,使其浓度落在标准曲线范围内,然后取25 μL稀释液进样,测量质谱图峰面积,即可知产品浓度为12.8 mg/L。再测量产品总活度,计算可得比活度为1.69×1014Bq/g。
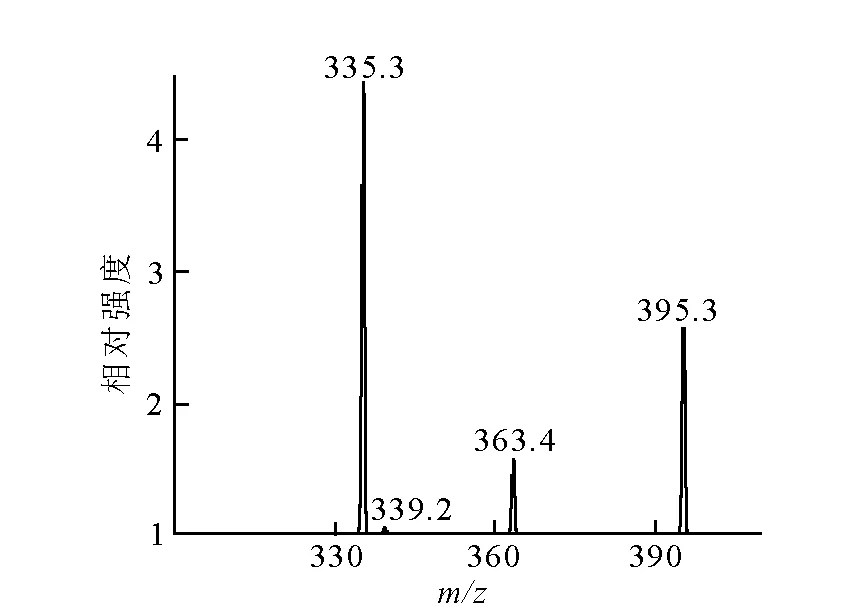
图3 母离子Q1扫描
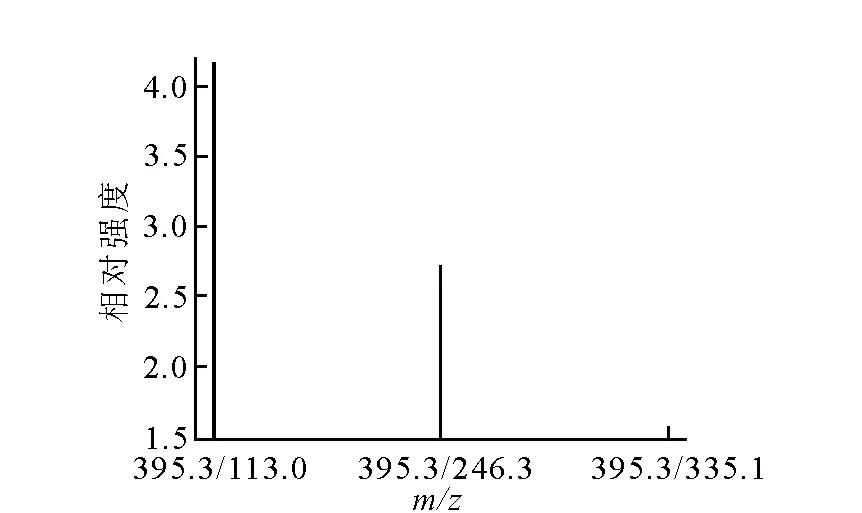
图4 离子对Q1/Q2扫描
3.3 生物学性质
内毒素快速检测仪PTS的内置内毒素标准曲线范围为5~0.05 EU/mL,产品稀释100倍后测量内毒素含量为小于0.05 EU/mL,即产品中内毒素含量小于5 EU/mL(n=3),符合标准。经无菌试验证实产品为无菌溶液。
异常毒性检查中,小鼠注射时体重均值为(23.1±1.8) g,一周后为(28.7±2.1) g,肉眼观察主要器官,无变化。在保证所有合成材料与原料均为无菌无热源的前提下,11C-Carfentanil注射液的细菌内毒素测量以及无菌检验可以在注射液使用中或使用结束后进行。
4 小 结
11C-Carfentani作为一种μ-Opiate受体显像剂,由于其生理效应很强,要求产品高比活度。从理化性质和生物学性质两个方面对11C-Carfentani进行质量控制,合成产品为无色透明澄清溶液,pH为5.5~6.0,半衰期为20.3 min,放化纯大于98%,比活度为1.69×1014Bq/g,内毒素含量小于5 EU/mL,异常毒性试验检查合格。以上结果表明,11C-Carfentanil注射液的质量符合药用要求,可满足实验和临床安全使用的要求。
参考文献:
[1] Minami M, Satoh M. Molecular biology of the opioid receptors: structures, functions and distributions[J]. Neurosci Res, 1995, 23(2):121-145.
[2] Harris RE, Zubieta JK, Scott DJ, et al. Traditional Chinese acupuncture and placebo (sham) acupuncture are differentiated by their effects on μ-opioid receptors (MORs) [J]. Neuroimage, 2009,47:1 077-1 085.
[3] Liberzon I, Taylor SF, Phan KL, et al. Altered central mu-opioid receptor binding after psychological trauma[J]. Biol Psychiatry, 2007, 61:1 030-1 038.
[4] Heinz A, Reimold M, Wrase J, et al.Correlation of stable elevations in striatal mu-opioid receptor availability in detoxified alcoholic patients with alcohol craving: a positron emission tomography study using carbon 11-labeled carfentanil[J]. Arch Gen Psychiatry, 2005, 62:57-64.
[5] Molina PE. Opioids and opiates: analgesia with car-diovascular, homodynamic and immune implications in critical illness[J]. J Intern Med, 2006,259(2):138-154.
[6] Van bever WFM, Niemegeers CJE, Schellekens
KHL, et al, N-4-substituted 1-(2-aryl-ethyl)-4-piperidinyl-N- phenylpropanamides, a novel series of extremely potent analgesics with unusually high safety margin[J]. Arzneim Forsch, 1976,26(8):1 548-1 551.
[7] 朱国政, 戴敦华. 强效镇痛药卡芬太尼的合成[J]. 医药工业,1988,19: 9.
Zhu Guozheng, Dai Dunhua. Synthesis of potent analgesic carfentanil[J]. Pharmacautical Industry, 1988,19(9):419-420(in Chinese).
[8] 张锦明, 田嘉禾.18F-FDG的质量控制及方法[J]. 中华核医学杂志, 2005, 25(6):383-384.
Zhang Jinming, Tian Jiahe. The quality control of18F-FDG[J]. Chin J Nucl Med, 2005, 25(6):383-384(in Chinese).
[9] 张锦明, 田嘉禾, 王武尚,等.单管法自动化合成11C-碘代甲烷[J].中华核医学杂志,2004,24:243.
Zhang Jinming, Tian Jiahe. et al. An automated synthesis of11C-methyl iodide with singlevessel[J]. Chin J Nucl Med, 2004,24(4):243-244(in Chinese).
[10] 张锦明, 桂媛, 徐志红,等. 阿片受体显像剂:11C-Carfentanil的合成及放射性标记[J]. 核化学与放射化学, 2011, 33(4):252-256.
Zhang Jiming, Gui Yuan, Xu zhihong. et al. Synthesis and Carbon-11 radiolabelling for Opiate receptor imaging agent:11C-Carfentanil[J]. J Nucl Rad, 2011, 33(4):252-256(in Chinese).
[11] 《中国药典》2010年版二部附录XⅢ B:89[M].北京:化学工业出版社.
[12] 《中国药典》2010年版二部附录XⅢ E:85[M].北京:化学工业出版社.

