胆甾醇辛酸酯-辛酰基-1-13C的合成
卢伟京,李 帅,徐仲杰,卢 浩
(上海化工研究院,上海 200062)
胆甾醇辛酸酯-辛酰基-1-13C(简记为胆甾醇辛酸酯-13C,ChO-13C)是一种13C呼吸试剂,用于诊断脂肪吸收和评价胰腺分泌不足,被认为是有效的诊断试剂,敏感性为68.2%,特异性为75%。[1-4]。
胆甾醇辛酸酯-13C的合成方法未见文献报道,天然丰度胆甾醇酯合成一般常用酸酐法、酶催化法、酰氯法和缩合法。酸酐法是酸酐和胆固醇反应生成胆甾醇酯,具有路线短、条件温和、收率高等优点[5-6];酶法以假丝酵母脂肪酶合成胆甾醇油酸酯和使用假单胞菌脂肪酶合成胆甾醇22碳六烯酯[7-8];酰氯法通常是将有机酸转变为酰氯,酰氯再与胆固醇反应得到相应的胆甾醇酯[9-10],产率为70%~93%[11-12];缩合法是用缩合试剂促进羧酸和醇的反应[13-14]。
酶法的合成效果较好,但酶价格昂贵;酸酐法需要自制辛酸酐-13C,其合成较为繁琐,收率偏低;酰氯法的产率高,但酰氯过量较多;缩合法具有反应条件温和、合成路线短等优点。综上所述,缩合法较为适宜。缩合法的反应机理是羧酸被缩合试剂活化,活化的羧酸再与胆固醇反应生成酯。为提高反应产率,加酯化催化剂可以进一步活化羧基,促进反应进行。
1 实验材料
1.1 主要仪器与装置
高效液相色谱仪(HPLC):仪器为日本岛津公司产品,配LC-20AT进样器;蒸发光检测器(ELSD):上海通微公司产品;色谱柱(Shim-Pack, HRC-SIL 4.6 mm×25 cm):日本岛津公司产品;TSQ Quantum Access液相色谱-质谱联用仪(LC-MS):美国Thermo Electron公司产品,配有电喷雾离子源(ESI)及Xcalibur3.1数据处理系统;HP 1100高效液相色谱系统:美国惠普公司产品,配有可变波长紫外检测器和N2000色谱工作站(浙江大学);WZZ-2B型自动旋光仪:上海精密科学仪器有限公司产品;Vance DSX-500核磁共振波谱仪(1H NMR):德国Bruker公司产品。
1.2 主要试剂
胆固醇(Ch-OH):分析纯,上海晶纯试剂有限公司产品;辛酸-1-13C:自制,13C同位素丰度为98.6 %13C,化学纯度为98.0%[18];N,N’-二环己基碳二亚胺(DCC)、叔胺、N,N’-二异丙基碳二酰亚胺(DIC):分析纯,上海共价化学科技有限公司;辛酸、正己烷、二氯甲烷、乙酸乙酯:分析纯,上海凌峰化学试剂有限公司产品;石油醚:分析纯,江苏强盛化工有限公司产品;胆甾醇辛酸酯13C标准样品:
2 实验方法
2.1 胆甾醇辛酸酯-13C的合成
缩合剂法合成胆甾醇酯-辛酰基-1-13C(ChO-13C)的反应式示于图1,在缩合剂的作用下,胆固醇(Ch-OH)与辛酸-1-13C反应,生成ChO-13C。
在两口烧瓶中加入胆固醇、辛酸、缩合剂,通氮气保护,搅拌一段时间,反应过程中采用TLC监测,产物使用硅胶柱分离提纯,TLC检测收集洗脱液,旋转蒸发洗脱液,得到白色固体产品。
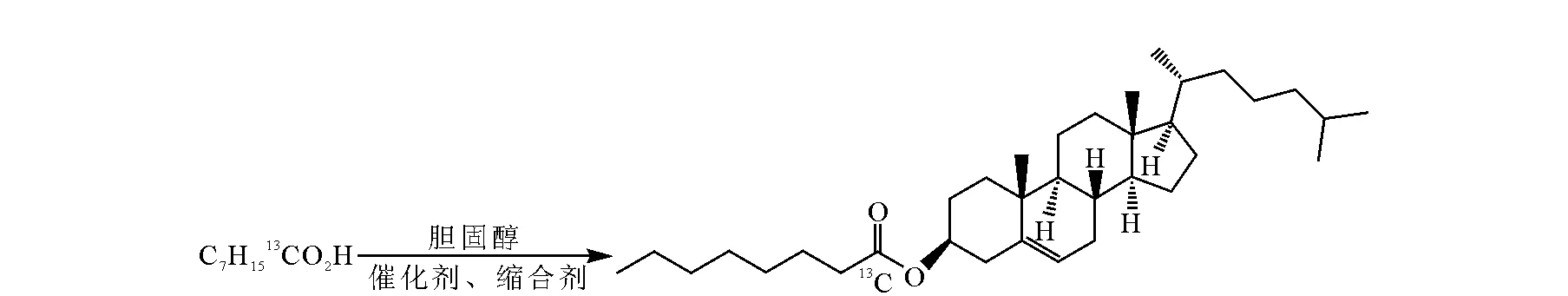
图1 缩合催化法合成胆甾醇酯-辛酰基-1-13CFig.1 Synthesis of cholesteryl octanoate-octanoyl-1-13C by a method of coupling-catalysis
2.2 胆甾醇辛酸酯-13C的表征
对合成的胆甾醇辛酸酯-13C产品进行HPLC-ELSD分析,分析条件为:流动相为V(正己烷)∶V(异丙醇)=99∶1,流速0.8 mL,柱压3.5 MPa;ELSD检测器,蒸发温度60 ℃,载气为空气,载气速度2.5 L/min。
采用LC-MS对合成的胆甾醇辛酸酯-13C进行结构和13C丰度测试,分析条件为:电喷雾电离方式(Electrospray Ionization, ESI),喷雾电压5 000 V,鞘气296 475 Pa,辅助气0 Pa,离子传输毛细管温度330 ℃,正离子Q1模式全扫描,质量扫描范围是m/z=35~800。
使用旋光仪对合成产品进行光学纯度测试,分析条件:三氯甲烷溶剂,C=2.0,24 ℃,样品的光学纯度P由下式计算
P=[α]样品24/[α]标样24×100%
其中 [α]样品24和[α]标样24分别表示在24 ℃时样品和标样的比旋光度
采用1H NMR对合成的ChO-13C进行结构分析,检测条件:500 Hz,CDCl3溶剂。
3 结果与讨论
3.1 DCC为缩合剂的合成实验
3.1.1辛酸用量对反应的影响
辛酸用量对反应的影响列于表1。以DCC为缩合剂,叔胺为酯化催化剂,产物经HPLC和LC-MS分析为目标化合物,表明该方法可行。1#产品纯度低,过硅胶柱分离时收集到未反应的胆固醇,产品的纯度和产率都较低,2#和3#的产品纯度均为99.9%,但2#的辛酸利用率较3#高。因此,选择辛酸过程10%的条件。
3.1.2DCC用量对反应的影响
DCC用量对ChO合成的影响结果列于表2。提高DCC用量,以促进反应进行,2#反应产物中有过量的胆固醇,提高DCC用量为1.5倍和2.5倍,产率基本无变化。
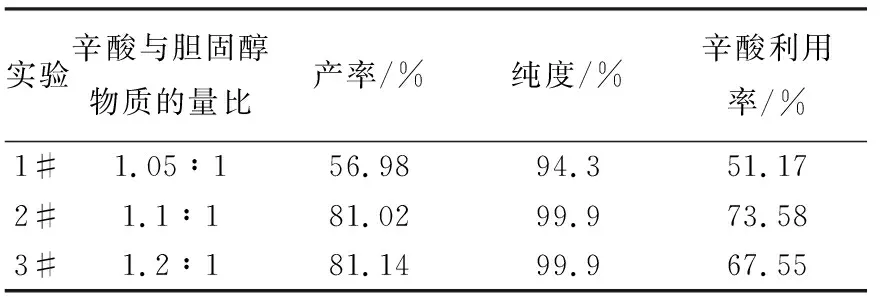
表1 辛酸用量对反应的影响
注:反应条件为辛酸∶DCC∶叔胺=1∶1∶1(物质的量比);每克胆固醇的二氯甲烷溶剂为31 mL;室温,TLC确定合成时间约为24 h

表2 DCC用量对合成ChO影响
注:反应条件为辛酸∶胆固醇∶叔胺=1.1∶1∶1.1(物质的量比);其余同表1
3.2 DIC为缩合剂的合成实验
3.2.1DIC用量的影响
DIC用量对合成的影响列于表3。DIC代替DCC进行合成,其用量增加,产率有所提高,DIC与辛酸物质的量比值从1.0增加为1.5,产率从81.8%提高至84.3%,较DCC缩合剂的产率略有提高,比值增加至2.5时,产率提高为85.3%,但反应时为浑浊液,不利于合成。综上所述,选择缩合剂DIC与辛酸的物质的量比值为1.5较为适宜。
3.2.2温度对反应的影响
温度对反应的影响列于表4。ChO的合成反应通常在室温进行,温变化对反应的影响差别较小,属于实验误差范围(相对误差小于1.4%)。可见,温度对反应影响不大,一般为室温。
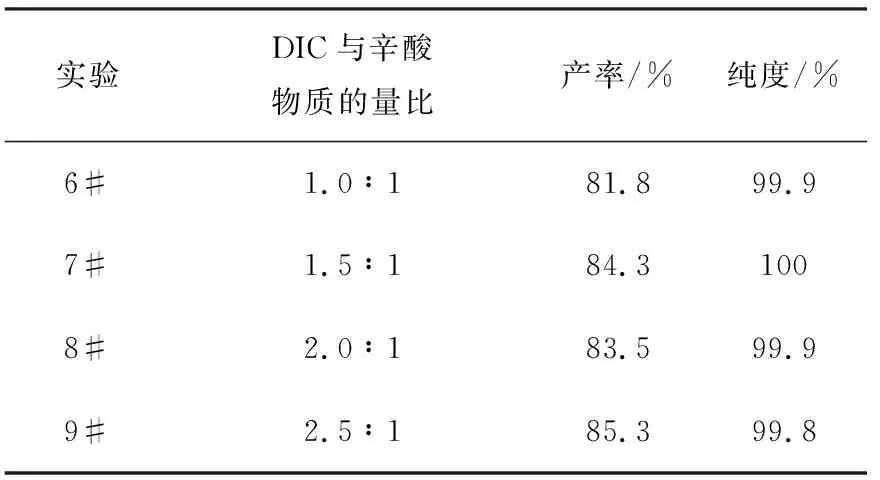
表3 DIC用量对合成的影响
注:反应条件为缩合剂DIC,其余条件同表2
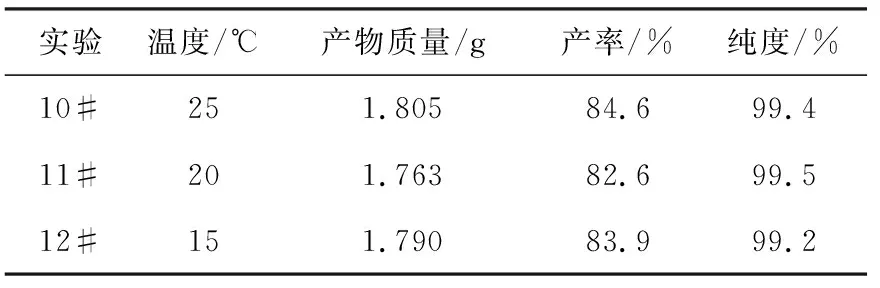
表4 温度对反应的影响
注:反应条件为DIC∶辛酸∶胆固醇=1.5∶1∶1.65(物质的量比),其余条件同表3
3.2.3正交设计优化
考察的试验因素和水平表列于表5。采用正交设计进一步优化,实验结果列于表6。
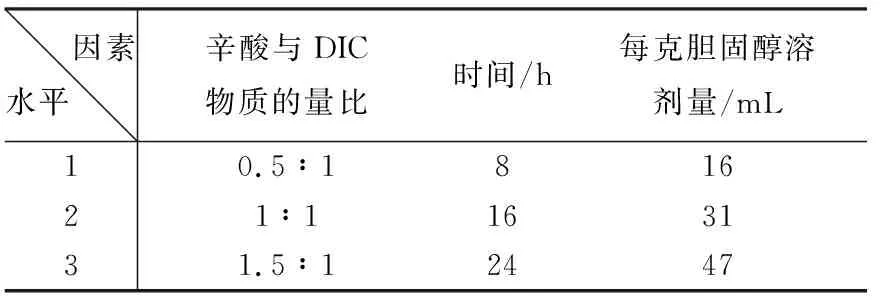
表5 试验的因素和水平表
方差分析表列于表7。正交设计方差分析表明,因素1反应的影响显著,因素2和因素3的影响不显著。优化实验条件为,因素1为1.5,因素2为24 ,因素3为31 。
对正交实验结果进行3次实验验证,平均产率为84.1%,相对误差小于1.1,纯度99.5%~100%。
3.3 丰度合成实验
以自制13C-辛酸为原料,按以上优化的条件,合成ChO-13C,产率84.1%,13C丰度为99.0%。
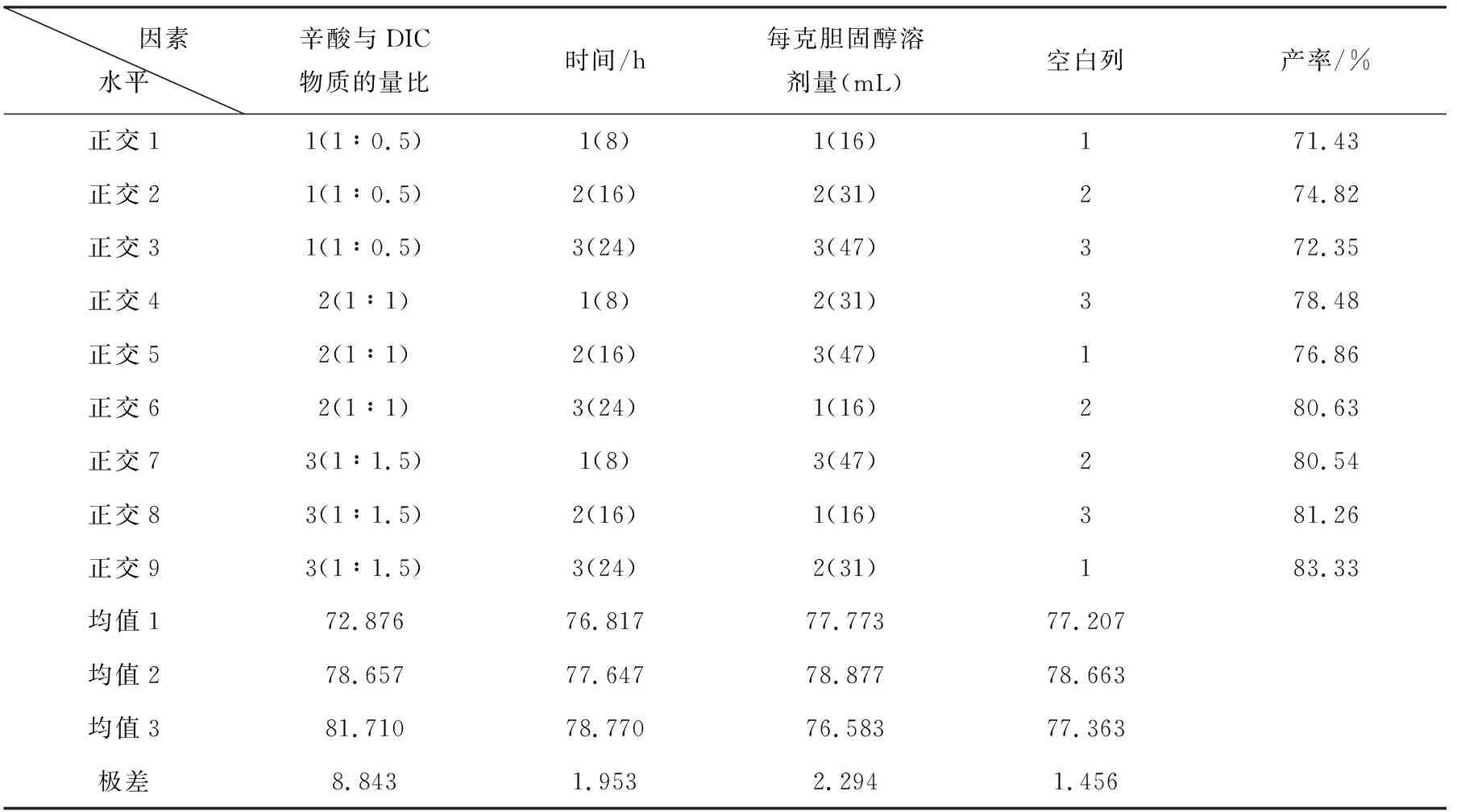
表6 ChO-13C合成试验设计方案及结果L9(34)
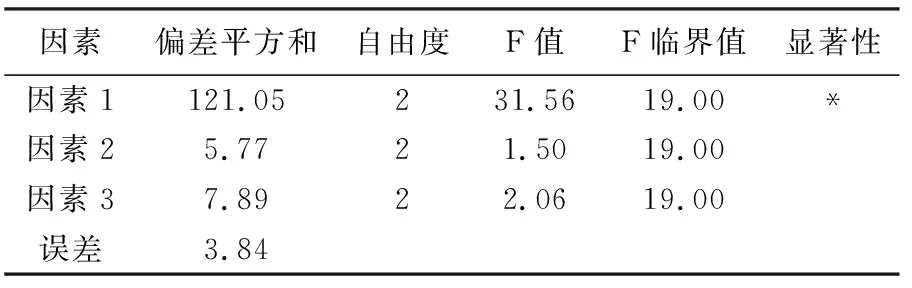
表7 方差分析表
3.4 结构分析
3.4.1HPLC分析
ChO-13C的HPLC-ELSD分析结果示于图2,产品的保留时间与标样基本一致,分别为42.98 min和43.32 min,可以确定产品为目的产物,由面积比计算,化学纯度为99.5%。
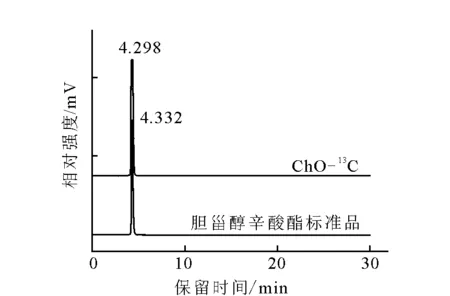
图2 ChO-13C的HPLC-ELSD分析Fig.2 HPLC-ELSD spectrum of ChO-13C
3.4.2LC-MS分析
ChO-13C产品的LC-MS的分析示于图3,m/z=536.49为[M+Na]峰(536.49≈513.84+23),369.35为胆固醇脱羟基的碎片,161.14也是碎片峰;天然丰度产品的准分子离子峰为535.49,536.49表示产品上了一个13C。可以确定样品是的胆甾醇辛酸酯-13C。由收集的536.49峰和535.50峰数据计算,产品的13C丰度为99.0 %。
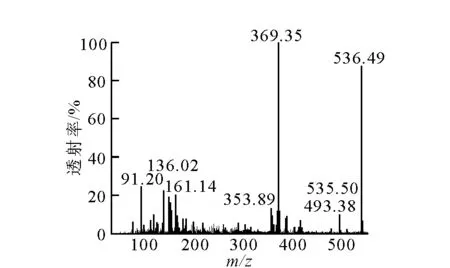
图3 ChO-13C的质谱图Fig.3 ESI-MS spectrum of ChO-13C
3.4.3光学纯度测试
由合成产品和标样的旋光度测试,光学纯度为99.0%。
3.4.4核磁共振分析
在胆甾醇辛酸酯上的氢原子的信号尽管较复杂,1H NMR 图谱上的数据基本与SDBS数据库[16]给出部分氢原子的归属一致。积分为61个氢,结构上是60个氢,在0.6~2.3区间积分有一定的误差(相对误差为1.67%)二者基本一致。可见,合成产品的1H NMR与胆甾醇辛酸酯的结构吻合,进一步确定是目标产物。
4 结 论
采用缩合法与催化法的组合方式,合成胆甾醇辛酸酯-辛酰基-1-13C,单因素优化与正交试验优化合成条件,在DIC:叔胺:辛酸:胆固醇=1.65∶1.65∶1.1∶1(物质的量比),每克胆固醇的二氯甲烷溶剂量31 mL,温度24 ℃,反应时间24 h时,产率为84.1%,13C丰度为99.0%,光学纯度为99.0%,化学纯度为99.5%。经HPLC-ELSD、LC-MS和1H NMR表征,所合成的产品为胆甾醇辛酸酯-辛酰基-1-13C。
参考文献:
[1] Ventrucci M, Cipolla A, Ubalducc GM, at al.13C labelled cholesteryl octanoate breath test for assessing pancreatic exocrine insufficiency[J]. Gut, 1998, 42: 81-87.
[2] McClean P, Harding M, Coward WA,et al.Bile Salt-Stimulated Lipase and Digestion of Non-Breast Milk Fat[J]. J Pediatr Gastroenterol Nutr, 1998, 26(1): 39-42.
[3] Lembcke B. Atemtests bei Darmerkrankungen und in der gastroenterologischen Funktionsdiagnostik (Breath tests in intestinal diseases and functional gastrointestinal diagnosis) [J]. Praxis, 1997, 36(1): 25-26.
[4] 孙蕴伟摘译.13C标记的胆固醇酰辛醇呼气试验评估胰腺外分泌不足[J].国外医学-消化系疾病分册,1998,4(1):249.
Xun Wenwei (Adapted translation).13C labelled cholesteryl octanoate breath test for assessing pancreatic exocrine insufficiency[J]. Inter J Dig Diseases. 1998,4(1): 249(in Chinese).
[5] Shaikh VAE, Maldar NN, Lonikar SV, et al. Th-ermotropic behavior of cholesterol linked polysaccharides[J]. J Appl Polym Sci, 1998, 70(1): 195-201.
[6] 武长城,李兰英,张栋,等,丁二酸单胆甾醇酯的合成研究[J].天津工业大学学报,2005, 24(6): 27-29.
Wu Changcheng, Li Lianying, Zhang Dong, et al. Research on synthesis of monocholesterylsuccinate[J]. J Tianjin Polytech Univ, 2005, 24(6): 27-29(in Chinese).
[7] Jonzo MD, Hiol A,Druet D, et al. Application of Immobilized Lipase from Candida rugosa to Synthesis of Cholesterol Oleate[J]. J Chem Technol Biotechnol, 1997, 69(4): 463-469.
[8] Shimada YY, Hirota, Baba T, et al, Enzymatic synthesis of steryl esters of polyunsaturated fatty acids[J]. J Am Oil Chem Soc, 1999, 76(6): 713-716.
[9] Lentz BR, Barenholz Y, Thompson TE. A simple method for the synthesis of cholesterol esters in high yield[J]. Chem Phys Lipids, 1975, 15( 2): 216-221.
[10] Ma J, Xuan YN, Huang Y. Synthesis and Characterization of A Novel Cholesteric Liquid Crystalline Containing Carboxyl Group[J]. Chin Chem Lett, 2005, 16(1): 127-130.
[11] Nagvekar DS,Delaviz Y, Prasad A, et al. Synthesis and Properties of Cholesteryl Esters Bearing 32- and 16-Membered Crown Ethers[J]. J Org Chem, 1996, 61(4):1 211-1 218.
[12] 顾树珍,杨新浩,华曦,等.胆甾醇酯类液晶的合成[J].化学世界,1990,7:308-311.
Gu Shuzhen, Yang Xinhao, Hua Xi, et al. Preparation of Cholesteryl Ester Liquid Crystals[J]. Chem World, 1990,7: 308-311(in Chinese).
[13] Zhang DW, Huang W, Pan GH, et al. Synthesis and characterization of non-symmetrical liquid crystals containing a cholesteryl ester moiety[J]. Chinese Chemical Letters, 2009, 20(5): 562-565.
[14] Boechzelt H, Karten B, Abuja PM, Synthesis of 9-oxononanoyl cholesterol by ozonization[J]. J Lipid Res, 1998, 39(7): 1 503-1 507.
[15] 侯秀红,卢伟京,卢浩,等.一种辛酸-1-13C的制备方法,中国200810203350[P]. 2008-12-02.
[16] Spectrol Database for Orgcnic Compounds (SDBS数据库)[DB].SDBS NO为7836.

