188Re直接标记单克隆抗体TGLA及其生物学评价
温 凯,张君丽,陈宝军,陈大明,崔海平
(原子高科股份有限公司,北京 102413)
单克隆抗体的问世极大地促进了抗体在各个领域的应用,但单克隆抗体大部分为鼠源性抗体,作为异种蛋白会诱发人体产生免疫反应,目前,临床上的应用只局限于检测与诊断,在体内治疗上的应用发展缓慢。近年来,单克隆抗体的鼠源性问题己通过抗体人源化、噬菌体抗体库及转基因动物等技术得到解决,本实验所标记抗体为一种特异性靶向CD20的嵌合抗体,命名为TGLA。CD20是人类B淋巴细胞表面特有的标识,不会发生明显的内化和脱落,是治疗非霍奇金淋巴瘤理想的靶抗原。嵌合抗体TGLA能特异性的结合CD20,并可通过CDC 和ADCC作用特异性地杀伤CD20+人B细胞淋巴瘤Daudi和Raji细胞;同时能够抑制Raji肿瘤细胞生长[1]。抗CD20单克隆抗体作为一种新的有效抑制肿瘤细胞增长的治疗方案,已应用于临床治疗B细胞淋巴瘤。
188Re标记的单克隆抗体已大量用于肿瘤的显像与治疗。Re和Tc同处于周期表第Ⅶ族,具有类似活泼的化学性质,像Tc一样可以形成许多稳定的配合物。188Re通过188W-188Re发生器生产,简便易得,更重要的是,188Re的半衰期为16.9 h,188Re[2]放射出的2.12 MeV (71.4%) 和1.96 MeV (25.8% ) β射线可以用于治疗,向肿瘤传递较高的辐射剂量,并对靶向肿瘤细胞附近的抗原表达阴性的非靶向肿瘤细胞也有杀伤作用,同时可以利用155 keV (15.0% ) 的γ射线进行显像。
本实验应用直接标记法[3-7]对TGLA进行188Re标记,制备得到188Re-TGLA,对标记条件进行优化,研究188Re-TGLA在荷淋巴瘤裸鼠体内的生物分布。
1 实验材料
1.1 主要试剂
单克隆抗体TGLA:军事医学科学院提供;188Re淋洗液:原子高科股份有限公司生产的188W/188Re发生器制备;葡萄糖酸钠、SnCl2·2H2O、NaHSO3、抗坏血酸:国药集团化学试剂北京有限公司。
1.2 主要仪器
FT-603井型γ闪烁探测器、FH463A自动定标器:北京核仪器厂;BS110S分析天平:德国赛多利斯公司。
1.3 实验动物
裸鼠:10只,鼠龄3周,体重18~22 g,由中国医学科学院肿瘤医院提供,腋下种植淋巴癌细胞株,肿瘤直径约0.5 cm时备用。
2 实验方法
2.1 188Re直接标记法
2.1.1TGLA的还原
取0.1 mL TGLA的PBS溶液(1 g/L, pH 5.0),10 μL 0.16 mol/L NaHSO3溶液,NaHSO3与单抗物质的量比为 1 500∶1,混合摇匀,室温下反应45 min。
2.1.2TGLA的188Re标记
用20 μL抗坏血酸(0.1 mol/L) 保护单抗还原溶液,然后加入175 μL 0.5 mol/L pH 5.0的葡萄糖酸钠溶液为缓冲液,并作为抗体标记的中间配体,50 μL 25 g/L SnCl2溶液(溶于0.05 mol/L HCl),最后加入100 μL Na188ReO4淋洗液(约5.6 MBq),反应2.5 h。
2.2 标记率的测定
以生理盐水体系和V(乙醇)∶V(氨水)∶V(水)=2∶1∶5混合溶液为展开体系,利用两展开体系的互补性测定188Re-TGLA标记率,其中,在生理盐水体系中188Re-TGLA及胶体Rf=0,188ReO4-的Rf=0.7。乙醇体系中的胶体Rf=0,而188Re-TGLA及188ReO4-的Rf=0.75。放射性HPLC柱填料为Bio-Sil SEC 250,流动相为0.1 mol/L PBS溶液,进样量10 μL。
2.3 标记条件的优化
(1)还原时间和SnCl2用量的选择
取175 μL 0.5 mol/L pH 5.0的葡萄糖酸钠溶液作为缓冲液,50 μL 25 g/L SnCl2溶液,加入100 μL 5.6 MBq的Na188ReO4淋洗液进行还原反应。分别取15、30、45、60 min时的反应液,以Whatman试纸为固定相,以生理盐水作为展开剂检测Na188ReO4还原率。测定还原时间对Na188ReO4还原率的影响。保持以上条件不变,分别取10、30、50、70、90 μL 25 g/L SnCl2溶液,还原反应45 min,测定SnCl2用量对188Re-TGLA标记率的影响。
(2)pH、中间配体和标记时间的选择
分别选用三种不同的中间配体:柠檬酸和酒石酸1∶5的混合溶液、柠檬酸、葡萄糖酸钠,在最佳标记条件下分别进行标记物的合成,测定Na188ReO4还原率与188Re-TGLA标记率。
保持其他反应条件不变,当反应pH为5.0时,分别考察标记时间为1.0、1.5、2.0、2.5 h时188Re-TGLA标记率;反应时间为2.5 h时,改变葡萄糖酸钠的pH,分别考察pH为4.0、4.5、5.0时188Re-TGLA标记率。
2.4 体外稳定性的测定
实验采用PBS法进行188Re-TGLA稳定性的测定,取150 μL含188Re-TGLA的试剂约5.6 MBq,置于1 mL pH 5.0磷酸缓冲液中,恒温37 ℃下,分别孵育1、2、4、8、24 h后,纸层析法测定其放化纯度,以观察其体外稳定性。
2.5 荷瘤裸鼠体内分布
将制备的188Re-TGLA用凝胶柱纯化后备用。取正常小鼠10只,随机分成2组,每组5只,分别经尾静脉注射10 μL约7.4×105Bq 的188Re-TGLA生理盐水溶液,分别于注射后24 h、48 h时处死,取心、肝、脾、肺、肾、胃、小肠、肌肉、骨头、血、肿瘤等组织称重并测量计数。经衰变校正后计算各组织放射性摄取率(%ID/g)。
3 结果与讨论
3.1 188Re-TGLA标记率
188Re-TGLA的HPLC结果示于图1,由图1可见,188Re-TGLA保留时间为9.14 min,标准品的保留时间为11.39 min,188Re-TGLA标记率为93%。
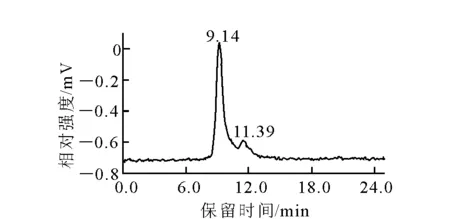
图1 188Re-TGLA的HPLC图谱Fig.1 HPLC chromatography of 188Re-TGLA
3.2 标记条件的选择
3.2.1还原时间对还原率的影响
还原时间对Na188ReO4还原率的影响结果示于图2。还原反应进行到45 min前,还原率逐渐升高,反应至45 min时达最大值87%,反应继续进行,还原率略有下降。这是由于反应时间过长,还原后的Re和Sn形成了Re-Sn胶体,影响了反应的进度,不利于反应的继续进行,影响最终的标记率,因此,最佳的还原时间选定为45 min。
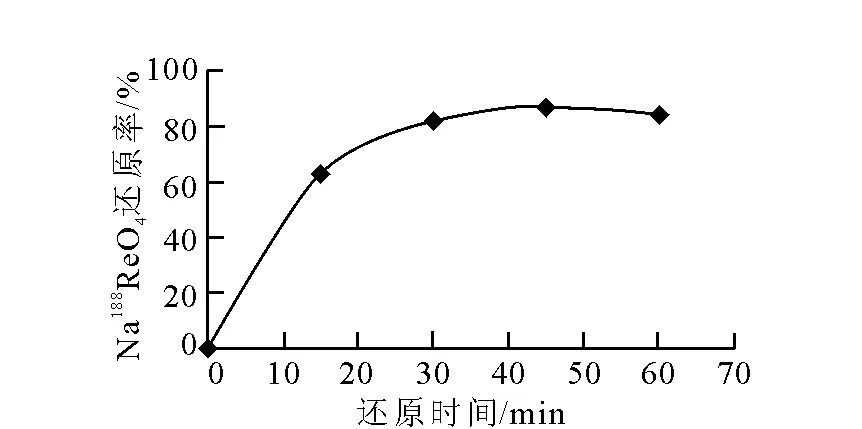
图2 还原时间对Na188ReO4还原率的影响Fig.2 Effect of reduction time on reduction rate
3.2.2SnCl2用量对Na188ReO4还原率的影响
由图3可见,随着SnCl2用量的增加,还原率不断上升,用量为1.25 μg时最高,之后随着SnCl2用量的不断增加,还原率略有下降,这是由于过量的Sn与Re生成胶体,使还原率降低。确定SnCl2用量为1.25 μg。
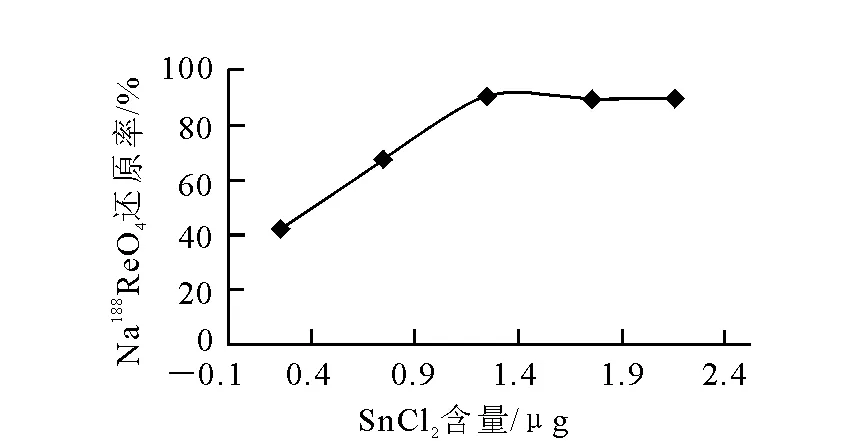
图3 SnCl2用量对Na188ReO4还原率的影响Fig.3 Effect of SnCl2 mass on reduction rate
3.2.3中间配体的选择
中间配体可与188Re 保持弱的络合作用,以使188Re处于稳定低价态,保证后续配位交换反应得以顺利进行。它又起着稳定Sn2+的作用,减少其水解。这三种中间配体的配合能力不同,与Re的结合能力不同。其中,柠檬酸和酒石酸都是结合能力强的配体,葡萄糖酸钠配位能力较弱,使Re顺利标记到抗体上,与柠檬酸盐、酒石酸盐相比,其标记实验条件易掌握、标记物稳定、放化纯度高。在标记反应中加入适量抗坏血酸保护溶液,稳定低价态的Re,增加标记物的体外稳定性,又可抑制疏基的氧化,提高标记率。
不同的配体下,188Re-TGLA的还原率与标记率列于表1,由表1可见,柠檬酸与酒石酸的混合配体溶液有一定的还原性,也可以进行标记,但是标记率与还原率都很低;柠檬酸的结合力很强,还原率高,但无法用于标记;葡萄糖酸钠具有较高的还原率,而且标记率高。这可能是由于柠檬酸的结合能力强,使还原后的Re很难与抗体结合,而葡萄糖酸钠的配合能力相对较弱,可以将还原后的Re标记到抗体上。
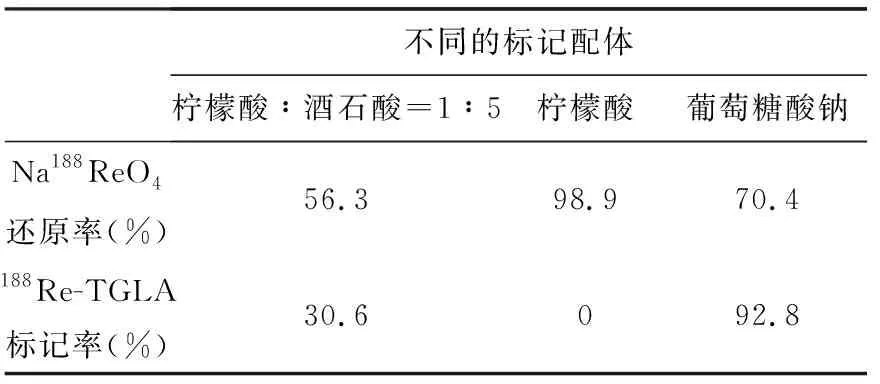
表1 不同配体进行标记的还原率与标记率
3.2.4标记时间对标记率的影响
标记时间对标记率的影响结果示于图4。反应2 h,标记率随时间的增长不断升高,到2 h标记率趋于稳定,标记率最高达87%,继续反应标记率略有下降。因此,选择标记时间为2~2.5 h,反应时间过长,Re与Sn可能会产生胶体,影响标记率。
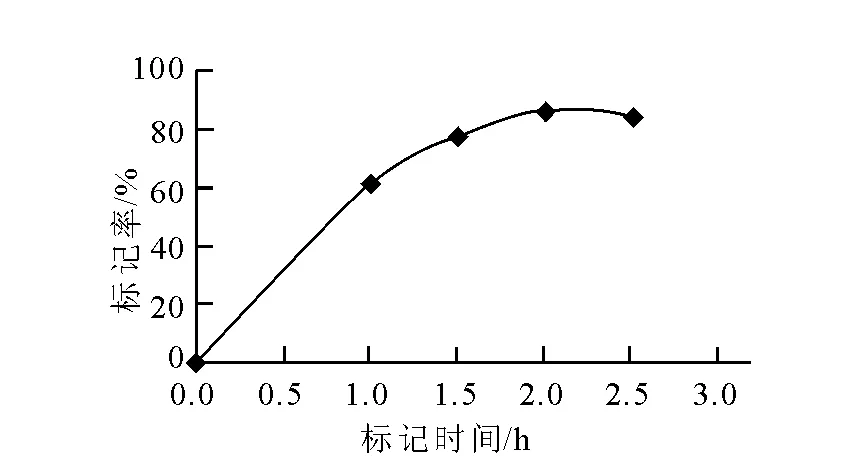
图4 标记时间对标记率的影响Fig.4 Effect of labeling time on labeling yield
3.2.5pH对标记率的影响
由于SnCl2必须存在于酸性溶液中, pH的范围选定必须在5.5以下,为了保证抗体的活性,避免Re形成胶体,pH必须保持在3.5以上。因此,在实验中选定了pH 4.0、4.5、5.0三个点测定其标记率。结果显示,pH对标记率的影响不大,为了减少胶体的产生,选择pH为5.0。
3.3 体外稳定性
188Re-TGLA体外稳定性结果示于图5。由图5可以看出,在24 h内其放化纯度保持较好,仍≥85%,基本维持稳定。结果表明,188Re-TGLA的体外稳定性较好。
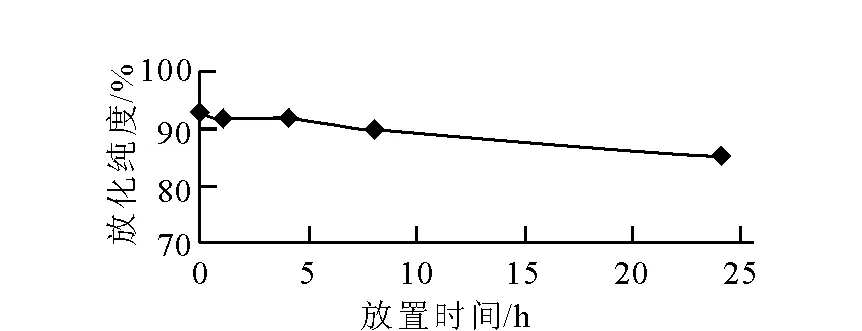
图5 188Re-TGLA体外稳定性Fig.5 188Re-TGLA’s vitro stability
3.4 188Re-TGLA在荷淋巴瘤裸鼠体内的分布
188Re-TGLA在荷淋巴瘤裸鼠体内的分布结果列于表2。由表2可见,在给药24 h后,该药物在肿瘤摄取较高,血液和肝脏和肾脏摄取较高,在脾,肺等器官也有一定的摄取。在48 h后,血液中仍有较强摄取,肿瘤的摄取降低,肝脏仍有一定的摄取,肝清除较慢,其他器官的摄取降低。此数据表明,该抗体在肿瘤中有一定的摄取,在肝脏有一定的富集,血液24 h摄取较高,清除较慢,48 h摄取有明显下降。由于该抗体在血液中的清除速度较慢,生物半衰期较长,在24 h并未到达各脏器及肿瘤,导致肿瘤摄取较低,血液中仍有较高摄取。
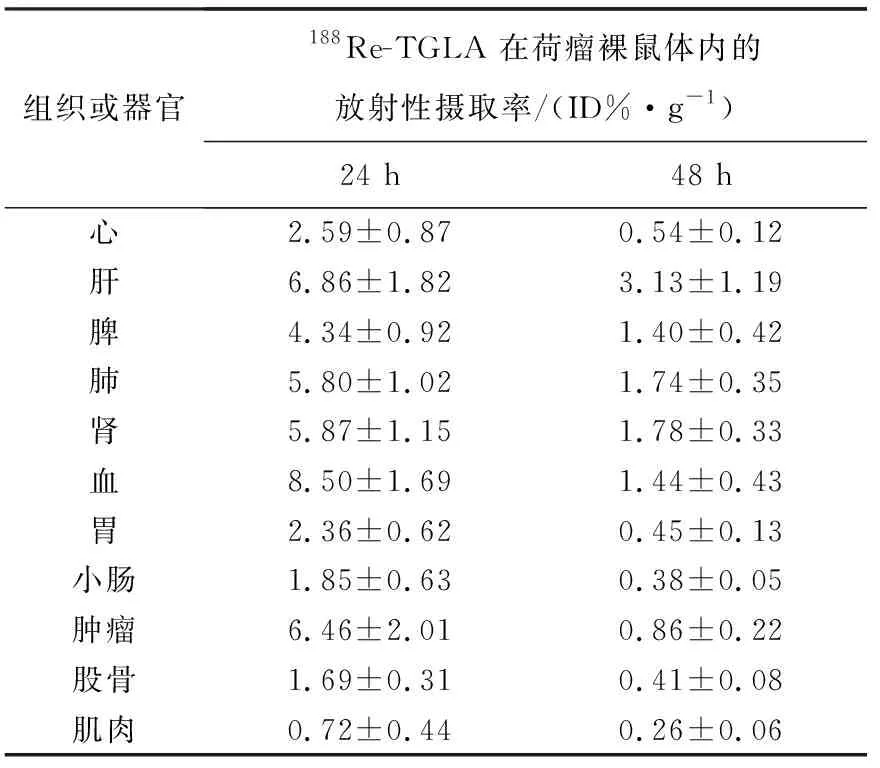
表2 188Re-TGLA的荷瘤裸鼠体内分布
肿瘤与其他器官的放射性摄取比(T/NT)列于表3中,由表3可见,各器官的T/NT随时间的增长均下降,这说明该药物在肿瘤中最佳的显像时间是24 h以内,在体内清除较慢,而且188Re的半衰期为16.9 h,相对于抗体的生物半衰期而言,188Re半衰期较短,对于显像来说是一个不利因素;在肝脏中清除较慢,停留时间较长,也增加病人所承受的剂量。减少抗体的体内半衰期,可以使用单克隆抗体的片段进行标记,与188Re的半衰期匹配,以达到更好的显像效果。
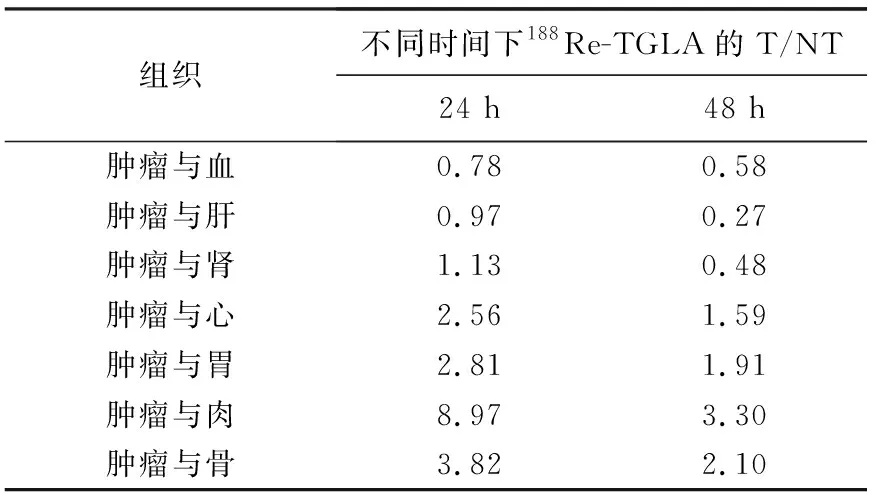
表3 188Re-TGLA在荷瘤裸鼠体内的T/NT
4 结 论
本实验通过优化188Re直接标记条件,标记率达93%,荷瘤裸鼠体内分布实验结果显示,在肿瘤有一定的摄取,肝肾也有较强的摄取,但在血液中清除较慢。这是由于188Re的半衰期较短,相对TGLA的生物半衰期较长,单克隆抗体TGLA的血液清除速度较慢,到达肿瘤的时间较长,导致在肿瘤的摄取并未达到预期效果,而且在肝脏的清除较慢也增加了患者的剂量。在今后的实验中可以尝试采用188Re直接标记抗体片段,降低抗体的生物半衰期,匹配188Re的半衰期,以达到更好的显像效果。
参考文献:
[1] 耿树生 孙瑛勋 谷欣,等. 新型抗CD20 嵌合抗体TGLA 体内、外活性的研究[C]. 第九届全国生物治疗会议,2006:48-49.
[2] 刘文彬,李玉,张汉文.188Re 标记单克隆抗体3H11的条件研究及其在荷瘤裸鼠体内的生物分布[J]. 同位素,1999,4(12):208-211.
Liu Wenbin, Li Yu, Zhang Hanwen. Study on labeling conditions of monoclonal antibody 3H11 with188Re and its biodistrybution in tumor-bearing nude mice[J]. Journal of Isotopes,1999,4(12):208-211(in Chinese).
[3] 吾为一,范我,鲍君杰,等.188Re标记抗CEA单克隆抗体及荷瘤裸鼠治疗实验研究[J]. 核技术,2002,11(25):953-956.
Wu Weiyi, Fan Wo, Bao Junjie, et al.188Re labelling of the anti-CEA monoclonal antibody and its herapeutic study in nude mice bearing tumor[J]. Nuclear Technology. 2002,11(25):953-956(in Chinese).
[4] 张智勇,王祥云,吴永慧.188Re直接标记单克隆抗体[J]. 核化学与放射化学,1998,3(20):172-174.
Zhang Zhiyong, Wang Xiangyu, Wu Yonghui. Direct labeling of monoclonal antibody with188Re[J]. Journal of Nuclear and Radiochemistry,1998,3(20):172-174(in Chinese).
[5] 章斌.188Re直接标记Octreotide的方法学[J]. 国外医学·放射医学核医学分册, 2002,26(5):220-222.
Zhang Bin. Investigations of directly labelling octreotide with188Re[J]. Foreign Medical Sciences(Section of Radiation Medicine and Nuclear Medicine),2002,26(5):220-222(in Chinese).
[6] 许风华,周伟,胡伟青,等.188Re直接标记抗体方法研究[J]. 同位素, 2009,1(22):18-22.
Xu Fenghua, Zhou Wei, Hu Weiqing, et al. Study of direct labeling antibody wth188Re[J]. Journal of Isotopes,2009,1(22):18-22(in Chinese).
[7] 章斌,吴翼伟,范我,等.188Re直接标记牛血清白蛋白的方法学研究[J]. 中国航天医药杂志,2003,5(4):23-25.
Zhang Bin, Wu Yiwei, Fan Wo, et al. Investigations of directly labeling BSA with Rhenium-188[J]. Medical Journal of CASE,2003,5(4):23-25(in Chinese).
[8] 黄丽琼,饶国辉.188Re 标记放射性药物在肿瘤治疗中的研究进展[J]. 中国热带医学. 2009 ,9(9):1 919-1 920.
Huang Liqiong, Rao Guohui. Application of rhenium-188 labeled radiopharmaceuticals for cancer treatment[J]. China Tropical Medicine,2009 ,9(9):1 919-1 920(in Chinese).
[9] 李贵平,张辉.188Re标记单克隆抗体的应用研究进展[J]. 放射免疫学杂志,2003,16(2):113-115.
[10] 许凤华,尹端沚,汪勇先.188Re 标记生物分子研究进展[J]. 核技术,2008,12(38):932-936.
Xu Fenghua, Yin Duanzhi, Wang Yongxian. Recent progresses in188Re labeling biomolecules [J]. Nuclear Technology,2008,12(38):932-936(in Chinese).
[11] Dadachova E.,Mirzadeh S. The role of tin in the direct labeling of proteins with rhenium-188[J]. Technical Notes,1997:605-608.

